
- •Федеральное агентство по образованию
- •Программа дисциплины
- •2.3. Кинетическая сторона химических реакций
- •3. Растворы. Электрохимические процессы
- •3.1. Растворы
- •3.2. Окислительно-восстановительные процессы. Электрохимия
- •3.3. Коррозия и защита металлов и сплавов от коррозии.
- •5. Химия и охрана окружающей среды
- •Ионно-молекулярные (ионные) реакции обмена
- •В кислой среде и.
- •Гидролиз соли, образованной сильной кислотой и слабым основанием.
- •Жёсткость природных вод и её устранение.
- •Примеры решения типовых задач.
- •Задача. Сколько граммов содержится в воды, если жесткость, обусловленная присутствием этой соли, равна ?
- •1.2. Окислительно-восстановительные реакции
- •Примеры решения типовых задач.
- •Задача. Составьте уравнение окислительно-восстановительной реакции между перманганатом калия и сульфитом натрия в среде серной кислоты.
- •Переходим к молекулярной форме уравнения:
- •1.3. Электрохимические процессы
- •Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать.
- •Электролиз
- •Для расчетов используют математическое выражение обобщенного закона Фарадея:
- •Примеры решения типовых задач.
- •Коррозия и защита металлов и сплавов от коррозии
- •Примеры решения типовых задач
- •1.5. Комплексные соединения
- •Примеры решения типовых задач.
- •1.6. Задачи
- •Определите рН 0,001 м раствора кон, считая диссоциацию полной.
- •Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений:
- •При сливании растворов иобразуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде.
- •Водородный показатель (рН) 0,003н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли и напишите уравнения реакций гидролиза в молекулярном и ионном виде.
- •Определите степень гидролиза (для первой ступени) и рН в 0,001м растворе и. Напишите уравнения реакций в молекулярном и ионном виде.
- •II. Варианты контрольной работы № 2
- •Продолжение
- •III. Приложение
- •IV. Содержание
Примеры решения типовых задач.
Пример 1. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Задача. Составьте уравнение окислительно-восстановительной реакции окисления дисульфида серы (II) кислородом.
Решение. Продуктами этой реакции являются SO2 и Fe2O3. Соответственно степень окисления железа изменяется от +2 до +3, степень окисления серы – от –1 до +4, степень окисления кислорода – от 0 до –2. Можно видеть, что функцию восстановителя в этой реакции выполняют совместно Fe2+ и S22-, функцию окислителя – О2. В этой связи представим реакции окисления и восстановления схемой:
-
11
О2 + 4е
 2 О2-
2 О2-восстановление, окислитель О2
4
Fe2+ – 1е
 Fe3+
Fe3+S22- – 10е
 2 S4+
2 S4+окисление, восстановитель FeS2
4
FeS2
+
11О2
![]() 2 Fe2O3
+
8 SO2
2 Fe2O3
+
8 SO2
По числу принятых кислородом и отданных FeS2 электронов определяем коэффициенты перед окислителем и восстановителем. С учетом поэлементного баланса находим коэффициенты перед формулами продуктов реакции.
Пример 2. Составление уравнений окислительно-восстановительных реакций методом электронно-ионного баланса.
Задача. Составьте уравнение окислительно-восстановительной реакции между перманганатом калия и сульфитом натрия в среде серной кислоты.
Решение. KMnO4 и Na2SO3 – сильные электролиты, поэтому в растворе они практически полностью диссоциируют на ионы. Окисляющим началом является анион MnO4– , в котором марганец находится в степени окисления +7. В то же время у серы в сульфит-анионе имеется ресурс окисления до сульфат-аниона, поэтому он является восстановителем. Известно, что в кислой среде перманганат-анион восстанавливается до Mn2+. Поэтому уравнения полуреакций записываются в виде:
-
2
MnO4 – + 8Н+ + 5е
 Mn2+
+ 4 Н2О
Mn2+
+ 4 Н2Овосстановление,
окислитель KMnO4
5
SО32– + Н2О – 2е
 SО42–
+ 2Н+
SО42–
+ 2Н+окисление, восстановитель Na2SO3
2MnO4
– + 16Н+
+
5SО32–
+5Н2О![]() 2Mn2+
+ 8 Н2О
+ 5SО42–
+ 10Н+
2Mn2+
+ 8 Н2О
+ 5SО42–
+ 10Н+
Можно видеть, как пара Н+ – Н2О осуществляет перераспределение кислорода между реагентами и продуктами реакции.
Коэффициенты перед строками уравнений полуреакций отражают требования электронного баланса: количество электронов, принятых окислителем должно быть равно количеству электронов, отданных восстановителем. Суммирование левых и правых частей уравнений реакций с учетом умножения их на указанные коэффициенты дает уравнение окислительно-восстановительной реакции в ионно-молекулярной форме, приведенное под чертой. Сокращение подобных членов в этом уравнении приводит к более компактной его форме
![]()
Переход
к молекулярной форме приводит к
окончательному виду уравнения:
![]() .
.
Пример 3. Составление уравнений окислительно-восстановительных реакций, протекающих в нейтральной среде.
Задача. Составьте уравнение окислительно-восстановительной реакции между сульфатом марганца(II) и перманганатом калия.
Решение. Продуктом
этой реакции
является MnO2,
следовательно, в роли окислителя
выступает анион
![]() ,
а восстановителя –
,
а восстановителя –![]() .
Составляем уравнение полуреакции,
учитывая, что в левой части этих уравнений
в качестве перераспределителя кислорода
выступает вода.
.
Составляем уравнение полуреакции,
учитывая, что в левой части этих уравнений
в качестве перераспределителя кислорода
выступает вода.
-
2
MnO4 – + 2Н2О + 3е
 MnО2
+ 4ОН
–
MnО2
+ 4ОН
–восстановление,
окислитель MnO4–
3
Mn2+ + 2Н2О – 2е
 MnО2
+ 4Н+
MnО2
+ 4Н+окисление, восстановитель Mn2+
2MnO4
– +
10Н2О
+
3Mn2+
![]() 5MnО2
+ 8ОН –
+
12Н+.
5MnО2
+ 8ОН –
+
12Н+.
Суммирование левых и правых частей уравнений полуреакций с учетом умножения их строк на приведенные коэффициенты дает ионно-молекулярное уравнение, представленное под чертой. С учетом того, что рекомбинация 8Н + и 8ОН – в правой части этого уравнения дает 8 молекул воды, сокращаем воду в левой и правой частях и получаем уравнение
2MnO4
– + 2Н2О
+
3Mn2+
![]() 5MnО2
+ 4Н+.
5MnО2
+ 4Н+.
Переход к молекулярной форме приводит к окончательному виду уравнения:
![]() .
.
Пример 4. Составление уравнений окислительно-восстановительных реакций с участием органических соединений.
Задача. Составьте уравнение реакции окисления этилбензола перманганатом калия в нейтральной среде.
Решение. Роль
окислителя в этой реакции выполняет
перманганат-анион, а восстановителя –
этилбензол,
![]() .
В нейтральной среде перманганат-анион
переходит в
.
В нейтральной среде перманганат-анион
переходит в![]() ,
а этилбензол деструктивно окисляется
до бензойной кислоты и углекислого
газа. В этой связи уравнение полуреакций
записывается в виде
,
а этилбензол деструктивно окисляется
до бензойной кислоты и углекислого
газа. В этой связи уравнение полуреакций
записывается в виде
-
4
MnO4 – + 2Н2О + 3е
 MnО2
+ 4ОН
–
MnО2
+ 4ОН
–восстановление,
окислитель MnO4–
1
 +
4Н2О
– 12е
+
4Н2О
– 12е

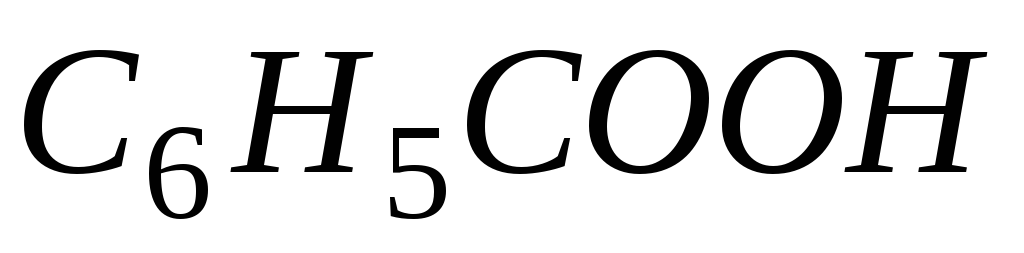 +
+
 +
12Н+
+
12Н+окисление, восстановитель

4MnO4
– +
12Н2О
+
![]()
![]() 4MnО2
+
4MnО2
+
![]() +
+![]() +
+ 12 Н2О
+
4ОН –
+
+ 12 Н2О
+
4ОН –
Сокращая воду в левой и правой частях полученного уравнения и учитывая взаимодействия
![]() +
ОН –
+
ОН –
![]()
![]() +
Н2О
+
Н2О
![]() +
2ОН –
+
2ОН –![]()
![]() +
Н2О,
+
Н2О,
приходим к уравнению
4MnO4
– +![]()
![]() 4MnО2
+
4MnО2
+![]() +
+![]() +2Н2О+
ОН-
+2Н2О+
ОН-
