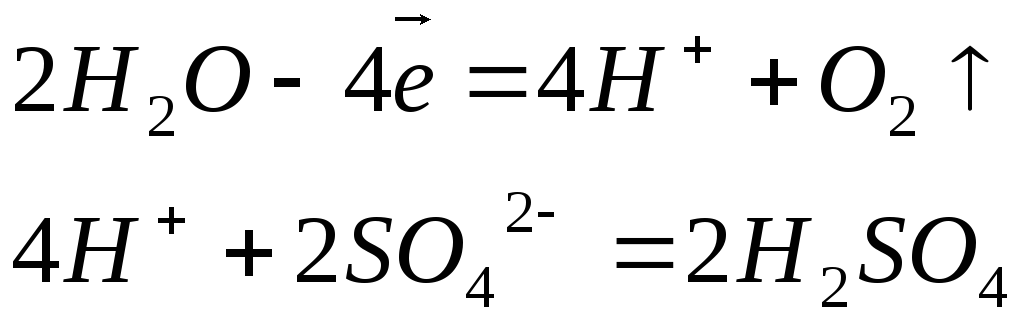- •Федеральное агентство по образованию
- •Программа дисциплины
- •2.3. Кинетическая сторона химических реакций
- •3. Растворы. Электрохимические процессы
- •3.1. Растворы
- •3.2. Окислительно-восстановительные процессы. Электрохимия
- •3.3. Коррозия и защита металлов и сплавов от коррозии.
- •5. Химия и охрана окружающей среды
- •Ионно-молекулярные (ионные) реакции обмена
- •В кислой среде и.
- •Гидролиз соли, образованной сильной кислотой и слабым основанием.
- •Жёсткость природных вод и её устранение.
- •Примеры решения типовых задач.
- •Задача. Сколько граммов содержится в воды, если жесткость, обусловленная присутствием этой соли, равна ?
- •1.2. Окислительно-восстановительные реакции
- •Примеры решения типовых задач.
- •Задача. Составьте уравнение окислительно-восстановительной реакции между перманганатом калия и сульфитом натрия в среде серной кислоты.
- •Переходим к молекулярной форме уравнения:
- •1.3. Электрохимические процессы
- •Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать.
- •Электролиз
- •Для расчетов используют математическое выражение обобщенного закона Фарадея:
- •Примеры решения типовых задач.
- •Коррозия и защита металлов и сплавов от коррозии
- •Примеры решения типовых задач
- •1.5. Комплексные соединения
- •Примеры решения типовых задач.
- •1.6. Задачи
- •Определите рН 0,001 м раствора кон, считая диссоциацию полной.
- •Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений:
- •При сливании растворов иобразуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде.
- •Водородный показатель (рН) 0,003н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли и напишите уравнения реакций гидролиза в молекулярном и ионном виде.
- •Определите степень гидролиза (для первой ступени) и рН в 0,001м растворе и. Напишите уравнения реакций в молекулярном и ионном виде.
- •II. Варианты контрольной работы № 2
- •Продолжение
- •III. Приложение
- •IV. Содержание
Электролиз
Электролизом называют окислительно-восстановительные реакции, протекающие на электродах при прохождении электрического тока через растворы или расплавы электролитов.
При электролизе электрод, соединенный с отрицательным полюсом внешнего источника постоянного тока, называется катодом (на нем идет восстановление), соединенный с положительным полюсом источника тока – анодом (на нем идет окисление).
В любом растворяемом в воде электролите под влиянием полярных молекул воды или под влиянием нагрева безводного электролита наблюдается процесс диссоциации его молекул на ионы. Поэтому при погружении в электролит электродов, соединенных с источником тока, происходит направленное перемещение ионов: катионов (положительно заряженных ионов) к катоду, анионов (отрицательно заряженных ионов) - к аноду. Например, при электролизе раствора или расплава хлорида натрия (NaCl) ионы Na+ перемещаются к катоду (К–), а ионы Cl- – к аноду(А+).
Различают растворимые и нерастворимые аноды. К первым относятся аноды, изготовленные из угля, графита или благородных металлов (золота, платины, палладия и т.п.). В этом случае к анодам перемещаются анионы кислотных остатков, и протекает соответствующий окислительный процесс. Например:
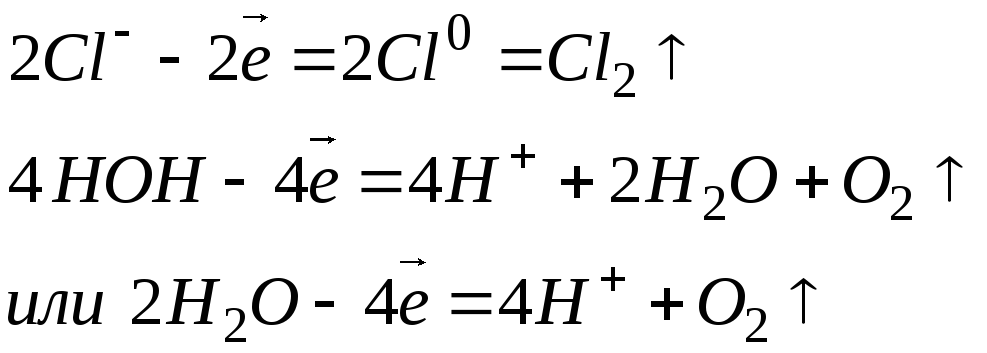
К растворимым анодам относятся аноды, изготовленные из любых металлов, кроме благородных. В этом случае происходит окисление (растворение) самого анода. Например, на медном аноде протекает следующий процесс:
![]()
Для решения вопроса о составе полученных при электролизе продуктов необходимо учесть порядок восстановления катионов на катоде и анионов на аноде. Восстанавливающийся на катоде катион называется окислителем, окисляющийся анион – восстановителем.
Руководствуясь вторым началом термодинамики, таблицей стандартных электродных потенциалов металлов и ее свойствами, утверждающими, что окислительная способность катионов возрастает сверху вниз, а восстановительная способность атомов металлов – снизу вверх, в простейших случаях можно установить следующий порядок восстановления катионов на катоде.
В первую очередь восстанавливаются катионы металлов с наиболее положительными значениями стандартных электродных потенциалов (от золота до сурьмы включительно). Например:
![]()
Во вторую очередь преимущественно восстанавливаются катионы металлов, занимающих в ряду напряжений среднее положение (от вольфрама до марганца). Например:
![]()
Вместо
всех остальных активных металлов,
расположенных выше марганца,
восстанавливаются молекулы воды с
образованием на катоде газообразного
водорода
 ,
что связано с большим перенапряжением
восстановления указанных металлов:
,
что связано с большим перенапряжением
восстановления указанных металлов:
![]()
Пользуясь рядом стандартных окислительно-восстановительных потенциалов, можно приближённо установить порядок окисления анионов на аноде:
В первую очередь окисляются анионы бескислородных кислот(S2-, I–, Br–, Cl–, CN–), за исключением иона фтора. Например:
![]()
Во вторую очередь окисляются молекулы воды по уравнению:

В третью очередь окисляются анионы бескислородных кислот. Например:

В
случае растворимого анода происходит
его окисление (см. выше). В случае
протекания вышеперечисленных процессов
по второму началу термодинамики система
переходит в состояние с минимальным
запасом энергии, т.е. её изобарно-изотермический
потенциал
![]() понижается
понижается![]() .
.
Рассмотрим примеры различных случаев электролиза.
Примеры электролиза растворов электролитов
с нерастворимыми анодами.
Электролиз раствора хлорида меди
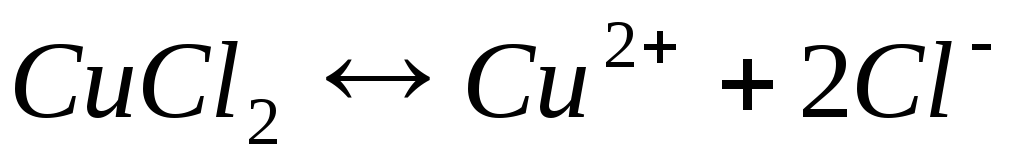
|
Катодный процесс (-) |
|
Анодный процесс (+) |
|
|
|
|
Продукты, образующиеся при электролизе на электродах в результате электрохимических реакций, называются первичными продуктами электролиза.
Электролиз раствора сульфата цинка

|
Катодный процесс (-) |
|
Анодный процесс (+) |
|
|
|
|
|
|
|
|
Продукты, образующиеся в растворе у электродов в результате вторичных реакций соединения, называются вторичными продуктами электролиза. В данном примере это образовавшаяся у анода серная кислота. Цинк и кислород, образовавшиеся на электродах, - первичные продукты электролиза.
Электролиз раствора хлорида натрия
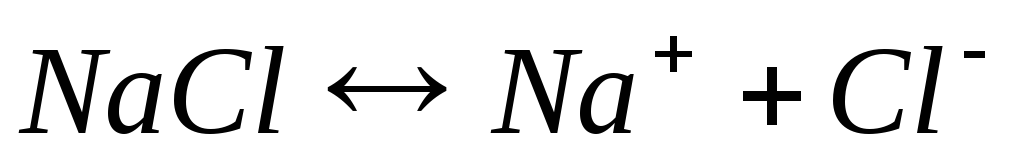
|
Катодный процесс (-) |
|
Анодный процесс (+) |
|
|
|
|
В приведённом примере первичными продуктами электролиза являются газы – водород и хлор, вторичными - гидроксид натрия, образовавшийся у катода.
4.
Электролиз раствора сульфата натрия
![]()
|
Катодный процесс (-) |
|
Анодный процесс (+) |
|
|
|
|
В данном случае, как и при электролизе кислородсодержащих кислот и щелочей, образуется 2 первичных (водород и кислород) и 2 вторичных (щелочь и кислота) продукта.
5.
Электролиз расплава хлорида натрия
![]()
|
Катодный процесс (-) |
|
Анодный процесс (+) |
|
|
|
|
Примеры электролиза растворов электролитов
с растворимыми анодами.
6. Рафинирование (очистка от примесей) анода, изготовленного из меди с примесями Zn, Sn, Ag.
Электролитом
в этом случае служит раствор соли меди,
анодом – медь, загрязненная примесями,
катодом – графит или пластинка из чистой
меди. Прилагаемое из внешнего источника
напряжение не превышает стандартный
электродный потенциал меди (![]() 0,4 В):
0,4 В):
![]()
-
Катодный процесс (-)
Анодный процесс (+)


Для растворения серебра величина используемого напряжения недостаточна, и поэтому оно в нейтральном состоянии остается на дне электролизера в виде рыхлого осадка (в шламе). Для осаждения примесей на медном катоде требуется большое перенапряжение, и поэтому они остаются в растворе.
Подобно рафинированию методом электролиза производится покрытие одного металла другим (гальваностегия), и наносятся металлические покрытия на неметаллические полупроводниковые подложки (гальванопластика).
Приведенные примеры находят широкое применение в промышленности.
Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.