- •Федеральное агентство по образованию
- •Программа дисциплины
- •2.3. Кинетическая сторона химических реакций
- •3. Растворы. Электрохимические процессы
- •3.1. Растворы
- •3.2. Окислительно-восстановительные процессы. Электрохимия
- •3.3. Коррозия и защита металлов и сплавов от коррозии.
- •5. Химия и охрана окружающей среды
- •Ионно-молекулярные (ионные) реакции обмена
- •В кислой среде и.
- •Гидролиз соли, образованной сильной кислотой и слабым основанием.
- •Жёсткость природных вод и её устранение.
- •Примеры решения типовых задач.
- •Задача. Сколько граммов содержится в воды, если жесткость, обусловленная присутствием этой соли, равна ?
- •1.2. Окислительно-восстановительные реакции
- •Примеры решения типовых задач.
- •Задача. Составьте уравнение окислительно-восстановительной реакции между перманганатом калия и сульфитом натрия в среде серной кислоты.
- •Переходим к молекулярной форме уравнения:
- •1.3. Электрохимические процессы
- •Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать.
- •Электролиз
- •Для расчетов используют математическое выражение обобщенного закона Фарадея:
- •Примеры решения типовых задач.
- •Коррозия и защита металлов и сплавов от коррозии
- •Примеры решения типовых задач
- •1.5. Комплексные соединения
- •Примеры решения типовых задач.
- •1.6. Задачи
- •Определите рН 0,001 м раствора кон, считая диссоциацию полной.
- •Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений:
- •При сливании растворов иобразуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде.
- •Водородный показатель (рН) 0,003н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли и напишите уравнения реакций гидролиза в молекулярном и ионном виде.
- •Определите степень гидролиза (для первой ступени) и рН в 0,001м растворе и. Напишите уравнения реакций в молекулярном и ионном виде.
- •II. Варианты контрольной работы № 2
- •Продолжение
- •III. Приложение
- •IV. Содержание
Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать.
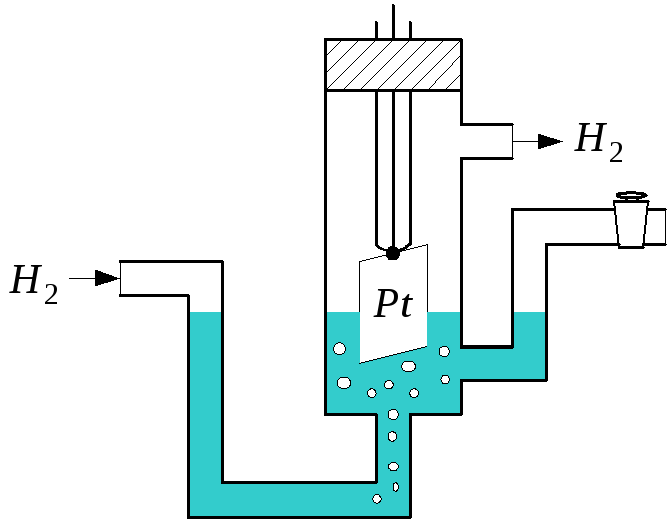
В качестве электрода сравнения используется так называемый водородный электрод (рис.2), потенциал которого при стандартных условиях
|
|
|
Рис.2 Схема водородного электрода |
![]() .
.
При измерении электродных потенциалов металлов составляют гальванический элемент из водородного электрода сравнения (анод) и исследуемого металлического электрода (катод) при стандартных условиях. Измеряемая в этом случае ЭДС гальванического элемента
![]() (
(![]() )
)
при
![]() отвечаетстандартному
электродному потенциалу металла
отвечаетстандартному
электродному потенциалу металла
![]() .
.
Стандартные электродные потенциалы металлов сведены в таблицу (ряд напряжений) (см. табл. 5). При значениях активностей, отличных от 1 моль/л, равновесные электродные потенциалы рассчитываются по уравнению Нернста:
![]() ,
,
где: аМеп+ – активность ионов металла в растворе;
R – универсальная газовая постоянная.
При небольших концентрациях растворов, применяемых в лабораториях, активность можно заменить концентрацией и после подстановки значений констант и параметров получить расчетное уравнение в виде
![]() .
.
Зависимость электродных потенциалов от концентрации широко используют для определения многих важнейших констант: произведения растворимости, константы нестойкости, ионного произведения воды, рН водных растворов. Для этих целей используют концентрационные цепи, в которых материал электродов одинаков, а отличны лишь концентрации растворов электролитов, содержащих соответствующие катионы. Например:
![]() ;
;
с1
< с2
;
![]() .
.
Можно построить совершенно аналогичную окислительно-восстановительную цепь с участием только ионов в каждом из процессов окисления и восстановления, при этом электроды инертные, а продукты реакции остаются в растворе и не выделяются на электродах. Например, в гальваническом элементе типа
![]()
переход электронов осуществляется от электрода с KNO2 к электроду с KMnO4, о чем свидетельствует измеритель напряжения. Для того чтобы составить уравнение электродной реакции, можно воспользоваться электронно-ионным способом, включая в уравнение только участвующие в реакции ионы, которые образуются при диссоциации сильного электролита, и молекулы слабых электролитов, в том числе воды. Уравнивание следует производить путем прибавления или отнятия молекул воды (ионов ОН– или Н+ для щелочной или кислой среды соответственно).
В приведенном примере анодом будет электрод с NO2–, а катодом – электрод с MnO4– в водном растворе. Поэтому реакция окисления на аноде записывается в виде
NО2–
+ Н2О
– 2е
![]() NО3–
+ 2Н+,
NО3–
+ 2Н+,
реакция восстановления на катоде принимает вид
MnO4
–
+ 8Н+
+
5е
![]() Mn2+
+ 4 Н2О.
Mn2+
+ 4 Н2О.
Суммирование обеих полуреакций с учетом баланса электронов дает уравнение реакции в ионном виде:
-
2
MnO4 – + 8Н+ + 5е
 Mn2+
+ 4 Н2О
Mn2+
+ 4 Н2О5
NО2– + Н2О – 2е
 NО3–
+ 2Н+
NО3–
+ 2Н+
2MnO4
– + 6Н+
+
5NО2–
![]() 2Mn2+
+ 3 Н2О
+ 5NО3–
2Mn2+
+ 3 Н2О
+ 5NО3–
или в молекулярном виде:
5KNО2
+
2KMnO4
+
3Н2
SO4
![]() 5KNО3
+
2MnSO4
+ K2SO4
+ 3 Н2О
5KNО3
+
2MnSO4
+ K2SO4
+ 3 Н2О
Величина потенциала каждого электрода может быть определена его сравнением с водородным электродом. Так как окислительно-восстановительные потенциалы зависят от концентраций, то такое сравнение принято проводить при концентрациях окисленной и восстановленной форм, равных 1 моль/л. В таблице стандартных окислительно-восстановительных потенциалов приводятся только потенциалы восстановления (для окислителя):
-
MnO4 – + 8Н+ + 5е Mn2+ + 4Н2О;
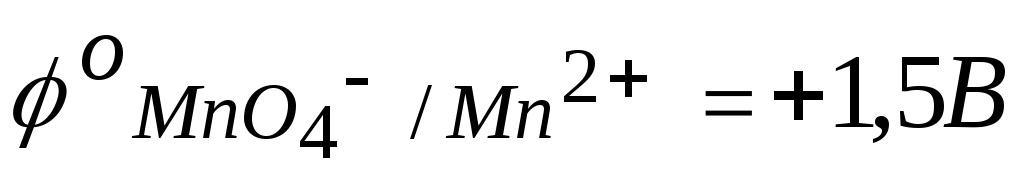
NО2– + Н2О – 2е NО3– + 2Н+;

Электродная
реакция, характеризующаяся меньшей
величиной потенциала, определяет
восстановитель и переписывается в
обратном направлении; при этом знак
потенциала меняется на обратный. Суммируя
электродные потенциалы, можно определить
величину ЭДС элемента, положительное
значение которой подтверждает возможность
самопроизвольного протекания реакции.
По найденной величине
![]() можно
рассчитать
можно
рассчитать![]() и
по уравнению изотермы Вант-Гоффа
определить константу равновесия К,
величина которой однозначно характеризует
глубину протекания процесса.
и
по уравнению изотермы Вант-Гоффа
определить константу равновесия К,
величина которой однозначно характеризует
глубину протекания процесса.
Зависимость восстановительного потенциала от концентрации ионов определяемая уравнением Нернста, а именно:

включает концентрацию тех ионов, которые написаны в уравнении электродной реакции, характеризуемой восстановительным потенциалом, после знака равенства (свосст) или перед знаком равенства (сокисл). Концентрации окисленных и восстановленных форм ставятся в степенях их стехиометрических коэффициентов. Так, для потенциала электродов в приведенном выше случае следует записать
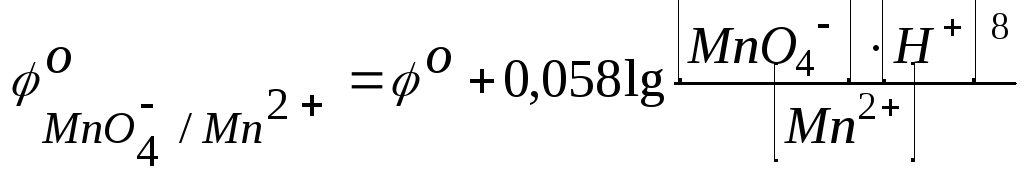 ;
;
 .
.
Окислительные свойства молекул или ионов тем сильнее, чем больше их потенциалы по алгебраической величине. Соотношения:
-nF![]() =
=
![]() Go
= – RT lnK =
Go
= – RT lnK =
![]() Ho
–
T
Ho
–
T![]() So
So
позволяют
вычислить изменения свободной энергии
![]() Go,
энтальпии
Go,
энтальпии
![]() Ho,
энтропии
Ho,
энтропии
![]() So
и константу равновесия электрохимического
процесса К
по известным
значениям Eo
и
T.
Для этого
достаточно знать равновесные ЭДС
элементов хотя бы при двух температурах
и решить систему из двух уравнений с
двумя неизвестными.
So
и константу равновесия электрохимического
процесса К
по известным
значениям Eo
и
T.
Для этого
достаточно знать равновесные ЭДС
элементов хотя бы при двух температурах
и решить систему из двух уравнений с
двумя неизвестными.