
402
.2.pdf20
3.3.11. Рассчитайте удельную теплоемкость для воздуха по
i 2 |
|
R |
|
|
||
формуле Cmp |
|
|
|
, возьмите |
i = 5, M = 0,029 кг/моль. |
|
2 |
M |
|||||
|
|
|
|
|||
Сравните полученное значение со средней удельной теплоемкостью при постоянном давлении, определенное по данным лабораторной работы.
3.4. Сделайте вывод, в котором укажите особенности метода измерений и расчета и оцените погрешность измерений.
21
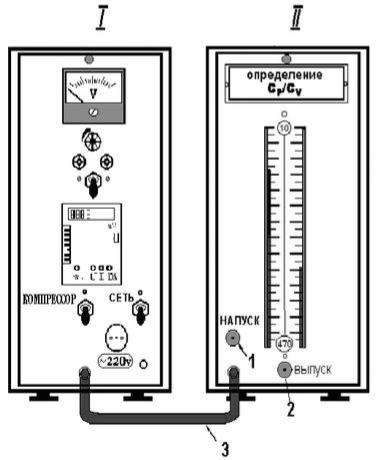
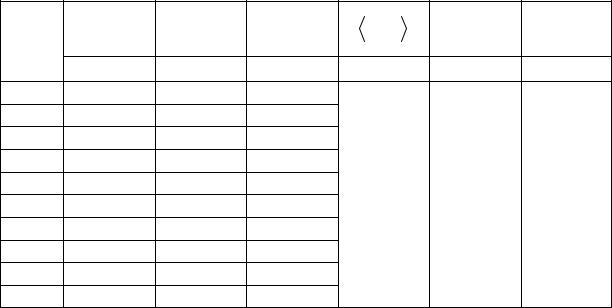
IV. Лабораторная работа № 4. ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ПУАССОНА
МЕТОДОМ КЛЕМАНА – ДЕЗОРМА
1. Цель работы
Освоить метод Клемана – Дезорма определения коэффициента Пуассона.
2. Подготовка к работе
Прочитать в учебниках следующие параграфы: [1] – ¶¶ 9.5– 9.6; [2] – ¶¶ 50, 53–55; [4] – ¶¶ 21, 22. Для выполнения работы студент должен знать: а) основные уравнения термодинамических процессов; б) первое начало термодинамики; в) определение и расчет коэффициента Пуассона; г) методы расчёта теплоты, работы и изменения внутренней энергии; д) уметь пользоваться измерительными приборами.
3. Выполнение работы
3.1. Описание |
|
|||
лабораторной уста- |
|
|||
новки |
|
|
|
|
Эксперимен- |
|
|
||
тальная |
установка |
|
||
для определения ко- |
|
|||
эффициента |
Пуассо- |
|
||
на состоит из двух |
|
|||
модулей (рис. 4.1). В |
|
|||
модуле I |
находится |
|
||
компрессор, |
соеди- |
|
||
ненный |
трубкой |
3 |
|
|
с баллоном, |
находя- |
|
||
щимся в модуле II. |
|
|||
Для |
накачива- |
|
||
ния воздуха в баллон |
|
|||
нужно |
включить |
|
||
тумблер |
žсеть¤ |
и, |
|
|
включив |
|
тумблер |
Рис. 4.1. Экспериментальная установка для |
|
žкомпрессор¤, |
на- |
|||
|
|
|
|
определения отношения СP/СV |
22
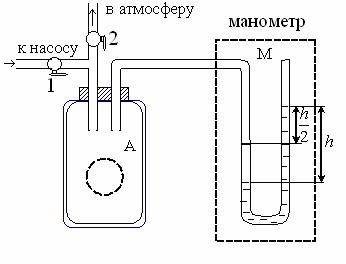
жать на клапан žнапуск¤. Клапан 2 žвыпуск¤ позволяет соединять баллон с атмосферой. По U-образному жидкостному манометру, расположенному в модуле II, определяют дополнительное к атмосферному давление в баллоне по разности уровней жидкости в коленах манометра: p ж gh , где h – разность уровней жидкости в коленах манометра; ρж – плотность жидкости, ρж = 10 3 кг/м 3 .
3.2. Методика измерений и расчёта
Метод Клемана – Дезорма состоит в определении коэффициента Пуассона через измерение разности уровней в манометре h1 и h2 . Для экспериментального определения отношения
= СP/СV для воздуха нужно провести ряд термодинамических процессов, полагая, что в условиях эксперимента воздух можно считать двухатомным идеальным газом.
В начальный момент времени при комнатной температуре давление в баллоне равно атмосферному pА.
|
В |
|
баллон |
А |
|
(рис. 4.2) с |
помощью на- |
|
|||
соса накачивается воздух |
|
||||
до разности уровней в ма- |
|
||||
нометре, |
примерно, |
|
|||
в 200–300 мм. Температу- |
|
||||
ра воздуха в баллоне в ре- |
|
||||
зультате |
сжатия несколь- |
|
|||
ко |
повышается. |
После |
|
||
прекращения накачивания |
|
||||
она будет понижаться до |
|
||||
комнатной |
температу- |
Рис. 4.2. Схема экспериментальной |
|||
ры Т0 . Процесс пониже- |
установки для определения СP/СV |
||||
ния |
температуры |
проис- |
А – сосуд; М – манометр |
||
ходит |
при |
постоянном |
|
||
объеме, сопровождаясь понижением давления и, следовательно, понижением разности уровней жидкости в манометре. После установления температурного равновесия воздух в сосуде будет характеризоваться параметрами р1 и Т0 , причем р1 рА ж gh1 ,
23 |
|
|
|
|
|
|
где р0 – атмосферное давление; h1 |
– установившаяся разность |
|||||
|
уровней |
|
жидкости |
|||
|
в манометре; |
ж gh1 |
– |
|||
|
гидростатическое |
давле- |
||||
|
ние |
столба |
жидкости |
|||
|
в манометре высотой |
h1, |
||||
|
которое |
уравновешивает |
||||
|
добавочное |
давление |
||||
|
в баллоне А; T0 |
– комнат- |
||||
|
ная температура (рис. 4.3). |
|||||
|
Для |
дальнейшего |
описа- |
|||
Рис. 4.3. Диаграмма зависимости |
ния |
термодинамических |
||||
давления от объема при |
процессов, происходящих |
|||||
адиабатном расширении1–2 |
в баллоне, мысленно вы- |
|||||
и изохорном нагревании 2–3 воздуха |
делим в |
баллоне |
неболь- |
|||
|
шой |
объем V0 |
вдали |
от |
||
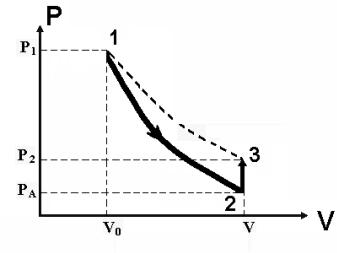
клапана. Состояние воздуха в объеме V0 в рассматриваемый момент времени характеризуется следующими термодинамическими параметрами: (V0; pA + gh1; T0). На рис. 4.3 – точка 1.
Затем, открыв (на малое время) клапан 2 (žвыпуск¤ на рис. 4.1), выпускают часть воздуха из баллона, после чего закрывают клапан 2. Воздух будет быстро выходить из баллона, давление в баллоне за это время снизится до атмосферного, уровни жидкости в коленах манометра сравняются. Молекулы воздуха, занимающие ранее объем V0, теперь будут занимать больший объем V, температура опустится ниже комнатной, т. к. часть внутренней энергии воздуха израсходуется на расширение воздуха. Если пренебречь теплообменом за время расширения воздуха, то этот процесс можно считать адиабатным, и переход из состояния 1 в состояние 2 (рис. 4.3) описывать уравнением Пуассона:
(рA + gh1) V0 =рAV . |
(4.1) |
В конце адиабатного расширения состояние выделенного |
|
объема воздуха характеризуется следующими термодинамическими параметрами: (V; рA; T).

24
Поскольку температура Т T0 , то воздух в сосуде после закрытия клапана начнет изохорически нагреваться за счет получения тепла от окружающей среды до комнатной температуры.
Когда температура станет равной T0 , изменение уровней в манометре прекратится, и третье состояние газа будет характеризоваться параметрами р2 рА ж gh2 и T0 , где h2 – новая установившаяся разность уровней в манометре.
Состояние 3 характеризуется следующими термодинамическими параметрами: (V; рA + gh2; TK) .Переход из состояния 2 в состояние 3 (изохора 2–3 на рис. 3) описывается уравнением:
|
рA |
|
рA gh2 |
. |
(4.2) |
|
|
|
|||
|
T |
T0 |
|
||
Теоретически возможен переход из состояния 1 в состоя- |
|||||
ние 3 по изотерме 1–3 (рис. 4.3). Этот переход можно бы было описать законом Бойля – Мариотта:
V0(рA + gh1) = V(рA + gh2). |
|
|
(4.3) |
|||||
Из (4.3) выразим объем V и подставим в (4.1): |
||||||||
|
|
|
|
|
рA gh1 |
|
|
|
|
|
|
|
|
||||
(рA + gh1)V0 |
|
= рAV0 |
|
|
|
|
||
р gh |
|
|||||||
|
|
|
. |
|||||
|
|
|
|
|
A |
2 |
|
|
Делим обе части последнего уравнения на р V |
0 |
|
и нахо- |
|||||||||
дим э: |
|
|
|
|
|
|
A |
|
|
|||
ln(1 gh1 |
рA ) |
|
|
|
|
|
|
|
||||
э = |
|
|
|
|
|
. |
|
|
|
|||
ln(1 gh1 рA ) ln(1 gh2 |
|
|
|
|
|
|||||||
|
рA ) |
|
|
|
||||||||
Как показывают расчеты, gh1 << рA и gh2 << рA, поэтому |
||||||||||||
в разложении в степенной ряд |
логарифмических |
|
функций |
|||||||||
ln(1 + gh1/рA) и ln(1 + |
gh2/рA) ограничимся только первыми |
|||||||||||
членами разложений: |
gh1 рA |
|
|
|
h1 |
|
|
|
|
|
||
э = |
|
|
= |
|
. |
|
|
(4.4). |
||||
|
|
|
h1 h2 |
|
|
|||||||
|
|
( gh1 рA ) gh2 рA |
|
|
|
|
|
|||||
3.3. Порядок выполнения работы
3.3.1. Включите на модуле I (рис. 4.1) тумблеры žсеть¤ и žкомпрессор¤, на модуле II нажмите клапан žнапуск¤, соеди-
25
няющий компрессор с баллоном, добейтесь, чтобы разность уровней в U-образном манометре составила 250–300 мм.
3.3.2.Закройте клапан žнапуск¤, выждите 3–5 мин, пока температура воздуха в баллоне не станет равной температуре воздуха в комнате (уровни в манометре перестанут перемещаться). По нижним уровням менисков определите уровни жидкости
вколенах манометра и разность уровней h1.
3.3.3.Резко нажмите клапан 2 (рис. 4.1) на втором модуле и отпустите его сразу, как только в первый раз выровняются уровни жидкости в коленах манометра (возможны колебания).
3.3.4.Выждите 3–5 мин, в течение которых температура воздуха в баллоне поднимется до комнатной (уровни жидкости в коленах манометра перестанут перемещаться). Определите раз-
ность уровней в коленах манометра h2. Вычислите коэффициент
Пуассона по формуле |
h1 |
. |
|
h1 h2
3.3.5.Повторите опыт не менее 10 раз, результаты занесите
втабл. 4.1. Степень накачивания должна быть одинаковой во всех опытах.
3.3.6. Оценить отклонение |
|
теор экс |
100% результа- |
|
|
||
|
|
теор
тов измерения от расчетного значения γтеор , определяемого по
формуле γтеор i 2 , принимая воздух за двухатомный газ с i
числом степеней свободы i 5.
3.3.7. Рассчитайте абсолютную h и относительную h погрешность измерений разности уровней жидкости в манометре, результаты занесите в таблицу, составленную самостоятельно.
Рассчитайте погрешность косвенных измерений коэффици-
ента Пуассона : |
4 h2 |
h2 – относительная погрешность |
|
1 |
2 |
коэффициента Пуассона;  экс
экс  /100 %, где – границы доверительного интервала. Ответ запишите в виде
/100 %, где – границы доверительного интервала. Ответ запишите в виде 
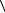 .
.
|
|
|
26 |
|
|
|
|
|
|
|
|
|
Таблица 4.1 |
|
Результаты измерений уровней жидкости |
|||||
|
|
и вычислений показателя адиабаты γ |
|
|||
№ |
h1 |
h2 |
экс |
экс |
γтеор |
ξ |
п/п |
мм |
мм |
|
|
|
% |
1 |
|
|
|
|||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
7 |
|
|
|
|
|
|
8 |
|
|
|
|
|
|
9 |
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
3.4. Сделайте вывод о различии коэффициента Пуассона, |
|||||
определенного экспериментально и теоретически. |
|
|||||
27
V. Лабораторная работа № 5. ИЗУЧЕНИЕ ЯВЛЕНИЙ ПЕРЕНОСА
1. Цель работы
Определение коэффициента внутреннего трения воздуха методом Пуазейля, вычисление длины свободного пробега молекул воздуха, коэффициентов диффузии и теплопроводности, числа Рейнольдса.
2. Подготовка к работе
Прочитать в учебниках следующие параграфы: [1] – ¶¶ 10.7
– 10.8; [2] – ¶¶ 46, 48; [4] – ¶¶ 86, 89. Для выполнения работы студент должен знать: а) формулу Пуазейля для определения коэффициента внутреннего трения; б) понятие коэффициентов диффузии и теплопроводности; в) физический смысл числа Рейнольдса и его расчёт; г) как пользоваться измерительными приборами д) как рассчитывать погрешности измерений.
3. Выполнение работы 3.1. Описание лабораторной установки
Если в газе существуют неоднородности плотности, температуры или скорости неупорядоченного движения отдельных слоев газа, то происходит самопроизвольное выравнивание этих неоднородностей путем возникновения потоков вещества, энергии или импульса, то есть наблюдаются явления переноса: диффузия, теплопроводность, внутреннее трение.
Лабораторная установка для изучения явлений переноса состоит из двух модулей (рис. 5.1). В модуле I расположены две емкости, соединенные трубкой 8 (рис. 5.2). В модуле II расположен компрессор, соединенный с емкостью 6 через клапан 1 (К1) с помощью шланга 10. После включения компрессора и нажатия клапана К1 вода по трубке 8 вытесняется в сосуд 9. Мерная трубка 7 позволяет следить за уровнем жидкости в сосуде 6. Когда уровень воды в мерной трубке 7 достигает уровня 90, компрессор выключают и отпускают клапан К1. После нажатия клапана 2 (К2) выравниваются давления в сосуде 6, левом колене манометра 5 (рис. 5.2), а на концах капиллярной трубки 3 создается разность давлений, которая измеряется манометром 5. Благодаря этому воздух после открытия 4 (рис. 5.2) протекает через капил-
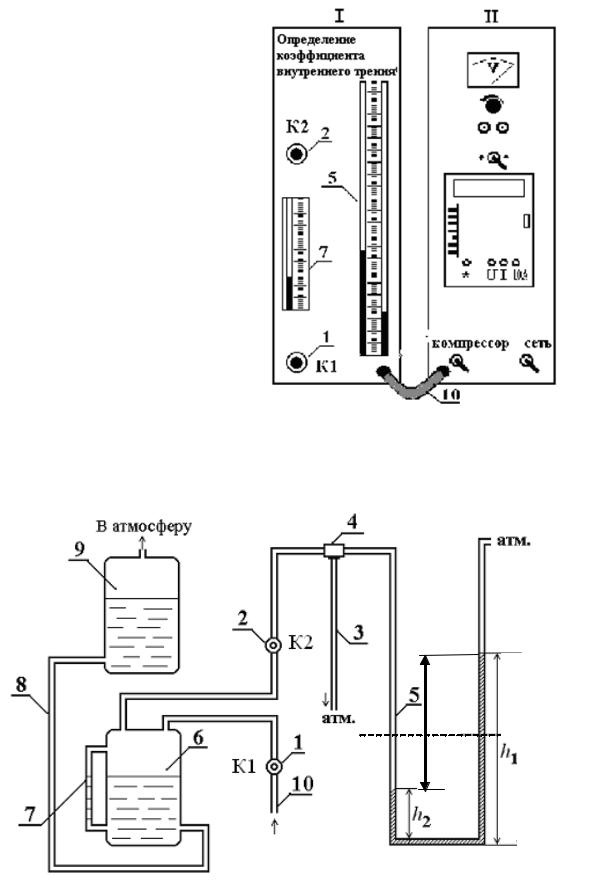
28
лярную трубку. |
Объем |
его можно |
считать |
(с ошибкой не |
более |
1 %) равным объему воды, перетекающей из сосуда 9 в сосуд 6.
Диаметр сосуда 6 dc = 0,098 м.
Длина капиллярной трубки
b = 0,045 м. Диаметр капилляр-
ной трубки
d = 0,44 10–3 м.
Рис. 5.1. Лабораторный комплекс для изучения явления переноса
h
компрессор
Рис. 5.2. Схема устройства лабораторного комплекса

29
3.2. Методика измерений и расчёта
Из закона Пуайзеля коэффициент динамической вязкости
воздуха определяется по формуле: |
|
|
4πt |
|
|
|
|
( p p |
2 |
)R |
|
|
|
η |
1 |
|
|
, |
(5.1) |
|
|
|
|
|
|||
8bV
где R d / 2 – радиус капиллярной трубки.
Разность давлений p1 p2 находится по разности уровней воды в манометре h1 h2 (рис. 5.2):
p ρв g(h1 h2 ) ,
где в – плотность воды.
Объем V воздуха, протекающего за время t через капилляр-
ную трубку находим по формуле V 1 dc2 H , где dc – диаметр 4
сосуда; H – изменение уровня воды в сосуде 6 определяем по мерной трубке 7.
Сучетом приведенных формул выражение (5.1) представим
ввиде
|
в gd 4 |
|
|
h |
t . |
(5.2) |
||||||||
|
|
|
|
|
||||||||||
|
|
|
32dc2b H |
|
||||||||||
Средняя по сечению скорость потока воздуха в капилляре |
||||||||||||||
равна |
|
|
|
|
|
|
dc2 H |
|
|
|||||
|
V |
|
4V |
|
|
|
. |
(5.3) |
||||||
|
d 2t |
|
|
|||||||||||
|
St |
|
|
|
d 2t |
|
||||||||
Число Рейнольдса, определяющее характер движения воз- |
||||||||||||||
духа по трубке, рассчитывается по формуле: |
|
|||||||||||||
|
Re |
ρ υ d |
, |
(5.4) |
||||||||||
|
|
|||||||||||||
|
|
|
|
|
|
η |
|
|||||||
где – плотность воздуха.
Если Re 1100 – характер течения воздуха ламинарный, если 1100 Re 2000 – характер течения неустойчивый, при Re 2000 – течение газа турбулентное.
