
- •Ступко т.В.
- •Введение Общие методические рекомендации
- •1. Основные понятия химии1 Примеры решения задач
- •Задачи для решения на занятии.
- •Задания для самостоятельного решения
- •Тестовые задания
- •Строение вещества2 Примеры решения задач
- •Задания для самостоятельного решения
- •Идз5«Строение атома и химическая связь»
- •Вопросы к коллоквиуму по теме «Строение атома и периодический закон д.И.Менделеева»
- •Пример тестового задания «Строение атома и химическая связь»6
- •3.Учение о химическом процессе
- •3.1. Элементы химической термодинамики7 Примеры решения задач
- •Задачи для решения на занятии.
- •Задачи для самостоятельного решения. Вариант №1
- •Тест «Термодинамика»
- •Кинетика. Химическое равновесие. Примеры решения задач
- •Задания для решения на занятии
- •Задания для самостоятельного решения Вариант №1
- •4. Химические процессы в растворах
- •4.1.Основные понятия о растворах. Равновесия в растворах8 Примеры решения задач
- •Задачи для решения на занятиях
- •Задачи для самостоятельного решения «Способы выражения концентрации растворов»
- •Задачи для самостоятельного решения «Равновесия в растворах»
- •4.2 Окислительно-восстановительные процессы9 Примеры решения задач
- •Задачи для решения на занятиях
- •Задачи для самостоятельного решения
- •Идз «растворы, овр»
- •Приложение
- •Соотношения между значениями физических единиц энергии
- •Соотношения между значениями физических единиц длины
- •Значения фундаментальных физических постоянных
- •Константы диссоциации некоторых кислот и оснований
- •Произведение растворимости малорастворимых электролитов при 25°с
- •Термодинамические характеристики некоторых веществ при 289 к
- •Стандартные электродные потенциалы при температуре 298 к
- •Общие константы образования некоторых комплексов (водный раствор, 25 °с)
- •Содержание
- •1Теоретическая часть в методическом пособии «Основы общей и неорганической химии» Часть I. С.6-29.
4. Химические процессы в растворах
4.1.Основные понятия о растворах. Равновесия в растворах8 Примеры решения задач
Пример 1. Определить рН 2 % раствора серной кислоты, учитывая, что плотность этого раствора равна 1,012 г/см3.
Решение: 1. Написать уравнения процессов, протекающих при образовании данного раствора в нашем примере это полная диссоциация сильного электролита – серной кислоты:
H2SO4 →2H+ + SO42-
2. Написать расчетные формулы для определения величин, значение которых надо найти по условия задачи. В нашей задаче это формулы
рН = - lg [Н+]
3. Для решения задачи нужно определить молярную концентрацию ионов водорода.
Из
уравнения диссоциации ясно, что [Н+]
равна 2
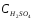
4. Определить молярную концентрацию 2% раствора H2SO4
CM = (ω •ρ•10)/ М
CM (H2SO4) = (2.1,012.10)/98= 0,207 моль/л
Следовательно [Н+] = 0,414 моль/л
рН = - lg 0,414 = 0,38
Пример 2. Определить значения рН 0,2 М раствора уксусной кислоты.
Решение: 1. Написать уравнения процессов, протекающих при образовании данного раствора в нашем примере это диссоциация слабого электролита:
СН3СООН↔ СН3СОО- + Н+
2. Написать расчетные формулы для определения величин, значение которых надо найти по условия задачи.
рН = - lg [Н+] = [Н+] /С,
т.к. [Н+] равна концентрации молекул уксусной кислоты, подвергшихся диссоциации.
3. Выяснить, концентрацию каких ионов нужно определить для решения задачи и обозначить ее через Х. В нашем примере [Н+] = Х моль/л.
4. Установить, равновесие какой реакции определяет концентрацию данных ионов и использовать выражение константы равновесия этой реакции для расчета их концентрации. В нашей задаче ионы водорода образуются при диссоциации уксусной кислоты, поэтому находим их концентрацию из выражения константы равновесия этого процесса
К = [СН3СОО-] [Н+] / СН3СООH
5. Определить величины, входящие в выражение константы по данным справочника (приложение) или по условию задачи, или выразив через Х.
В нашем случае К = 1,8 . 10 -5 (по справочным данным).
Концентрация молекул уксусной кислоты будет равна исходной ее концентрации (0,2 моль/л) за вычетом того количества кислоты, которое продиссоциировало на ионы [Н+] и [СН3СОО-]. Т.к. [Н+] обозначили за Х моль/л, то, очевидно, количество продиссоциированных молекул уксусной кислоты тоже будет равно Х моль/л - по стехиометрии уравнения (4) и значит, остаточная (равновесная) концентрация уксусной кислоты составит [СН3СООH] = С СН3СООH - Х = (0,2 - Х) моль/л.
6. Подставить найденные значения величин в выражение константы и решить уравнение относительно Х. В нашей задаче после подставки в формулу (5) имеем
1,8 . 10 -5 = (0,1 + Х) . Х / (0,2 - Х).
Т.к. значение Х получится порядка 10 -5, то есть по сравнению с числами 0,1 и 0,2 эта величина небольшая, то ею как слагаемым пренебрегаем
1,8 . 10 -5 = 0,1 Х / 0,2 ,
откуда Х = 3,6 . 10 -5 моль/л = [Н+].
7. Подставляем найденные значения в формулы расчета величин, искомых в задаче.
В нашем примере
= [Н+] / С = 3,6 . 10 -5 / 0,2 = 1,8 . 10 -4 = 0,018 %,
рН = - lg [Н+] = lg 3,6 . 10 -5 = 5 - 0,56 = 4,44.
Пример 3 Растворимость AgCl при 25 0С составляет 0,0018 г/л. Вычислить произведение растворимости хлорида серебра, М AgCl = 143,5.
Решение: AgCl ↔Ag+ + Cl- ; ПР AgCl = [Ag+] [Cl-].
C AgCl = 0,0018/143,5 = 1,25 . 10-5 моль/л.
1 моль AgCl образует 1 моль [Ag+] и 1 моль [Cl-],следовательно, над осадком [Ag+] = [Cl-] = 1,25 . 10-5 моль/л, поэтому ПР = 1,25 . 10-5 . 1,25 . 10-5 = 1,56 . 10-10.
Пример 4 Определить рН раствора над осадком Zn(OH)2 и его растворимость.
Решение:1. В данной системе имеет место равновесие
Zn(OH)2 ↔Zn2+ + 2OH-
2. Т.к. при растворении осадка, образуются ионы ОН- , то рН находим по формуле
рН = 14 - рОН = 14 + lg[OH-].
Растворимость осадка, то есть число его молекул в 1 л насыщенного раствора, в соответствии с уравнением диссоциации будет определяться концентрацией ионов цинка над осадком: [Zn2+].
3. Для решения задачи обозначим [Zn2+] = Х моль/л, тогда [OH-] = 2 Х моль/л.
4. Оба иона Zn2+ и OH- образуются при растворении осадка, значит определять их концентрацию нужно из выражения ПР
ПР = [Zn2+][OH-]2
5. Значение ПР находим из справочных таблиц. ПР= 7,1 .10-18
6. Подставляя ПР и принятые обозначения в выражение, получим
7,1 .10-18 = Х . (2Х)2 = 4Х3, откуда Х = 7,3 . 10 -7 = S (моль/л),
а [OH-] = 2 .7,3 . 10 -7 = 1,46 10 -6 и рН = 14 + lg 1,46 10 -6 = 8,17.
Пример 5. Произведение растворимости хлорида серебра 1,56.10-10. Сколько граммов этой соли содержится в 100 мл насыщенного раствора?
Решение:
ПРAgCl
= [Ag+]
[Cl-]
=1,56 .
10-10,
следовательно, концентрации ионов равны
[Ag+]
= [Cl-]
=
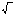 1,56.
10-10 =
1,25 .
10-5
моль/л = L
AgCl
1,56.
10-10 =
1,25 .
10-5
моль/л = L
AgCl
M AgCl = 143,5, то есть 143,5 - 1 моль, а х г - 1,25 . 10-5 моль; поэтому
х = 143,5 . 1,25 . 10-5 - это на 1 л, то есть на 1000 мл; а на 100 мл :
1,25 . 10-5 . 143,5 . 100 /1000 = 1,79 . 10 -4 (г).
Пример 6. К 100 мл CuCl2 насыщенного раствора СаСО3 (ПР = 4,8.10-9) добавили 10 мл 0,1 М раствора CaCl2. Как изменится растворимость СаСО3?
Решение: 1. Вычисляем растворимость СаСО3 в водном растворе:
ПР СаСО3= [Са2+][СО32–] = L2
Lвода
=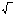 4,8.10-9
=6,9.10-5
моль/л
4,8.10-9
=6,9.10-5
моль/л
2. Определяем растворимость СаСО3 в растворе CaCl2
Теперь [Са2+] стала больше - L + количество кальция, пришедшее из раствора CaCl2
Определяем количество ионов кальция в растворе:
Добавили моль Са2+ n= СM.V/1000 =0,1.10/1000= 10-3 моль
V раствора стал 100+10 = 110 мл
СМ этого раствора = n. 1000/V = 10-3.1000/110=0,009 моль/л
[Са2+]= (L+0,009) а [СО32–] =L
Тогда:
ПР СаСО3= [Са2+][СО32–] = (L+0,009) L
Мы не допустим большой ошибки, если учтем, что
0,009>>L и (L+0,009)≈0,009,
Тогда ПР СаСО3= 0,009 L
L = ПР/0,009 =4,8.10-9/0,009 =
3. Сравним величины растворимости:
Lвода/L =6,9.10-5 /5,33.10-7 =129
Растворимость СаСО3 уменьшилась в 129 раз
Пример 7. Оцените значение константы гидролиза CuCl2 по первой ступени (при 250С) и определите рН 1 М раствора этой соли
Решение:1. Напишем уравнение гидролиза соли:
CuCl2
+ H2O
![]() CuOHCl
+ HCl
CuOHCl
+ HCl
В ионном виде:
Сu2+
+
H2O
![]() CuOH+
+ H+
CuOH+
+ H+
2. Найдем значение константы гидролиза:
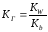
Из таблицы KCu(OH)2 = 3,4.10-7 тогда Kг =10-14/3,4.10-7 = 0,29.10-7
3. Найдем концентрацию ионов водорода в растворе
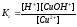 ,
0,29.10-7=
,
0,29.10-7=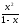 ,
,
так как константа мала, х<<1, а 1-x≈1, тогда
0,29.10-7
= х2
, х =
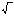 0,29.10-7
=1,7.10-4
0,29.10-7
=1,7.10-4
4. Найдем рН раствора:
рН = - lg1,7.10-4 =3,37
