- •Ступко т.В.
- •Введение Общие методические рекомендации
- •1. Основные понятия химии1 Примеры решения задач
- •Задачи для решения на занятии.
- •Задания для самостоятельного решения
- •Тестовые задания
- •Строение вещества2 Примеры решения задач
- •Задания для самостоятельного решения
- •Идз5«Строение атома и химическая связь»
- •Вопросы к коллоквиуму по теме «Строение атома и периодический закон д.И.Менделеева»
- •Пример тестового задания «Строение атома и химическая связь»6
- •3.Учение о химическом процессе
- •3.1. Элементы химической термодинамики7 Примеры решения задач
- •Задачи для решения на занятии.
- •Задачи для самостоятельного решения. Вариант №1
- •Тест «Термодинамика»
- •Кинетика. Химическое равновесие. Примеры решения задач
- •Задания для решения на занятии
- •Задания для самостоятельного решения Вариант №1
- •4. Химические процессы в растворах
- •4.1.Основные понятия о растворах. Равновесия в растворах8 Примеры решения задач
- •Задачи для решения на занятиях
- •Задачи для самостоятельного решения «Способы выражения концентрации растворов»
- •Задачи для самостоятельного решения «Равновесия в растворах»
- •4.2 Окислительно-восстановительные процессы9 Примеры решения задач
- •Задачи для решения на занятиях
- •Задачи для самостоятельного решения
- •Идз «растворы, овр»
- •Приложение
- •Соотношения между значениями физических единиц энергии
- •Соотношения между значениями физических единиц длины
- •Значения фундаментальных физических постоянных
- •Константы диссоциации некоторых кислот и оснований
- •Произведение растворимости малорастворимых электролитов при 25°с
- •Термодинамические характеристики некоторых веществ при 289 к
- •Стандартные электродные потенциалы при температуре 298 к
- •Общие константы образования некоторых комплексов (водный раствор, 25 °с)
- •Содержание
- •1Теоретическая часть в методическом пособии «Основы общей и неорганической химии» Часть I. С.6-29.
Тест «Термодинамика»
|
№ |
Вопрос |
Ответ |
|
1 |
Реакция, протекающая с выделением тепла, называется:
|
|
|
2 |
Условием принципиальной осуществимости самопроизвольного процесса является, условие |
|
|
3 |
Система, которая обменивается с окружающей средой и веществом и энергией является |
|
|
4 |
Химическая реакция невозможна при любой температуре, если
|
|
|
5 |
Стандартными условиями в термодинамике считаются ###. |
|
|
6 |
В изолированной системе без сообщения энергии извне протекают только такие самопроизвольные процессы, в которых энтропия |
|
|
7 |
Единица измерения энтропии ###… |
|
|
8 |
Изменение энтропии в ходе реакции СО(г) + 2H2(г) = CH3OH(ж)
|
|
|
9 |
Энтропия реакции NH4NO3(к) = N2O(г) + 2H2O(г); |
|
|
10 |
Энтальпия реагентов больше, чем энтальпия продуктов для реакций:
|
|
Кинетика. Химическое равновесие. Примеры решения задач
Пример 1. Как изменится скорость реакции
4НС1+О2 →2С12+ 2H2O,
протекающей в газовой фазе, если увеличить в три раза: 1) концентрацию кислорода, 2) концентрацию хлорида водорода, 3) давление?
Решение. Если обозначить концентрации НС1 и О2 соответственно через а и b, то выражение для скорости реакции примет вид:
v=k[HCl] [О2]=kа4b.
После увеличения концентраций O2 в три раза
v1 = kа43b.
Увеличение скорости реакции по отношению к первоначальному определяется отношением
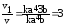
После увеличения концентраций HCl в три раза
V1= k(3а)4b.
Увеличение скорости реакции по отношению к первоначальному определяется отношением
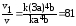
Увеличение давления во столько же раз увеличивает концентрацию газообразных реагирующих веществ, поэтому в этом случае:
v1= k(3а)4 3b.
Увеличение скорости реакции по отношению к первоначальному определяется отношением
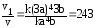
Пример 2. Чему равна массовая доля Н2 и 12, превращающихся в иодид водорода, если они взяты в реакцию количеством вещества 1 моль каждый, а константа равновесия при температуре опыта равно 4?
Решение. Запишем уравнение реакции: H2 + I2 ↔ 2HI
|
|
H2 |
I2 |
HI |
|
Взято, моль/л |
1 моль |
1 моль |
0 моль |
|
К моменту равновесия прореагировало |
Х моль |
Х моль |
|
|
0сталось |
1-х |
1-х |
|
|
Образовалось |
|
|
2х |
Равновесные концентрации Н2 и I2 составляют 1-х, а HI ‑ 2х моль/л
Запишем значение константы равновесия:
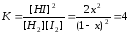
откуда х = 0,5 моль/л.
Таким образом, массовая доля Н2 и 12, превратившихся в HI, составляет 50%
Пример 3. Какими способами в системе
2SO2+O2↔SO3 ΔН<0
можно смещать равновесие в сторону большего выхода SO3 при заданной концентрации SO2?
Решение. Согласно правилу Ле Шателье это достигается:
а) повышением концентрации О2;
б) уменьшением концентрации SO3 (удаление из сферы реакции);
в) повышением давления;
г) понижением температуры до такого ее значения, при котором скорость реакции еще достаточна для относительно быстрого достижения равновесия.
Пример 4. Константа равновесия реакции
CO+H2O↔CO2+Н2
при температуре 727 и 927 °С соответственно равна 1,4 и 0,74. Как найти ΔG этой реакции и определить ее направление при указанных температурах?
Решение. ΔG находится из уравнения
ΔG= - RT InK =-19,1 Т lg К. Температуры 727 и 927 °С соответственно равны 1000 и 1200 К.
Тогда:
a) ΔG1=-19,1-1000lg1,4=-2789 Дж/моль=-2,8 кДж/моль;
б) ΔG2= -19,1-1200lg0,74=+2502 Дж/моль=+2,5 кДж/моль.
Таким образом, в температурном интервале 727—927 °С (при ~800 °С) значение ΔG проходит через нуль и направление реакции меняется с прямого на обратное, поэтому реакцию следует проводить при температурах ниже 800 °С. С понижением температуры выход будет увеличиваться, однако время достижения равновесия будет расти.
Пример 5. При повышении температуры с 300 до 380 К скорость реакции возросла в 3000 раз. Найти температурный коэффициент реакции.
Решение: По уравнению Вант-Гоффа
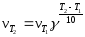 ,
,
Подставляем
значения параметров задачи в уравнение
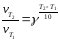 ,
3000 = γ8
,
3000 = γ8
Логарифмируя это выражение, получаем:
8lg γ= lg3000, 8lg γ = 3,48, γ=2,7

 ,
,
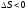
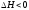 ,
,