
- •Электродные потенциалы
- •1. Понятие об электродных потенциалах
- •2. Водородный электрод. Газовые электроды.
- •3. Стандартные электродные потенциалы. Ряд напряжений
- •4. Потенциалы окислительно-восстановительных реакций
- •5. Измерение стандартных электродных потенциалов
- •6. Теория гальванических элементов; явления поляризации и деполяризации
- •Если цинк погружён в 1 м раствор сульфата цинка, а медь — в
- •7. Анодное окисление и катодное восстановление. Явления перенапряжения.
- •8. Последовательность разряда ионов
- •9. Законы Фарадея
- •Рассмотрим несколько примеров электролиза
- •11. Аккумуляторы
- •Коррозия металлов и борьба с ней
- •13. Типы коррозии металлов
- •14. Факторы, определяющие интенсивность коррозии металлов
- •15. Методы защиты металлов от коррозии
6. Теория гальванических элементов; явления поляризации и деполяризации
Первый гальванический элемент был создан итальянским физико -химиком А. Вольта. Он состоял из медных и цинковых пластинок, разделённых сукном, смоченным раствором серной кислоты. При последовательном соединении большого, числа пластинок элемент Вольта обладает значительной ЭДС. Схема элемента Вольта представлена на рис. 4.-
-
Рис. 4. Схема элемента Вольта
На поверхности раздела цинка и серной кислоты идет реакция:
Zn = Zn2++2e-
Электроны накапливаются на цинковом электроде и заряжают его отрицательно. Перемещаясь по внешней цепи к медному электроду, в котором концентрация электронов меньше, они обусловливают сле-
дующую реакцию:
2Н+ + 2е- = Н2
Суммарное уравнение реакции, за счет которой гальванический элемент Вольта дает электрический ток, выглядит так:
Zn + 2Н+ = Zn2++Н2
Медный электрод в элементе Вольта является инертным электродом и на границе с раствором серной кислоты играет роль водородного электрода (см. п. 2). Потенциал такого водородного электрода постепенно смещается в отрицательную сторону за счёт увеличения [Н2] и уменьшения[Н+]. В результате этого электродвижущая сила элемента Вольта непрерывно падает. Смещение величины потенциала положительного электрода в сторону более отрицательных значений называется поляризацией и может быть обусловлено наряду с указанными выше и другими причинами. Например, замедленностью реакции разряда ионов на электроде, которая требует дополнительного напряжения. Цинковый электрод также подвергается поляризации, но в обратном направлении: по мере увеличения концентрации ионов цинка около цинкового электрода его потенциал становится положительнее (6). Процесс устранения поляризации называется деполяризацией. Деполяризация электрода, на котором идёт выделение водорода, может быть вызвана действием специально добавленных в раствор окислителей или кислорода воздуха (по уравнению 4Н2+О2=2Н2О). Процессы поляризации и деполяризации играют большую роль при коррозии металлов и будут рассмотрены особо. Рассмотрим принципы работы гальванического элемента на примере элемента Даниэля — Якоби (рис. 5)
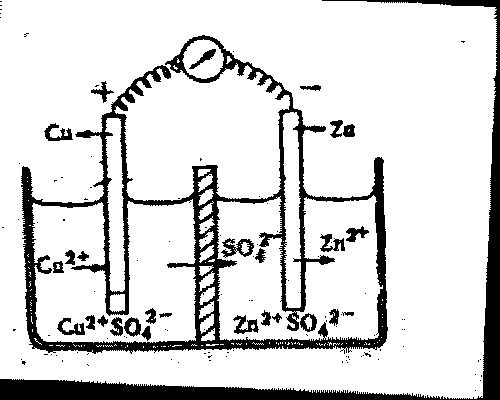
Рис. 5. Гальванический элемент Даниэля - Якоби
Если цинк погружён в 1 м раствор сульфата цинка, а медь — в
- 1М раствор сульфата меди, то по потенциалу медного электрода
Е(Cu/Сu 2+) = +0,337 в и цинкового электрода Е(Zn/Zn 2+ +) = - 0.762 в
можно найти ЭДС этого элемента:
Е(Cu/Сu 2+) + Е(Zn/Zn 2+ +) = +0,337 -(-0.762)= 1,099 в.
На границе цинка и раствора сульфата цинка идёт процесс Zn= Zn 2+ +2е- . Цинковый электрод получает отрицательный заряд и электроны по внешней цепи переходят к меди. На границе медного электрода и раствора сульфата меди протекает реакция Сu 2+ +2е- = Сu, т. е. на медном электроде выделяется медь. Одновременно по внутренней цепи от меди к цинку перемещаются отрицательные ионы SO42-, которые вместе с перешедшими в раствор ионами цинка образуют раствор сульфата цинка. Суммарное уравнение процессов на электродах : Zn + Сu 2+ = Zn 2+ + Сu
Электрическая энергия элемента Даниэля — Якоби образуется за счёт химической энергии указанной реакции. В отличие от элемента Вольта, элемент Даниэля - Якоби является обратимым, т. е., пропуская ток от внешнего источника в обратном направлении, можно привести элемент в исходное состояние.
