
- •Правила техники безопасности
- •1.2.2. Диаграмма плавкости двухкомпонентных систем при неограниченной растворимости компонентов в жидком и твердом состоянии, компоненты не образуют химических соединений
- •А б
- •1.2.3. Диаграмма плавкости двухкомпонентных систем с устойчивым химическим соединением при неограниченной растворимости компонентов в жидком состоянии и отсутствии растворимости в твердом состоянии
- •Зависимость температур начала и окончания кристаллизации от состава систем
- •3. Контрольные вопросы
- •Список рекомендуемой литературы
1.2.2. Диаграмма плавкости двухкомпонентных систем при неограниченной растворимости компонентов в жидком и твердом состоянии, компоненты не образуют химических соединений
Характерные кривые охлаждения для данной системы и пример диаграммы представлены на рис. 3. Кривые охлаждения для чистых компонентов имеют обычный вид, а на кривой охлаждения любого промежуточного состава при начале кристаллизации появляется перегиб вследствие замедления охлаждения за счет выделения теплоты кристаллизации, а после окончания кристаллизации вследствие прекращения тепловыделения на кривой охлаждения появляется второй излом (кривая охлаждения для состава М). Выше линии ликвидуса ТАLTB находится область, соответствующая жидкофазному гомогенному состоянию системы. Ниже линии солидуса ТАSTB расположена область существования твердого раствора. Между линиями солидуса и ликвидуса находится область равновесного сосуществования жидких и твердых растворов. В этом случае при кристаллизации в системе не происходит образование эвтектической смеси.

А б
Рис. 3. Диаграмма плавкости для систем при неограниченной растворимости компонентов в жидком и твердом состоянии.
Рассмотрим процесс кристаллизации расплава, обозначенного на диаграмме точкой М. При охлаждении до температуры Т1 система остается в жидком состоянии. При температуре T1 из расплава состава m выпадают кристаллы твердого раствора, имеющего состав, характеризуемый точкой n (точка пересечения изотермы с линией солидуса). Состав образующихся кристаллов отличается от состава жидкой фазы, из которой они образуются. В твердый раствор в большей степени переходит более тугоплавкий компонент (в данном случае – это компонент В). По мере понижения температуры от Т1 до Т2 состав расплава изменяется по линии ликвидуса от точки m до точки k, а состав кристаллов твердого раствора, находящихся в равновесии с расплавом (жидкостью), будет изменяться по линии солидуса от точки n до точки l. Последние капли жидкости будут при Т2 иметь состав, характеризуемый точкой k. Дальнейшее понижение температуры системы, характеризуемой точкой М, не будет сопровождаться изменениями фазового состава. То обстоятельство, что во всем интервале температур ТА ÷ ТВ состав сосуществующих твердой и жидкой фаз отличаются друг от друга, позволяет осуществлять дробную кристаллизацию. Повторение такой кристаллизации, то- есть операций расплавления и последующего отделения кристаллизующихся растворов позволяет выделять один из компонентов в более чистом состоянии.
1.2.3. Диаграмма плавкости двухкомпонентных систем с устойчивым химическим соединением при неограниченной растворимости компонентов в жидком состоянии и отсутствии растворимости в твердом состоянии
Если компоненты А и В могут образовать устойчивое твердое химическое соединение AxBy, которое способно плавиться без разложения, то такие соединения называются конгруэнтно плавящимися. В этом случае на диаграмме плавкости такой системы (рис. 4.4) на кривой ликвидуса появляется максимум, который называется сингулярной точкой (точка С рис. 4). Соответствующий ей состав характеризует состав химического соединения АxBy. Для этой точки состав расплава совпадает с составом кристаллов, выделяющихся при охлаждении системы. Чем выше положение максимума на диаграмме, тем устойчивее образующееся химическое соединение.
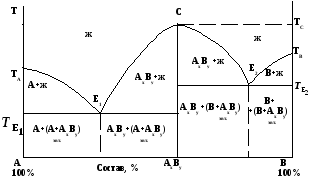
Рис. 4. Диаграмма плавкости с конгруэнтно плавящимся химическим
соединением.
По обе стороны максимума находятся две эвтектики. Диаграмму плавкости в данном случае можно рассматривать как состоящую из двух самостоятельных диаграмм для следующих систем: компонент А - химическое соединение AxBy и компонент В – химическое соединение AxBy. В каждой системе имеется своя эвтектика с соответствующей температурой её кристаллизации, что отражено на диаграмме. На областях диаграммы, представленной на рис. 4, указаны фазы, которые находятся в равновесии при соответствующих составах систем и температурах.
1.2.4. Диаграмма плавкости двухкомпонентных систем с неустойчивым химическим соединением при неограниченной растворимости компонентов в жидком состоянии и отсутствии растворимости в твердом состоянии
При образовании компонентами А и В химического соединения AxBy, плавящегося с разложением (инконгруэнтно), на линии ликвидуса диаграммы плавкости (рис.5) возникает перегиб, отмеченный точкой Р.
Инконгруэнтно плавящееся химическое соединение AxBy устойчиво только ниже температуры ТP. Поэтому при повышении температуры выше ТP это твердое соединение распадается с образованием двух фаз, в данном случае: кристаллов компонента В и расплава соответствующего состава. Точка перегиба Р называется перитектической, и ей соответствует равновесие:
расплав + ВТВ. ↔ AxBy ТВ.. (14)

Рис. 5. Диаграмма плавкости с инконгруэнтно плавящимся химическим соединением.
В отличие от эвтектической точки, в которой одновременно выпадают две твердые фазы, в перитектической точке одна твердая фаза (соединение AxBy) выпадает, а другая (выпавшие ранее кристаллы вещества В) растворяется. Система в этой точке и на всей перитектической прямой РТР нонвариантная (S = 2 –3 + 1 = 0). Пунктирной линией (со скрытым максимумом) на диаграмме показано возможное положение сингулярной области.
На представленной в качестве примера диаграмме для рассматриваемого случая (рис. 5) указаны фазы, которые находятся в равновесии при соответствующих составах систем и температурах.
Правило рычага
С помощью диаграмм фазового состояния можно определять не только составы и виды равновесных фаз, но и количественные соотношения между ними. Это делается с помощью правила рычага: отношение количества одной фазы к количеству другой фазы, находящейся с ней в равновесии, равно обратному отношению отрезков на коноде, разделенной точкой, характеризующей общий состав системы.
Рассмотрим применение правила рычага для гетерогенных (двухфазных) систем, диаграммы которых представлены на рис. 6.
Фигуративной точке М (рис. 6а) соответствуют две фазы, находящиеся в равновесии: кристаллы А (точка Т1) и расплав состава, соответствующего точке N. В соответствии с правилом рычага:
масса кристаллов А MN
–––––––––––––––––– = –––– . (15)
масса расплава T1M
Фигуративной точке Р (рис. 6в) соответствуют две фазы, находящиеся в равновесии: расплав состава, соответствующего точке С, и кристаллы состава, соответствующего точке D. Находим соотношение между этими фазами по правилу рычага:
масса кристаллов РС
––––––––––––––––– = –––– (16)
масса расплава РD
Знание рассчитанного соотношения между фазами позволяет найти при известном составе равновесных фаз количество каждого компонента в равновесных системах.
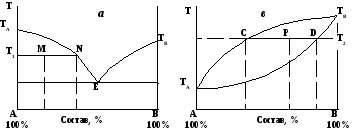
Рис.6. Диаграммы плавкости двухкомпонентных систем. Применение правила рычага.
2. Экспериментальная часть
В настоящей лабораторной работе исследуется одна из двухкомпонентных неизоморфных систем: нафталин - фенол или нафталин – дифениламин (по заданию преподавателя), для которых характерны диаграммы с эвтектикой. Определение температур начала и окончания кристаллизации индивидуальных веществ и их смесей определяют с помощью кривых охлаждения, получаемых в координатах температура – время.
Предусмотрено последовательное получение кривых охлаждения для систем различного состава (вариант 1) с их записью на самописце потенциометра, а также одновременное получение кривых охлаждения с их регистрацией на компьютере с возможной последующей распечаткой полученных графических данных (вариант 2).
Вариант 1.
Кривые охлаждения получают следующим образом. В штативе на лабораторном столе находятся пронумерованные герметично закрытые стеклянные пробирки с исследуемыми смесями известного состава (указывается в таблице, прилагаемой к лабораторной установке). При комнатной температуре индивидуальные вещества и двухкомпонентные системы находятся в твердом агрегатном состоянии. Для снятия кривых охлаждения пробирки с веществами нагревают до полного расплавления (образования однофазной прозрачной системы) в водяной бане. Затем пробирки с расплавами охлаждают с постоянной скоростью. При этом осуществляется контроль за температурой охлаждаемых образцов с помощью термопар, помещенных в пробирки. Сигнал с термопары подается на вход потенциометра с устройством, позволяющим непосредственно записывать зависимость температуры охлаждаемых образцов от времени на диаграммной ленте. Термопары подключаются к потенциометру с помощью специального переключателя, установленного на лабораторном столе.
Перед началом работы необходимо включить потенциометр в сеть и поставить тумблер “прибор” в положение “включено”. Затем в стакан с водой, нагретой на электрической плитке, помещают пробирку с исследуемой смесью. Уровень воды в стакане должен быть таким, чтобы пробирка была погружена на 2/3 своей высоты. Необходимо следить за тем, чтобы вода не попадала в пробирки с веществами. Переключателем, установленном на лабораторном столе, подключают термопару соответствующей пробирки к потенциометру (номер пробирки и номер позиции указателя на переключателе должны совпадать). При этом указатель температуры на потенциометре покажет температуру исследуемой системы (в оС). Когда содержимое пробирки расплавится, и температура расплава повысится ещё на 5-10 оС, включают на потенциометре для записи кривой охлаждения тумблер с указателем “диаграмма” и вынимают пробирку из стакана с горячей водой. Горячую пробирку сначала помещают в штатив, охлаждая на воздухе, а затем опускают в стакан с охлажденной до 8-10 оС водой (смесь готовится из воды с добавлением кусочков льда).
Запись кривых охлаждения для индивидуальных веществ следует продолжать до тех пор, пока температура системы не станет на 10-15 оС ниже температуры их кристаллизации, а для смесей - до фиксирования температуры окончания кристаллизации эвтектики (15-20 оС). При записи кривых охлаждения необходимо следить за тем, чтобы перфорация диаграммной ленты попадала в зубцы ведущего барабана, а в перо самописца поступали чернила. Кривая на диаграммной ленте должна помечаться соответствующей цифрой. Необходимо следить за температурой и уровнем воды в стакане с охлаждающей смесью. При необходимости в стакан добавляется лед, а излишек воды сливается. После снятия кривой охлаждения пробирку с исследованной смесью ставят в штатив и приступают к изучению кристаллизации других систем. Для расплавления в стакан с горячей водой не рекомендуется помещать более двух пробирок. При работе с пробирками необходимо соблюдать осторожность, стараясь не нарушить их герметичность и контакт термопар с потенциометром.
После окончания записи кривых охлаждения смесей, указанных преподавателем, диаграммную ленту отрывают и, определив температуры начала и окончания кристаллизации исследованных систем, вносят их в таблицу результатов. Ниже приводится форма таблицы результатов.
Таблица
