
- •Методические рекомендации для студентов к лабораторному практикуму
- •Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
- •1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
- •Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •Тема: Тепловые эффекты химических реакций. Термодинамические характеристики химических и биохимических процессов
- •Практическая часть
- •Экспериментальная часть Лабораторная работа. Определение стандартной теплоты (энтальпии) реакции нейтрализации
- •Экспериментальные данные и результаты измерений
- •Тема: Кинетика химических и биохимических реакций. Химическое равновесие
- •1. Основные понятия химической кинетики:
- •Практическая часть
- •Экспериментальная часть
- •Зависимость скорости разложения от ее концентрации //
- •Тема: Коллигативные свойства растворов неэлектролитов и электролитов
- •1. Вода как универсальный биологический растворитель.
- •2. Коллигативные свойства растворов (определение, виды).
- •2. Экспериментальная часть
- •Криоскопическим методом
- •Экспериментальные данные и результаты измерений
- •Тема: Протолитические равновесия и процессы. Водородный показатель. Гидролиз
- •1. Электролиты сильные и слабые.
- •3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
- •Экспериментальная часть
- •Реакция среды при гидролизе солей
- •Тема: Буферные системы, классификация и механизм действия
- •2. Экспериментальная часть
- •Ацетатного буферного раствора по кислоте и щелочи
- •Экспериментальные данные и результаты измерений
- •Тема: Физикохимия дисперсных систем. Растворы вмс
- •Практическая часть
- •Экспериментальная часть
Тема: Коллигативные свойства растворов неэлектролитов и электролитов
Цель темы: Овладение навыками решения типовых задач на определение свойств растворов в зависимости от их концентрации и освоение криоскопические, эбуллиоскопические и осмотические методы для определения молярной массы растворенного вещества.
Исходный уровень. Студент должен знать:

Основные учебно-целевые вопросы:
1. Вода как универсальный биологический растворитель.
2. Коллигативные свойства растворов (определение, виды).
2.1. Диффузия. Осмос. Осмотическое давление.
2.2. Гипо–, гипер– и изотонические растворы, их значение для медицины.
2.3.Закон Вант-Гоффа (формулировка), уравнение для неэлектролитов и электролитов.
2.4. Изотонический коэффициент Вант-Гоффа, его связь со степенью диссоциации.
2.5.Осмолярная
и осмоляльная концентрация
![]() в практической медицине.
в практической медицине.
2.6. Биологическое значение осмоса: изоосмия, гемолиз, плазмолиз, тургор, онкотическое и осмотическое давление крови.
2.7. Закон Рауля и его следствия: понижение и повышение температуры (криометрия и эбулиометрия).
Практическая часть
Ситуационные задачи
Задачи на закон Вант-Гоффа и Рауля
Задача
№1. Применение
соединений цинка в медицине основано
на том, что цинк дает соединения с белками
– альбуминаты растворимые и нерастворимые,
последние обычно образуют пленку на
тканевой поверхности и оказывают
подсушивающее действие, что способствуют
заживлению тканей, а растворимые
оказывают действие от слабовяжущего
до резко прижигающего. Осмотическое
давление 0,1 М. ZnSO4
при 0°С равно
![]() Па.Определить
кажущуюся степень диссоциации соли в
данном растворе.
Па.Определить
кажущуюся степень диссоциации соли в
данном растворе.
Ответ.![]() .
.
Задача №2. Определить концентрацию раствора глюкозы, если раствор этого вещества при 18°С изотоничен с раствором, содержащим 0,5 моль/л хлорида кальция. Кажущаяся степень диссоциации СаCI2 в растворе при указанной температуре составляет 65,4%.
Ответ.![]() моль/л.
моль/л.
Задача
№3.
В медицине раствор формальдегида
применяется для консервации анатомических
и биологических препаратов и не может
быть назначен внутрь, т.к. является
протоплазматическим ядом. Определить
температуру кипения раствора, содержащего
6 г формальдегида
![]() в 100 г воды.
в 100 г воды.![]() град∙кг/моль.
град∙кг/моль.
Ответ.![]()
Задача
№4.По
фармакологическим свойствам этиловый
спирт относится к веществам наркотического
действия. Воздействуя на кору головного
мозга, он вызывает характерное алкогольное
возбуждение, в больших дозах – ослабление
возбудительных процессов коры и угнетение
деятельности дыхательного центра. При
какой примерно температуре будет
замерзать 40 % водный раствор
![]() .
.
Ответ.
Раствор
начнет замерзать примерно при ![]() .
.
Контрольные задачи
В каком из растворов хлорида натрия: 2%, 0,86%, 0,2% жизнедеятельность эритроцитов не будет нарушена и почему?
 ,
T=37оС.
Плотность растворов и степень диссоциации
NaCI
считать равными единице.
,
T=37оС.
Плотность растворов и степень диссоциации
NaCI
считать равными единице.Изотоничны ли растворы мочевины и уксусной кислоты с массовой долей 0,6%, если степень диссоциации уксусной кислоты равна 0,01, ρ =1 г/мл?
Магния сульфат /
 /в
медицинской практике применяют
как слабительное, желчегонное и
успокаивающее действие на ЦНС. При
концентрации препарата в крови 9-10 мг%
наступает снотворный эффект, а при
15-18 мг% – наркотическое состояние.
Большие концентрации могут вызвать
угнетение дыхания. Определите
осмотическое давление раствора сульфата
магния концентрации 0,005 моль/л при 18оС,
если кажущаяся степень диссоциации
этой соли равна 66%.
/в
медицинской практике применяют
как слабительное, желчегонное и
успокаивающее действие на ЦНС. При
концентрации препарата в крови 9-10 мг%
наступает снотворный эффект, а при
15-18 мг% – наркотическое состояние.
Большие концентрации могут вызвать
угнетение дыхания. Определите
осмотическое давление раствора сульфата
магния концентрации 0,005 моль/л при 18оС,
если кажущаяся степень диссоциации
этой соли равна 66%.Никотинамид (пиридин-3-карбоновой кислоты) в медицинской практике применяют как специфическое противоаллергическое средство. Осмотическое давление крови при 37оС равно 7.7 атм. Будет ли изотоничен крови 2% раствор никотинамида /
 (витамин РР), ρ=1,03 г/мл?
(витамин РР), ρ=1,03 г/мл?Общая осмотическая концентрация в плазме крови в норме составляет 0,3 моль/л. Вычислите осмотическое давление плазмы крови при T=25oC.
Осмотическое давление раствора, содержащего 0,2 г белка в 10 мл, при 25оС равно 10-3 атм. Определить молярную массу белка.
Рассчитайте осмотическое давление 20%-ного водного раствора глюкозы (ρ = 1,08 г/мл) при 310 К, применяемого для внутривенного введения, например, при отеке легкого. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что π крови равно 740-780 кПа?
Чему равно осмотическое давление раствора при 20оС, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина (Mr (С34Н33N4O5Fe=633 г/моль))?.
Что произойдет с эритроцитами крови, если их поместить в 3 моль/л раствор глюкозы?
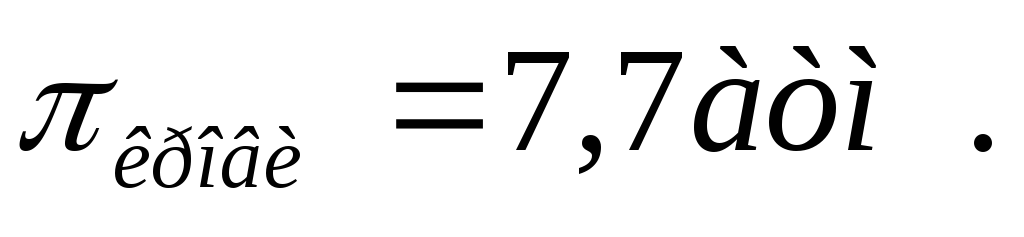 ,
при T=37оС.
,
при T=37оС.Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы (ρ=1,006 г/мл)
В каком из двух растворов глюкозы отклонение от закона Рауля будет больше: с С=0,1М или С=0,2М? Дайте пояснения.
В каком случае отклонение от закона Рауля будет больше: в растворе уксусной кислоты с моляльной концентрацией 0,05 моль/кг или в соляной кислоте с такой же моляльной концентрацией? Дайте пояснения.
Вычислите температуру кипения и температуру замерзания 4,6% раствора глицерина в воде.
Вычислите температуру кипения и температуру замерзания водного раствора сахарозы с массовой долей 2%.
Давление пара чистого ацетона при 20°С 23940 Па. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23 710 Па. Определить молекулярную массу камфоры, растворенной в ацетоне.
Определите эбулиоскопическую постоянную ацетона, если раствор, содержащий 4,6 г глицерина /
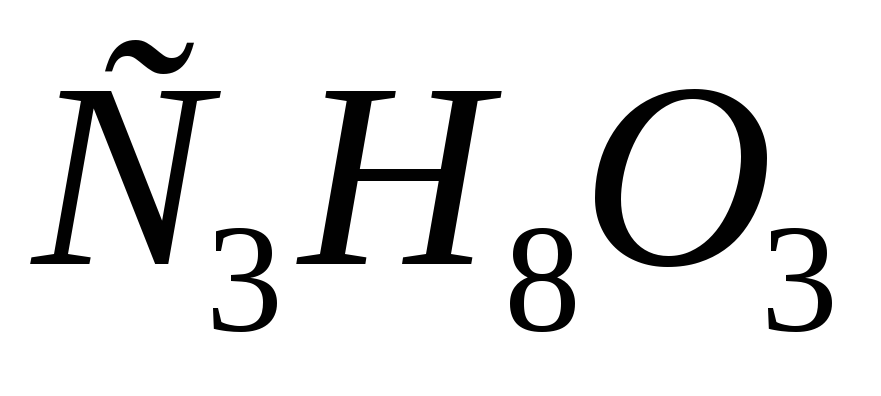 /
в 200 г ацетона /
/
в 200 г ацетона / /,
кипит при температуре 56,43оС.
Ткип(
/,
кипит при температуре 56,43оС.
Ткип( )
=56оС.
)
=56оС.Температура замерзания сыворотки крови равна -0,56оС. Рассчитайте моляльную концентрацию солей в крови, условно считая все соли бинарными и полностью распадающимися на ионы по схеме:
 .
Наличие в сыворотке неэлектролитов во
внимание не принимать.
.
Наличие в сыворотке неэлектролитов во
внимание не принимать.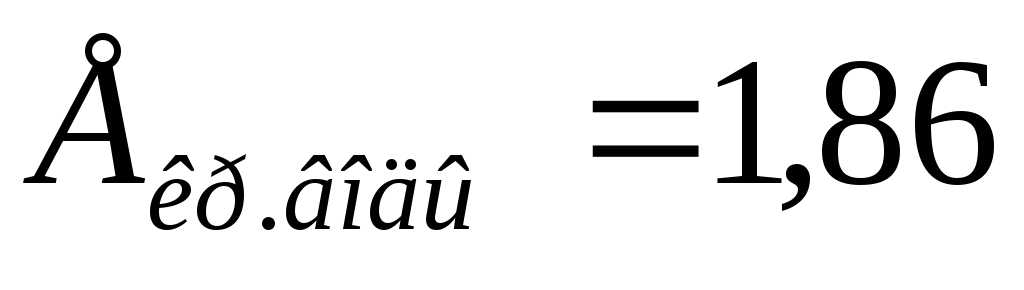 К∙кг/моль.
К∙кг/моль.
