
Мет_указ [2ч] _022014_ - Рек_К, Сушка, Абсор _фото_
.pdf
Пермский национальный исследовате льский
политехн ический университет
Кафедра «Машины и ап араты производственных про ессов»
ПРОЦЕСС Ы И АППАР АТЫ ХИМИЧЕ СКОЙ ТЕХН ОЛОГИИ (2 ча сть)
етодические указания к лабораторным работам: |
|
|
Лаб ораторн я работа №1 |
« бсорбция» ....... ............................................ |
3 |
Лаб ораторн я работа №2 |
« Испытание ректификаци нной колонны» .. |
14 |
Лаб ораторн я работа №3 |
« Исследование конвективной сушки |
|
твердого тела» ...................... |
........................... .......................................... |
34 |
Пермь 2014
Составители: С.Х. Загидуллин, А.Г. Хлуденев, В.М. Беляев, И.Г. Ложкин
Процессы и аппараты химической технологии: Методические указа-
ния к лабораторным работам. Ч.2. Сост. С.Х. Загидуллин, А.Г. Хлуденев, В.М. Беляев, И.Г. Ложкин; Перм. нац. исслед. политех. ун-т. – Пермь, 2011, – 45 с.
Дано описание трех лабораторных установок по изучению массообменных процессов, порядок работы на них. Рассмотрена методика обработки экспериментальных данных.
Пермский национальный исследовательский политехнический университет, 2014
2
Лабораторная работа №1 «Абсорбция»
Цели лабораторной работы:
–практическое ознакомление с процессом абсорбции;
–определение опытного значения коэффициента массопередачи и сравнение его с расчетным значением.
Краткие сведения из теории
Абсорбцией называется процесс поглощения газов или паров из газовых или парогазовых смесей жидкими поглотителями (абсорбентами). При физической абсорбции поглощенный газ не взаимодействует химически с поглощающей жидкостью. Изменяя условия проведения процесса, можно выделить растворенный газ из жидкости, т.е. провести процесс десорбции. Если между газом и жидкостью происходит химическое взаимодействие, процесс называется хемосорбцией.
Для системы газ – жидкость переменными, влияющими на процесс, являются температура, давление и концентрация извлекаемого компонента. Существует несколько способов выражения концентрации компонента в газовой и жидкой фазах. Наибольшее распространение получили относительные концентрации:
Y кмоль компонента / кмоль инертного газа,
X кмоль компонента / кмоль растворителя.
Концентрация выражается также мольными или массовыми долями компонента в смеси x , y .
Используется также объемная концентрация:
сГ кг компонента / м3 газовой смеси (г/л);
сЖ кг компонента / м3 раствора (г/л).
Вчастности, объемную концентрацию компонента в газе (г/л) можно рассчитать по уравнению
|
с |
Г |
|
МК |
y , |
(1) |
|
|
|||||
|
|
22,4 |
|
|
||
где МК – |
молекулярная масса компонента; |
|
||||
y – |
объемная доля компонента в газовой фазе. |
|
||||
3
На границе раздела фаз газ – жидкость происходит непрерывный переход компонента из одной фазы в другую. С течением времени устанавливается состояние динамического равновесия, при котором скорости переноса молекул в обоих направлениях одинаковы. Равновесие в системах газ – жидкость при физической абсорбции описывается законом Генри: равновесная упругость компонента над раствором пропорциональна его мольной доле в жидкости:
р* Ех, |
|
(2) |
|
где Е – константа Генри, имеющая размерность давления, |
|
||
х – мольная доля компонента в жидкости. |
|
||
Возможна и такая запись закона Генри: |
|
||
р* Ес |
Ж |
, |
(3) |
|
|
|
|
где сЖ – объемная концентрация компонента в жидкости, г/л;
Е – константа Генри, мм рт.ст./(г/л).
Если концентрация компонента в какой-либо фазе отличается от равновесной, то будет протекать процесс абсорбции (или десорбции), причем движущей силой процессов является разность между фактической (рабочей) концентрацией компонента и его равновесной концентрацией в этой же фазе. Выражения для движущей силы могут различаться в зависимости от способов
выражения концентрации, например: |
|
у у у*, |
(4) |
х х х*, |
(5) |
где у, х – рабочие концентрации компонента соответственно в газовой и жидкой фазах;
у*, х* – равновесные концентрации компонента.
В тех случаях, когда определяющей стадией процесса является перенос компонента в газовой фазе, можно использовать уравнение:
р р р* , |
(6) |
где р – парциальное давление компонента в газовой фазе; р*– равновесная упругость компонента над раствором, определяе-
мая по закону Генри.
Если р > р*, то происходит абсорбция компонента поглотителем. При р < р* компонент десорбируется из жидкой фазы в газовую.
4
Связь парциального давления компонента р с объемной долей его в газе описывается законом Дальтона:
|
|
р Ру, |
(7) |
|
где |
Р– общее давление. |
|
|
|
|
Расчет массообменной аппаратуры производится с использованием |
|||
основного уравнения массопередачи: |
|
|
||
|
М КY F уСР КХ F хСР , |
(8) |
||
где |
М – количество компонента, перешедшего из одной фазы в другую; |
|||
|
F – поверхность контакта фаз; |
|
|
|
|
уСР , хСР – средняя движущая сила процесса, выраженная соответ- |
|||
ственно через концентрации газовой и жидкой фаз; |
|
|||
|
КY , КX – коэффициент массопередачи, выраженный аналогично. |
|||
|
Применительно к условиям лабораторной работы основное уравнение |
|||
массопередачи можно записать в виде: |
|
|
||
|
М kF pСР |
(9) |
||
при следующих размерностях: |
p |
– мм рт.ст., |
k – г/(ч м2 мм рт. cт.), |
|
|
|
СР |
|
|
F – м2.
При выполнении лабораторной работы это уравнение применяется для вычисления опытного значения коэффициента массопередачи.
Для определения количества компонента, переносимого через границу раздела фаз, составляется материальный баланс:
где G , L – |
М G(YН YК ) L(X К X Н ), |
(10) |
массовые расходы инертного газа (воздуха) и растворителя |
||
(воды); |
|
|
YН , YК – |
концентрация компонента в газе на входе и выходе из |
|
абсорбера; |
|
|
X Н , X К – |
концентрация компонента в жидкости на входе и выходе |
|
из абсорбера. |
|
|
Для абсорбции аммиака водой из аммиачно-воздушной смеси, осуществляемой в лабораторной работе в условиях пленочного течения жидкости, материальный баланс (при противоточном движении фаз) выражается уравнением:
M V |
(сН сК ) W (сК |
сН ) , |
(11) |
|
СМ |
Г Г |
Ж |
Ж |
|
где M – количество абсорбированного аммиака, г/ч;
5

VСМ – расход аммиачно-воздушной смеси, л/ч;
W– расход воды, л/ч;
сГН , сГК – начальная и конечная концентрации аммиака в газе, г/л ;
сЖН , сЖК – начальная и конечная концентрации аммиака в жидкости, г/л.
Учитывая, что на абсорбцию подается чистая вода, для которой сЖН 0 , получим:
сК |
M . |
(12) |
Ж |
W |
|
Всвязи с тем, что движущая сила процесса (разность между рабочей
иравновесной концентрациями) изменяется по длине аппарата, в основное уравнение массопередачи (9) входит средняя движущая сила, определяемая как средняя логарифмическая:
р |
|
рБ |
рМ |
, |
(13) |
|
СР |
|
ln |
р |
|
|
|
|
Б |
|
|
|
||
|
|
|
|
|
||
|
|
рМ |
|
|
||
где рБ , рМ – наибольшее и наименьшее значения движущей силы в
абсорбере на входе и выходе, мм рт.ст.
Для условий лабораторной работы распределение давлений схематично можно представить таким образом:
р |
Н |
р |
К |
р |
Б |
р |
Н |
р* |
, |
|
|
|
|
|
Н |
|
|||||
р*Н |
р*К |
р |
М |
р |
К |
р* . |
||||
|
|
|
|
|
|
|
К |
|
||
Здесь рН , рК – парциальное давление аммиака в смеси на входе и выходе из аппарата;
р*Н , р*К – равновесная упругость аммиака над раствором на входе и выходе из абсорбционной трубки.
Значения рН и рК определяются по закону Дальтона, а р*Н и р*К –
по закону Генри для соответствующих объемных концентраций аммиака в газе и жидкости.
При абсорбции аммиака в условиях пленочного течения абсорбента поверхность раздела фаз является фиксированной и равной внутренней поверхности абсорбционной трубки:
F dL , |
(14) |
где d – внутренний диаметр трубки, м; L – длина трубки, м.
6
Опытное значение коэффициента массопередачи, определяемое по уравнению (9), с использованием экспериментальных данных, необходимо сравнить со значением, полученным на основании теоретического расчета.
Перенос вещества из одной фаз в другую складывается из переноса абсорбируемого компонента из основной массы газа к поверхности контакта и переноса компонента от поверхности контакта в глубь массы жидкости. Коэффициент массопередачи, характеризующий скорость суммарного процесса переноса массы, может быть представлен в виде
k |
|
|
1 |
|
|
, |
k |
|
|
|
|
1 |
|
, |
(15) |
|
1 |
m |
|
|
|
1 |
|
1 |
|||||||||
У |
|
|
|
|
Х |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У |
Х |
|
|
|
|
|
|
Х |
m У |
|
|
|||
где kУ – коэффициент массопередачи, выраженный через концентрацию компонента в газовой фазе;
kХ – коэффициент массопередачи, выраженный через концентрацию
компонента в жидкой фазе;У – коэффициент массоотдачи в газовой фазе;
Х – коэффициент массоотдачи в жидкой фазе;
m – константа фазового равновесия, аналогичная константе Генри. Для газов с малой растворимостью величина m весьма велика, по-
этому можно записать
k |
|
Х |
|
, |
k |
Х |
|
Х |
. |
(16) |
|
||||||||||
У |
|
m |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
m мала, поэтому можно |
||
Для хорошо растворимых газов величина |
||||||||||
принять |
|
|
|
|
kХ m У. |
|
||||
kУ У , |
|
(17) |
||||||||
Расчет коэффициентов массоотдачи У и Х производится с ис-
пользованием теории подобия. Конкретные случаи массоотдачи в газовой и жидкой фазах описываются критериальными уравнениями вида:
NuД ARem(PrД )n , |
(18) |
где коэффициент A и показатели степеней m и n – постоянные числа; Nu Д d / D – диффузионный критерий Нуссельта;
Re wd / – критерий Рейнольдса;
PrД / D – диффузионный критерий Прандтля;
– коэффициент массоотдачи;
7
d – определяющий линейный размер (диаметр трубки); D – коэффициент молекулярной диффузии;
w – линейная скорость потока;
– кинематическая вязкость.
Для условий лабораторной работы (абсорбция хорошо растворимого газа) справедливы уравнения (17), а коэффициент массоотдачи в газовой фазе может быть рассчитан из критериального уравнения:
Nu 0,05Re0Г,83 (Pr)0,44 |
(19) |
при следующих размерностях величин, входящих в критерий Нуссельта: d – м, D – м2/ч, – г/(ч м2 мм рт.cт.).
Описание установки и ее работы
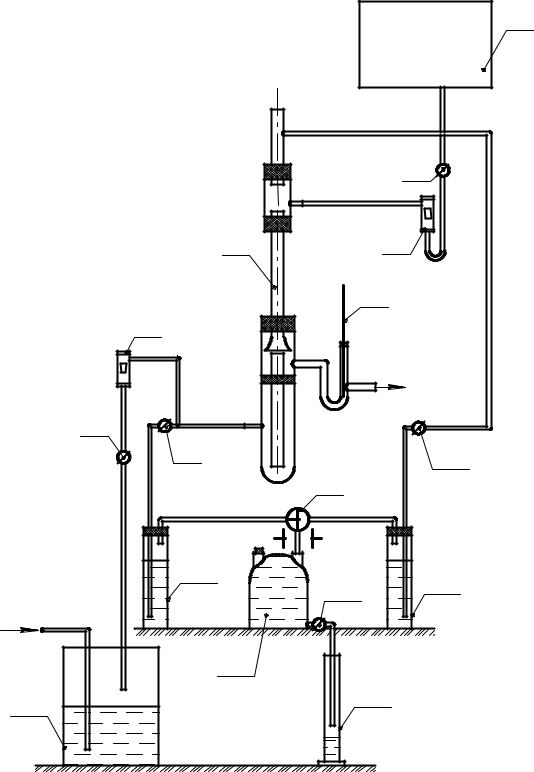
Схема установки для проведения процесса абсорбции представлена на рис.1.
Основной частью установки является абсорбционная трубка 4. Внутренний диаметр трубки 18 мм, длина – 320 мм.
Поглощение аммиака из его смеси с воздухом происходит водой, стекающей пленкой по внутренней поверхности трубки. Вода поступает из напорного бака 1; расход ее регулируется вентилем 2 и измеряется ротаметром РС-3а; температура воды измеряется термометром 5. Аммиак увлекается воздухом из емкости с аммиачной водой 14 и дозируется с помощью вентиля 7 по расходомеру 6.
Концентрация аммиака в аммиачно-воздушной смеси определяется по поглощенному серной кислотой количеству аммиака, пропускаемого через дрексели 10 и 12. Замер количества вытекшей при этом из аспиратора 13 воды осуществляется мерным цилиндром 15.
Приступить к работе можно только после детального ознакомления с установкой. Пуск установки производится с разрешения преподавателя в следующем порядке:
1.Открыть запорный вентиль для подачи воды в напорный бак и дождаться перелива. В дальнейшем следить за работой перелива, не допуская понижения уровня воды в напорном баке.
2.Регулирующим вентилем 2 установить по ротаметру 3 заданный преподавателем расход воды (градуировочный график для ротаметра прилагается). Следить за тем, чтобы вода равномерно омывала всю поверхность абсорбционной трубки.
8
3.Открыть запорный вентиль на воздушной линии.
4.Регулирующим вентилем 7 установить по ротаметру 6 заданный преподавателем расход аммиачно-воздушной смеси (градуировочный график для ротаметра прилагается).
5.Залить в дрексель 10 – 10 мл, а в дрексель 12 – 2 мл 0,1 н. раствора серной кислоты, прибавить несколько капель метилоранжа и долить до отметки дистиллированной водой.
6.Наполнить водой аспиратор 13.
7.Через 10…15 минут после пуска установки замерить концентрацию аммиака в аммиачно-воздушной смеси на входе в абсорбционную трубку.
Для этого:
а) поставить трехходовой кран 9 в положение А; б) при закрытом вентиле 8 проверить аспиратор на герметичность, открыв
кран 11; после того как вода не будет выливаться из аспиратора, слить воду из мерного цилиндра 15;
в) открыть вентиль 8 и с небольшой скоростью пропускать через дрексель 10 аммиачно-воздушную смесь до обесцвечивания (или появления желтого цвета);
г) закрыть кран 11 и вентиль 8; замерить количество вытекшей из аспиратора воды.
8.Замерить в той же последовательности концентрацию аммиака в амми- ачно-воздушной смеси на выходе из абсорбционной трубки, поставив трехходовой кран в положение Б.
9.После окончания работы закрыть регулирующие и запорные вентили. Все измеренные величины занести в табл. 1.
|
Опытные результаты |
Таблица 1 |
|
|
|
|
|
|
|
Наименование величины |
Измеренные |
|
|
значения |
1. |
Расход аммиачно-воздушной смеси VСМ , л/ч |
|
2. |
Расход воды W , л/ч |
|
3. |
Количество вытекшей из аспиратора воды |
|
при замере концентрации аммиака, мл: |
|
|
|
– на входе в абсорбционную трубку VВН |
|
|
– на выходе из абсорбционной трубки VВК |
|
4. |
Температура воды t , 0С |
|
5. |
Барометрическое давление Р, мм рт.ст. |
|
9
1
|
|
2 |
4 |
|
3 |
|
|
5 |
6 |
|
|
|
|
слив воды |
7 |
|
|
8 |
|
16 |
|
|
|
|
9 |
|
А |
Б |
|
10 |
11 |
12 |
|
||
вход воздух |
|
|
|
|
|
13 |
|
|
14 |
|
15 |
|
|
Рис. 1. Схема абсорбционной установки: 1 – напорный бак; 2,7 – регулирующие вентили; 3 – ротаметр РС-3а для измерения расхода воды; 4 – абсорбционная трубка; 5 – термометр; 6 – ротаметр РС-3а для измерения расхода аммиачновоздушной смеси; 8,16 – вентили для пуска аммиачно-воздушной смеси в дрексели; 9 – трехходовой кран; 10, 12 – дрексели; 11 – кран; 13 – аспиратор; 14 – емкость с аммиачной водой; 15 – мерный цилиндр.
10
