
Rastvory_i_biopolimeryEkz
.pdf
Растворы и биополимеры в медицине.
РАСТВОРЫ
1. Концентрацию веществ в растворах можно выразить разными способами. На этой страничке вы с ними познакомитесь. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд.
Пересчет концентраций растворов из одних единиц в другие:
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с - процентная концентрация; M - молярная концентрация; N - нормальная концентрация; э - эквивалентная масса, r - плотность раствора; m - мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c • p • 10) / m
N = (c • p • 10) / э
От массовой доли к молярности:
где:
ρ — плотность раствора, г/л; ω — массовая доля растворенного вещества в долях от 1;
M1 — молярная масса растворенного вещества, г/моль.
От молярности к нормальности: N= M×z
M — молярность, моль/л; z — число эквивалентности.
От массовой доли к титру:
от=1; |
, |
|
∙ |
|
где: ρ — плотность раствора, кг/л; ω — массовая доля растворенного вещества в долях |
Т |
|
|
|
|
|
От молярности к титру: |
|||||
где= |
, |
∙ |
М |
∙ |
М |
Т |
|
|
|
||
M — молярность, моль/л;
M1 — молярная масса растворенного вещества, г/моль
От молярности к моляльности:
=
∙
∙ − ∙
где:
M — молярность, моль/л;
ρ — плотность раствора, г/мл;
M1 — молярная масса растворенного вещества, г/моль.

От моляльности к мольной доле:
=
+
где:
mi — моляльность, моль/кг;
M2 — молярная масса растворителя, г/моль.
2. Слабые электролиты- вещества частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1)почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2)некоторые неорганические кислоты (H2CO3, H2S и др.);
3)почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
4)вода.
Они плохо (или почти не проводят) электрический ток.
Степень диссоциации. Константа диссоциации.
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита (стехиометрическим индексам).
Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.
Степень диссоциации (a) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N): a = n / N
и выражается в долях единицы или в % (a = 0,3 – условная граница деления на сильные и слабые электролиты).
Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов. Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе
слабого электролита можно рассчитать, зная степень диссоциации a и исходную концентрацию вещества c в растворе.
Константа диссоциации (KD) - отношение произведения равновесных концентраций ионов в степени соответствующих стехиометрических коэффициентов к концентрации недиссоциированных молекул.
Она является константой равновесия процесса электролитической диссоциации; характеризует способность вещества распадаться на ионы: чем выше KD, тем больше концентрация ионов в растворе.
Закон Оствальда: |
|
||
[ |
]∙[ |
] |
|
= |
[ ] |
= |
= ( ) |
где:
[KA] — концентрация недиссоциированного соединения в растворе; [K+] — концентрация катионов в растворе;
[A−] — концентрация анионов в растворе.
Константу равновесия применительно к реакции диссоциации называют константой диссоциации.
3. Электролиты-вещества, которые в растворенном состоянии проводят электрический ток.
Способность электролитов диссоциировать на ионы служит мерой силы данного электролита. Хорошо диссоциирующие электролиты называются сильными (NaCl, Na2SO4, HCl, KOH и др.)
Межионное взаимодействие, а также сольватация (электростатическое взаимодействие между частицами растворенного вещества и растворителя) ионов уменьшат не только скорость их движения, но и осмотическое давление растворов, величину понижения давления пара над ними и т.п. Все это может привести к неправильному выводу, что в растворе имеется меньше ионов, чем в действительности. Так, измерение электропроводности показывает кажущуюся неполную диссоциацию сильных электролитов в концентрированных растворах.
Кажущаяся степень диссоциации, также как и степень диссоциации в концентрированных растворах меньше единицы и увеличивается с уменьшением концентрации, стремясь к единице. Но в растворах сильных электролитов это связано с образованием из сольватированных ионов ассоциатов, которые ведут

себя как недиссоциированные молекулы, т.е. не участвуют в переносе электричества и движутся как единое целое.
Кажущаяся неполная диссоциация сильных электролитов позволяет вместо истинной концентрации ионов использовать так называемую активность (а), т.е. величину, равную активно проявляющейся концентрации ионов. Заменяя значения концентрации ионов и молекул их активностями, можно условно представить, например, диссоциацию HCl как неполную и вывести уравнение константы равновесия этой реакции
С увеличением разбавления сила межионного взаимодействия уменьшается, и значения активностей ионов и молекул также изменяются, все более приближаясь к истинному значению их концентраций.
По истинной концентрации частиц электролитов можно найти их активность через коэффициент активности
где а – активность; с – аналитическая концентрация; γ – коэффициент активности.
Коэффициент активности различен у разных ионов; он равняется единице при большом разбавлении, когда а=С. При увеличении концентрации электролита все сильнее проявляются силы межионного взаимодействия, активность и коэф. активности уменьшаются. Особенно резко выражено это уменьшение в растворах, содержащих многозарядные ионы, у которых межионное взаимодействие особенно сильно.
Однако при очень больших концентрациях некоторых электролитов коэф. активности вновь начинает расти, что объясняется недостатком молекул воды для гидратации всех ионов. Ионы, частично или полностью лишенные оболочки, особенно легко подвижны. В связи с этим фактором активность в подобных растворах оказывается выше действительной концентрации частиц, а коэф. активности становится больше единицы.
 Ионной силой (µ) раствора электролита называют
Ионной силой (µ) раствора электролита называют
величину, измеряемую полусуммой произведения концентрации C каждого из присутствующих в растворе ионов на квадрат его валентности Z.
Коэф. активности ионов связан с ионной силой разбавленного раствора следующим соотношением:
из которого следует, что чем больше ионная сила раствора, тем меньше коэффициент активности его ионов. Если ионные силы двух растворов равны, то коэффициенты активности ионов равной валентности в них
одинаковы.
Сильные электролиты практически полностью диссоциируют даже в концентрированных растворах.
Классическая теория Аррениуса (эта теория объясняет электропроводность растворов тем, что молекулы электролитов в воде и некоторых других растворителях диссоциируют на ионы-частицы несущие электрические заряды) оказалось недостаточной для объяснения свойств растворов сильных электролитов. Ранее изложенные преставления о диссоциации электролитов в растворе дополнили Дебай и Гюккель теорией, согласно которой в таких растворах действуют электростатические силы притяжения между разноименными ионами и силы отталкивания между одноименными (другими словами ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемую ионную атмосферу). Чем выше концентрация растворов, тем плотнее ионная атмосфера и тем медленнее движутся ионы. Силы
взаимодействия между многовалентными ионами выше, чем между одновалентными. Отсюда снижение подвижности многовалентных ионов оказывается большим, чем у одновалентных.
4. Растворение газов в жидкостях называют абсорбцией газов жидкостями. Концентрация большинства таких растворов невелика. Растворимость газа, выраженная в молях на 1000г растворителя, при постоянно температуре прямо пропорциональна его давлению над раствором (з-н Генри): C=K`р, где
С- моляльная концентрация газа в жидкости, р- давление газа, K`- коэффициент растворимости, равный

количеству молей газа, растворяющегося в 1000г растворителя при давлении газа в 1атм. Коэффициент K` зависит от природы газа, растворителя и температуры.
Газы, молекулы которых полярны, лучше растворяются в полярных растворителях. Некоторые газы при растворении вступают в химическое взаимодействие растворителем или диссоциируют на ионы, что резко повышает их растворимость. С повышением температуры растворимость газов обычно уменьшается. Сеченов, изучая растворимость газов, установил, что присутствие электролитов в растворе понижает растворимость газов:
В крови содержатся электролиты, белки, липоиды и другие вещества, их концентрация может меняться в известных пределах, оказывая некоторое влияние на растворимость в крови CO2 и О2.
Изменение растворимости газов под влиянием перемены давления может обуславливать тяжелую патологию. Резкое понижение атмосферного давления приводит к «закипанию» крови вследствие выделения растворенных в ней газов, их пузырьки закупоривают мелкие сосудики в мозгу и других органах, что может привести к серьезным заболеваниям и гибели человека. Улучшение снабжения тканей кислородом достигается помещением больных в палаты с повышенным давлением кислорода в воздухе.
5. Коллигативными называют такие свойства раствора, которые зависят только от концентрации
растворенного вещества и природы растворителя, но не зависят от природы растворенного вещества. К этим свойствам относятся: 1) понижение давления насыщенного пара над раствором; 2) понижение температуры замерзания; 3) повышение температуры кипения; 4)осмотическое давление.
Коллигативные свойства раствора — это свойства идеального раствора.
Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а сила межмолекулярного взаимодействия однородных и разнородных частиц одинакова.
Соответственно, образование этих растворов не сопровождается тепловым эффектом ( Н = 0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества.
Н = 0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества.
Понижение давления насыщенного пара над раствором.
Одно из важнейших явлений, характерных для жидких растворов, — понижение давления насыщенного пара растворителя над раствором по сравнению с давлением насыщенного пара чистого растворителя.
Давление насыщенного пара при данной температуре характеризует равновесие между жидким и газообразным состоянием вещества в закрытой системе, возникающее на границе раздела фаз вследствие выравнивания скоростей эндотермического процесса испарения и экзотермического процесса конденсации. В растворе концентрация молекул растворителя в поверхностном слое меньше, чем в чистом растворителе (молекулы растворенного вещества сольватируясь (гидратируясь) занимают часть поверхности раствора), поэтому равновесие достигается при меньшем давлении насыщенного пара.
Выражение Р0А–РА = РА = Р0А· Nв количественно выражает связь между концентрацией растворенного вещества в растворе и давлением насыщенного пара растворителя над раствором. Его называют законом
Рауля: понижение давления насыщенного пара растворителя А над раствором Р0А· пропорционально мольной доле растворенного нелетучего вещества ·Nв.
Здесь Р0А и РА — давления насыщенного пара растворителя соответственно над чистым
растворителем и над раствором; РА – разность между давлениями насыщенного пара растворителя над раствором РА и растворителем Р0А.
Из выражения закона Рауля следует, что с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
6. Из закона Рауля возникают два следствия. Согласно одному из них температура кипения раствора выше температуры кипения растворителя. Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя.
Повышение температуры кипения Ткип. пропорционально моляльности раствора.
Ткип. = Кэ ·Сm ,
где Кэ — эбуллиоскопическая постоянная. Она означает повышение температуры кипения раствора при его моляльной концентрации, равной 1.
Вспомнив определение моляльности раствора можно записать:
Ткип. = Кэ mр.в.·1000/М·mр-ля
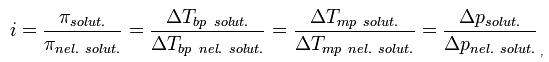
Согласно второму следствию из закона Рауля температура замерзания (кристаллизации) раствора ниже температуры замерзания (кристаллизации) чистого растворителя. Раствор замерзает при более низкой температуре, чем растворитель, так как молекулы растворенного вещества при понижении температуры препятствуют формированию кристаллической решетки при затвердевании раствора.
Понижение температуры замерзания (кристаллизации) ?Тзам. пропорционально моляльности раствора:
Тзам. = Кк ·Сm
или Тзам. = Кк mр.в.·1000/М·mр-ля
где Кк — криоскопическая постоянная. Она означает понижение температуры затвердевания раствора при его моляльной концентрации, равной 1.
Значения Кэ и Кк зависят от природы растворителя ине зависят от природы растворенного вещества и
его концентрации.
Значения Кэ и Кк — справочные величины.
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i)— безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
Взаимодействие ионов уменьшается с уменьшением их концентрации, то есть, разбавлением раствора, ведь тогда уменьшается вероятность встречи двух частичек. Экстраполируя разбавление в сторону бесконечности, коэффициент i стремится к своему максимальному значению, определяемому по формуле растворённого соединения. Степень диссоциации α, в соответствии с вышеупомянутой формулой зависимости между i и α, одновременно возрастает, приближаясь к единице (1).
7. Осмос – это преимущественно одностороннее проникновение молекул
растворителя (диффузно) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическое давление – величина, измеряемая минимальным гидравлическим давлением, которое нужно
приложить к раствору, чтобы осмос прекратился.
Вант-Гофф предложил эмпирическое уравнение для расчета осмотического давления разбавленных растворов неэлектролитов:
= С(х) , где π- осмотическое давление, кПа С(х) – молярная концентрация, моль/л
R – универсальная газовая постоянная (8,31 кПа л/моль К) Т – абсолютная температура, К
Закон следует рассматривать как следствие 2-го начала термодинамики, т.к. он может быть выведен
из условий термодинамического равновесия при |
. |
К (37оС) составляет 780 кПа или 7,7 атм (Такое же |
при 310 |
||
Осмотическое давление крови человека ∆ |
= 0 |
|
давление создает и 0,9%-ный водный раствор NaCl (0,15 моль/л), который, следовательно, изотоничен с кровью).
8. Осмос – это преимущественно одностороннее проникновение молекул
растворителя (диффузно) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическое давление – величина, измеряемая минимальным гидравлическим давлением, которое нужно
приложить к раствору, чтобы осмос прекратился.
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением.
Изотонические растворы – растворы, которые имеют одинаковое осмотическое давление по отношению друг к другу.
Гипертонические растворы – раствор с большим осмотическим давлением по отношению к другому раствору. 2% раствор NaCl

Гипотонический раствор – раствор с меньшим осмотическим давлением по отношению к другому раствору. 0,1% раствор NaCl
Плазмолиз – явление, при котором клетка, помещенная в гипертонический раствор, сжимается и сморщивается. Вода выходит из клетки.
Гемолиз – явление, при котором клетка, помещенная в гипотонический раствор, клетка набухает и разрывается. Вода поступает в клетку.
9.
10.
10
11. Протолитическая теория Бренстеда и Лоури. Классификация кислот и оснований в свете этой теории. Сильные и слабые электролиты, виды кислотности.
Бренстед и Лоури выдвинули новую теорию кислот и оснований, основанную на представлении о переносе протона. Согласно этой теории, кислота представляет собой вещество, состоящее из молекул или ионовдоноров протонов (т. к. они отдают протоны), а основание-вещество, состоящее из молекул или ионовакцепторов протонов (т.к. они принимают протоны).
По этой теории кислотой называют всякое вещество, молекулы которого (в том числе и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называют всякое вещество, молекулы которого (в том числе и ионы) способны присоединять протон, т.е. быть акцептором протонов; амфолитом называют всякое вещество, которое является и донором, и акцептором протонов.
Данная теория объясняет кислотно-основные свойства не только нейтральных молекул, но и ионов. Кислота, отдавая протон, превращается в основание, которое является сопряженным этой кислоте. Понятия «кислота» и «основание» являются относительными понятиями, так как одни и те же частицы - молекулы или ионы - могут проявлять как основные, так и кислотные свойства в зависимости от партнера.
Классификация органических кислот и оснований по Брендстеду
Кислоты и основания Бренстеда классифицируют по природе атома при кислотном или основном центре.
Взависимости от природы элемента, с которым связан протон, различают четыре основных типа органических кислот Бренстеда:
O-H – кислоты - карбоновые кислоты, спирты, фенолы;
S-H – кислоты - тиолы;
N-H – кислоты - амины, амиды, имиды;
C-H – кислоты - углеводороды и их производные.
Взависимости от природы атома, к неподеленной паре электронов которого присоединяется протон, основания Бренстеда делят на три основных типа:
o аммониевые основания - амины, нитрилы, азотсодержащие гетероциклические соединения; o оксониевые основания - спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты и
их функциональные производные;
o сульфониевые основания - тиолы, сульфиды.
Особый тип оснований Бренстеда представляют -основания, в которых центром основности являются электроны -связи (алкены, арены).
Кислоты и основания Льюиса
Дж. Льюисом была предложена более общая теория кислот и оснований.
Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.) Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3).
Таким образом, основания Бренстеда и Льюиса – это одни и те же частицы. Однако основность по Бренстеду есть способность присоединять только протон, в то время как основность по Льюису – понятие более широкое и означает способность к взаимодействию с любой частицей, имеющей низколежащую свободную орбиталь.
Кислотно-основное взаимодействие по Льюису есть доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно представить как взаимодействие кислоты и основания Льюиса
Сильные и слабые электролиты
Электроли́—т вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Различают сильные и слабые электролиты. Сильные электролиты в растворах практически диссоциированы полностью. К этой группе электролитов относится большинство солей, щелочей и сильных кислот. К слабым электролитам принадлежат слабые кислоты и слабые основания и некоторые соли: хлорид ртути (II), цианид ртути (II), роданид железа (III), иодид кадмия. Растворы сильных электролитов при больших концентрациях обладают значительной электропроводностью, причем она с разбавлением растворов возрастает незначительно.
Растворы слабых электролитов при больших концентрациях отличаются незначительной электропроводностью, сильно увеличивающейся при разбавлении растворов.
Исходя из степени диссоциации все электролиты делятся на две группы
1.Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
2.Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Виды кислотности
Компонентами буферной смеси может быть только слабые кислоты или слабые основания, так как они диссоциируют частично. Поэтому в растворах кислот различают активную, потенциальную(резервную) и общую кислотность.
Активная кислотность измеряется активностью (концентрацией) свободных водород-ионов в растворе. Определяет рН раствора.
Потенциальная килотность измеряется количеством водород-ионов, связанных в молекулы кислоты,
то есть представляет собой «запас» недиссоциированных молекул кислоты
Сумма активной и потенциальной кислотностей составляет общую кислотность, которая определяется общей(аналитической) концентрацией кислоты и устанавливается титрованием.
12. Буферные растворы, их классификация, состав и свойства. Вывод уравнения ГендерсонаГассельбальха для кислотных и основных буферных систем. Буферная кривая.
Буферными системами называют растворы, которые не изменяют величины pH при:
добавлении к ним небольшого количества кислоты или основания
разбавлении
Классификация кислотно-основных буферных систем
1. Слабая кислота и ее анион
Ацетатная буферная система CH3COO--/CH3COOH
Врастворе CH3COONa и CH3COOH
Область действия: интервал pH 3,8 – 5,8
Водороднокарбонатная бс HCO3--/H2CO3 В растворе NaHCO3 и H2CO3
Область действия : pH 5,4 – 7,4
2.Слабое основание и его катион
Аммиачная бс NH3/NH4+
Врастворе NH3 и NH4Cl Область действия: pH 8,2 – 10,2
3.Анионы кислой и средней соли или двух кислых солей
Карбонатная бс CO32--/HCO3
Врастворе Na2CO3 и NaHCO3 Область действия: pH 9,3 – 11,3
Фосфатная бс HPO42--/HPO4--
Врастворе Na2HPO4 и NaH2PO4
Область действия: pH 6,2 – 8,2
4.Ионы и молекулы амфолитов
Кним относят аминокислотные и белковые бс. Если аминокислоты и белки находятся в изоэлектрическом состоянии(т.е. суммарный заряд молекул равен 0) , то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка или аминокислоты переходит из изоэлектрического состояния в форму «белок-кислота» или «белок-основание», при этом образуется смесь 2-ух форм белка:
Слабая «белок-кислота» + соль этой слабой кислоты
Слабое «белок-основание» + соль этого слабого основания
Свойства БС:
При разбавлении водой рН практически не изменится.
При добавлении к буферной смеси небольшого количества сильной кислоты или основания
концентрация ионов Н+ почти не увеличится и рН раствора практически не изменится
Уравнения Гендерсона-Гессельбальха
Уравнение показывает как зависит кислотно-основное равновесие буферного раствора от свойств компонентов кислотно-основной буферной системы и от количественного соотношения этих компонентов в растворе.
Показателем кислотно-основного равновесия в растворе является водородный показатель, pH. Свойство кислоты (её способность распадаться на ионы), как составляющей буферной системы, характеризуется значением константы равновесия, константы диссоциации кислоты, K. (или в логарифмической
форме pK = – lgK, в частности, если K = 10–11, то |
pK = 11). Количественная структура (состав) буферной |
||||
системы может быть оценена в виде отношения соль/кислота (эквиваленты, эквивалентная масса). |
|||||
Учитывая сказанное, уравнение Гендерсона-Гассельбальха для кслотных бс выглядит следующим |
|||||
образом: |
|
|
|
|
|
pH= PK + lg |
Ссоли |
|
или |
||
Скислоты |
|||||
|
|
||||
|
|
Ссоли |
соли |
||
pH= PK + lg |
Скислоты |
кислоты |
|||
|
|
|
|
|
|
Уравнение Гендерсона-Гессельбальха для основных бс выглядит сдедующим образом:
рН = 14 – Рк + lg основания Ссоли
буферная кривая Согласно определению Бренстеда, кислотами называют такие вещества, которые в растворах отдают ионы
водорода (доноры протонов), а основаниями – вещества, связывающие эти ионы (акцепторы протонов). Подобное определение оказалось особенно плодотворным в области биологических наук. Рассмотрим с этих
позиций реакцию диссоциации
НА ↔H+ + А–.
При протекании этой реакции в прямом направлении (слева направо) НА представляет собой кислоту. Когда эта реакция в определенных условиях осуществляется в обратном направлении, анион А– является по определению основанием (он связывает ионы водорода). А– в данном случае называют сопряженным основанием. Между реакциями диссоциации и
ассоциации существует равновесие, подчиняющееся закону действующих масс. В случае сильных кислот, например НСl, равновесие в реакции (11) значительно смещено вправо. Если же НА представляет собой слабую кислоту, то диссоциация происходит не полностью. Степень ее зависит от константы равновесия Показатель рН. Кислотность или щелочность раствора зависит от содержания в нем свободных ионов водорода. Показателем этого содержания служит величина рН. По определению рН представляет собой отрицательный десятичный логарифм молярной концентрации ионов Н+:
pн=–lg[н+]. (12)
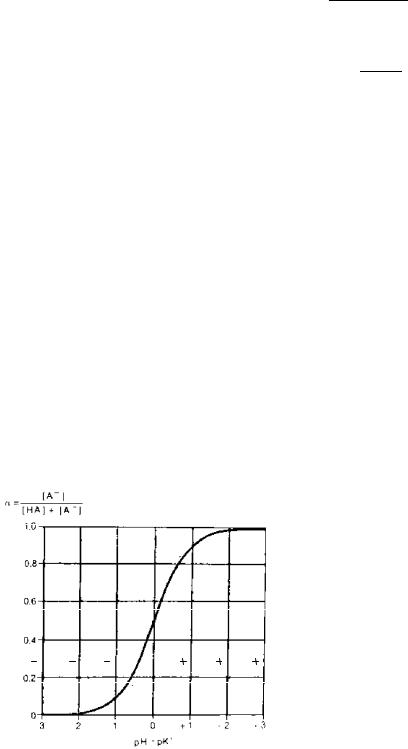
Таким образом, если рН 7 (нейтральная реакция среды), то концентрация ионов H+ [Н+] равна 10–7 моль/л. При увеличении кислотности раствора его рН снижается.
Показатель рН был вначале предложен для технических целей, однако оказалось, что он имеет особое значение для живых объектов. Дело в том, что электрохимический потенциал ионов пропорционален не их концентрации, а логарифму этой концентрации. В связи с этим можно предполагать, что степень возбуждения рецепторов, участвующих в поддержании кислотно–щелочного равновесия в организме человека или животного, пропорциональна не концентрации ионов H+, а. величине рН.
Зависимость степени диссоциации слабой кислоты от рН. рК'–отрицательный логарифм константы равновесия К'. Для получения подобных буферных кривых к раствору последовательно добавляют кратные количества Н+ или ОН– и измеряют рН после каждой добавки
13. Механизм действия буферных растворов.
1. Кислотный (ацетатный) буфер:
Кислотный резерв:
СН3СООН= Н(+)+СН3СОО(-)+Na(+)+ОН(-)= Н2О+СН3СОО(- )+Na(+)
Основный резерв:
СН3СООNa=Na(+)+CH3COO(-)+H(+)+Cl(- )=CH3COOH+Na(+)+Cl(-),
где (+), (-) – заряды ионов.
При добавлении к кислотному буферному раствору сильной кислоты, она заменяется эквивалентным количеством слабой кислоты.
Активная кислотность при добавлении сильной кислоты или основания практически не изменяется, а потенциальная при добавлении сильной кислоты увеличивается, а при добавлении основания – уменьшается.
2. Аммонийный буфер: NH4OH+HCl
NH4Cl+NaOH
Сильное основание заменится эквивалентным количеством слабого основания. Основное уравнение Гендерсона-Гассельбаха.
K= ([H(+)] [CH3COO(-)])/[CH3COO(-)]
[H(+)]= (K*[CH3COOH])/[CH3COO(-)]=(K[кислоты])/[соли] CH3COONa=Na(+)+CH3COO(-)
pK=-lgK
pH=pK(кислоты)+lg([соли]/[кислоты])=pK+lg(C1/zсоли*Vсоли)/ (C1/zкислоты*Vкислоты) – для кислотного буфера.
С=С1/z*V – моль эквивалента При разбавлении pH не меняется!
pH=14-pK(основания)-lg([соли]/[основание])
Буферная емкость.
Это число моль эквивалента сильной кислоты или сильного основания, которое надо добавить к 1 л. буферного раствора, чтобы его рН изменился на 1.
B=(C1/z(кислоты, основания)*V(кислоты, основания))/(V(буф.р-ра)*dpH) Буферная емкость зависит от факторов:
1.Чем больше количества компонентов кислотно-основной пары основание/сопряженная кислота в растворе, тем выше буферная емкость этого раствора.
2.Буферная емкость зависит от соотношения концентраций компонентов буферного
раствора, а следовательно, и от рН буфера. Буферная емкость с разбавлением уменьшается!
14.Буферные системы крови (главная буферная система).
Водородкарбонатный буфер. H2CO3=H(+)+HCO3(-) NaHCO3=Na(+)+HCO3(-) [NaHCO3]/[H2CO3]=[NaHCO3]/[pCO2]=20/1 CO2+H2O=H2CO3=H(+)+HCO3(-)
Когда емкость бикарбонатного буфера понижается, но рН еще не изменилось, возникает ацидоз. Некомпенсированный ацидоз – когда рН смещается в кислую сторону.
Водородкарбонатная буферная система наиболее «быстро» отзывается на изменение рН крови. Ее буферная емкость по кислоте составляет Вк=40 ммоль/л плазмы крови, а буферная емкость по щелочи значительно меньше и равна примерно Вщ=1-2 ммоль/л плазмы крови.
Фосфатный буфер. НРО4(2-) – основный резерв Н2РО4(-) – кислотный резерв НРО4(2-)/H2PO4(-)=4/1
Различия буферной емкости данной системы по кислоте и щелочи не столь велики, как у водородкарбонатной: Вк=1-2 ммоль/л; Вщ=0.5 ммоль/л. Поэтому фосфатная система участвует в нейтрализации как кислых, так и основных продуктов метаболизма. Это система медленного реагирования. В связи с малым содержанием фосфатов в плазме крови она менее мощная, чем водородкарбонатная буферная система.
В крови имеется также белковый буфер и гемоглобиновый буфер. В сыворотке крови нет аммонийного буфера!
15.Метод нейтрализации применяется для количественного определения кислот и щелочей. При помощи этого метода проводят также ряд других объемных определений, связанных с реакцией нейтрализации, например определение некоторых солей, образованных сильными основаниями и слабыми кислотами (Na2C03, Na2B407), или солей аммония.
При количественном определении кислот — алкалиметрия— рабочим раствором является раствор щелочи NaOH или КОН. Приготовить титрованный раствор щелочи по навеске невозможно, так как щелочь не отвечает требованиям, предъявляемым к веществам, из которых можно готовить раствор точной концентрации по точно взятой навеске. Кроме того, при самом тщательном хранении растворы щелочей довольно быстро меняют свой титр, поэтому титр этих рабочих растворов устанавливают. Исходным веществом для установления титра рабочего раствора щелочи может служить щавелевая кислота Н2С204- 2Н20 или янтарная кислота Н2С4Н4О4. Часто в лабораторной практике в качестве исходного
