
Rastvory_i_biopolimeryEkz
.pdfраствора употребляют 0,1 н. раствор кислоты, приготовленный из фиксанала.
При количественном определении щелочи — ациди-метрии— рабочим раствором является раствор сильной кислоты (обычно НС1 или H2S04J. Приготовить титрованный раствор кислоты исходя из концентрированной кислоты невозможно. Как бы точно мы ни взяли навеску концентрированной кислоты, мы не будем знать истинного ее количества, так как серная кислота гигроскопична, а концентрированная соляная кислота выделяет хлористый водород. Поэтому титр рабочих растворов кислот устанавливают. Исходным веществом для установки титра раствора кислоты служит бура Na2B40r10Н2О или химически чистая сода Na2C03. В некоторых случаях рабочий раствор кислоты готовят из фиксанала. Титр раствора кислот не меняется довольно продолжительное время.
Метод нейтрализации применяется в. клинических лабораториях для определения кислотности желудочного сока. В санитарно-гигиенических лабораториях метод нейтрализации находит самое широкое применение. При помощи этого метода определяют карбонатную жесткость воды, кислотность молочных продуктов, квашеной капусты и безалкогольных напитков.
Если титровать раствор любой кислоты раствором щелочи, происходит связывание ионов Н+ кислоты ионами ОН- и концентрация ионов Н+ постепенно уменьшается, а рН раствора возрастает (см. § 18). При определенном значении рН достигается точка эквивалентности и титрование должно быть закончено. При титровании раствора щелочи раствором кислоты связываются ионы ОН~, концентрация их в растворе уменьшается, а концентрация ионов Н+ увеличивается и рН раствора уменьшается. Однако величина рН в точке эквивалентности не во всех случаях имеет одно и то же значение, она зависит от природы реагирующей кислоты и основания.
При нейтрализации сильной кислоты сильным основанием НС1 + NaOH = NaCl + Н20
образуется только один слабый электролит — вода. Реакция практически доходит до конца. Образующаяся при реакции соль гидролизу не подвергается, и раствор 2Р2 имеет нейтральную реакцию (рН 7,0). Следовательно, при титровании сильной кислоты сильной
щелочью и наоборот в точке эквивалентности среда раствора нейтральна, рН раствора равен 7,0. Если титровать сильной - щелочью слабую кислоту, например, уксусную
CH3COOH + NaOH =s=fc CH3COONa-f Н20,
в точке эквивалентности будет присутствовать соль CH3COONa, подвергающаяся гидролизу: CH3COONa + Н20 ?—f СН3СООН + NaOH.
Следовательно, протекающая в данном случае при титровании реакция обратима и не пойдет до конца. В точке эквивалентности в растворе присутствуют свободные СНзСООН и NaOH. Слабая уксусная кислота будет находиться в растворе в основном в виде недиссо-циированных молекул, а едкий натр будет диссоциирован почти полностью. Концентрация ионов ОН- превысит концентрацию ионов Н+ и титрование закончится при рН>7,0. При титровании слабых оснований сильными кислотами, например
NH4OH + НС1 т—*■ NH4CI + н2о,
образующаяся соль подвергается гидролизу. Реакция нейтрализации обратима, и в точке эквивалентности концентрация ионов Н+ превысит концентрацию ионов ОН~. Титрование будет заканчиваться при рН<7,0. Таким образом, при методе нейтрализации точка эквивалентности совпадает с точкой нейтральности лишь при взаимодействии сильной кислоты с сильным основанием. При титровании необходимо установить точку эквивалентности, а не нейтральности и, следовательно, титрование в разных случаях приходится заканчивать при различных значениях рН.
ЗАКОН ЭКВИВАЛЕНТОВ
Еще до создания атомно–молекулярного учения было установлено, что простые и сложные вещества вступают в химические реакции в строго определенных массовых соотношениях.
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Рассмотрим реакцию взаимодействия гидроксида алюминия с серной кислотой:
2Al(OH)3+3H2SO4= Al2(SO4)3+6H2O.
Из уравнения следует, что 2 моль Al(OH)3 взаимодействует с 3 моль H2SO4, при этом образуется 1 мольAl2(SO4)3 и 6 моль H2O. Таким образом, количество моль реагентов и продуктов (пропорциональное стехиометрическим коэффициентам в уравнении) обычно неодинаково.
Теперь рассмотрим число моль эквивалентов веществ, участвующих в данной реакции. 6 Моль эквивалентовAl(OH)3 взаимодействует с 6 моль эквивалентов H2SO4, при
этом образуется 6 моль эквивалентов Al2(SO4)3 и 6 Моль эквивалентов H2O. Таким образом, количество моль эквивалентов реагентов и продуктов всегда одинаково.
Количество вещества(B), моль |
Al(OH)3 |
≠ |
H2SO4 |
≠ |
Al2(SO4)3 |
≠ |
H2O |
2 |
3 |
1 |
6 |
||||
Эквивалентное число z |
3 |
|
2 |
|
6 |
|
1 |
Количество эквивалентов (1/zB),моль |
6 |
= |
6 |
= |
6 |
= |
6 |

Для химической реакции, записанной в общем виде: |
|
|
||||||||||||||||||||||||||
aA + bB = cC + dD, |
|
|||||||||||||||||||||||||||
где A, B – реагенты, C, D – продуты, |
|
|
||||||||||||||||||||||||||
а,b,c,d – стехиометрические коэффициенты; |
|
|
||||||||||||||||||||||||||
справедливо равенство: |
|
|
||||||||||||||||||||||||||
(1/z А) = (1/z B) = (1/z С) = |
(1/z D) |
(8) |
||||||||||||||||||||||||||
Это выражение (8) является математической записью закона эквивалентов. |
||||||||||||||||||||||||||||
Число моль эквивалентов вещества можно рассчитать через массу т(В) вещества В: |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
(1/z B) = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(9) |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
или объем V(B) газообразного вещества В: |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
(1/z B) = |
|
|
|
|
|
|
|
(10) |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Закон эквивалентов дает возможность производить расчеты без уравнения реакции. Кроме того, из закона эквивалентов можно вывести еще одну формулу для расчета молярной массы эквивалента оксида:
М(1/z оксида) = М(1/z элемента) + М(1/z О) = М(1/z элемента) + 8 |
(11) |
Ацидиметрию см в тетради!
Кривые титрования. Кривая титрования – это график зависимости pH, оптической плотности или какихлибо других характеристик титруемого раствора (ось ординат) от объема добавленного титранта (ось абсцисс). Масштаб оси абсцисс всегда линейный, а оси ординат может быть линейным или логарифмическим. Линейный масштаб удобен для тех методов контроля за титрованием (спектрофотометрия, амперометрия), в которых контролируемый параметр меняется с концентрацией линейно, а логарифмический – в случае логарифмического изменения (например, при потенциометрии с ионоселективным электродом). Логарифмический масштаб часто используют при визуальном определении конечной точки титрования, поскольку именно в этом масштабе наиболее наглядно проявляется резкое изменение свойств раствора вблизи точки эквивалентности.(дополнительно см лекцию)
16 вопрос

16 вопрос (продолжение)
17. В основе определение лежит метод ацидиметрии. Для определения используется рабочий титрованный раствор соляной кислоты. Он приготавливается так: готовят раствор соляной кислоты примерно нужной нормальности, параллельно готовят раствор буры (Na2B4O7 * 10H2O), который является установочным
титрованным раствором. Его готовят методом растворения точной его навески в воде. Его титр определяется по формуле: T=g(масса буры)/Vр-ра . Затем с помощью буры титруют раствор соляной кислоты и определяют его концентрацию.
Ход определения. В мерную колбу добавляется исследуемый раствор и разбавляется дистиллированной водой до метки, перемешивается. Бюретка заполняется рабочим титрованным раствором до нулевой отметки. Необходимый объем исследуемого раствора переносится в колбу для титрования, сюда же добавляется 1-2 капля индикатора – метилоранжа. Затем проводится титрование методом прямого титрования. Раствор титруется до появления оранжевой окраски. Опыт повторить 3 раза.
При титровании щелочи соляной кислотой оно протекает по схеме: H+ + OH- <=> H2O
По достижении точки эквивалентности кол-во разбавленной кислоты примерно равно количеству основания, т.е. в этот момент в р-ре будет только образовавшаяся в результате соль хлорид натрия без избытка кислоты или соли. рН=7, т.к. соли сильных кислот и сильных оснований не подвергаются гидролизу.
Индикатор выбирается согласно его способности приобретать окраску в зависимости от значений рН. Окрашивание должно быть резким, интенсивным, изменяться в определенных интервалах рН. Для каждого данного титрования можно применять только те индикаторы, показатели титрования которых лежат в пределах скачка рН на кривой титрования. При титровании используется такой индикатор, который изменяет свою окраску около точки эквивалентности, т.е. интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования. Поэтому перед началом титрования вычисляют область рН раствора, в которой наблюдается скачок, а затем подбирают такой индикатор, у которого интервал перехода совпадает с этим скачком. При титровании сильных оснований сильными кислотами предпочитают метилоранж, так как он не подвержен влиянию двуокиси углерода, поглощаемой из воздуха.
18. Алкалиметрия – определение кол-ва кислот путем титрования основанием. Для определения
используется рабочий титрованный раствор гидроксида натрия. Он приготавливается так: готовят раствор
гидроксида примерно нужной нормальности, параллельно готовят раствор щавелевой кислоты (Н2С2O4 * 10H2O), который является установочным титрованным раствором. Его готовят методом растворения точной его навески в воде. Его титр определяется по формуле: T=g(масса буры)/Vр-ра . Затем с помощью щавелевой кислоты титруют раствор гидроксида натрия и определяют его концентрацию.
Ход определения. В мерную колбу добавляется исследуемый раствор и разбавляется дистиллированной водой до метки, перемешивается. Бюретка заполняется рабочим титрованным раствором до нулевой отметки. Необходимый объем исследуемого раствора переносится в колбу для титрования, сюда же добавляется 1-2 капля индикатора – метилоранжа, если определяемая кислота сильная, или фенолфталеина, если определяемая кислота слабая.. Затем проводится титрование методом прямого титрования. Раствор титруется до появления оранжевой окраски при использовании метилоранжа или до появления неисчезающего в течение 30 сек бледнорозового окрашивания раствора при использовании фенофталеина. Опыт повторить 3 раза.
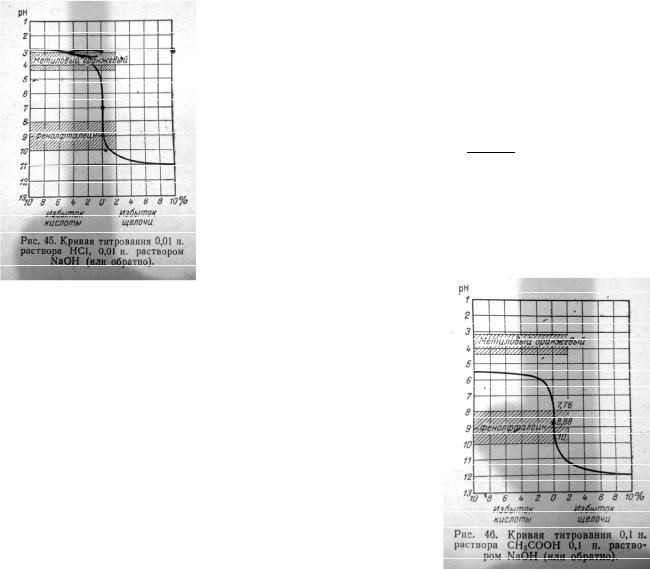
Кривая титрования соляной кислоты с помощью гидроксида натрия:
Изменениями V обычно пренебрегают. Изначально рН р-ра равно ~2. Когда к 100 мл 0,1н р-ра соляной кислоты прибавляют 100 мл 0,1н гидроксида натрия, р-р вводят в состояние эквивалентности. В этот момент р-р будет содержать только хлорид натрия без избытка щелочи/кислоты, поэтому рН=7. В этот момент следует закончить титрование. В промежутке от начала титрования до pH=4 расходуется 99,9 мл гидроксида, при этом рН изменяется только на 2. При переходе же от точки с pH=4 до pH=10 расходуется всего 0,2 мл гидроксида, но изменение рН гораздо значительней. Это подтверждается уравнением:
кисл.ф
= − Сщел.ф
Резкому изменению рН от последних 1-2 капель отвечает резко изменение отношения Скисл./Сщел , а следовательно, и резкая перемена окраски индикатора.
Кривая титрования уксусной кислоты с помощью гидроксида натрия:
Точка эквивалентности не совпадает с рН=7. Скачок титрования меньше чем в первом случае и приходится на диапазон от pН=7,76 до рН=10. Эта разность в величине скачков объясняется так: СН3СООН как слабая кислота создает меньшую концентрацию Н+ чем соляная кислота, поэтому скачок начинается при рН=7,76 в отличие от рН=4 в случае соляной кислоты. Заканчивается на рН=10 т.к. титруют одинаково растором гидроксида натрия.
19. "Определение соляной и уксусной кислот при их совместном
присутствии в растворе"
Предлагаемый для анализа раствор является моделью желудочного сока. Желудочный сок также является смесью сильной соляной и слабых органических кислот. Соляная и уксусная кислоты могут быть определены раздельно в одном растворе титрованием его щелочью. При титровании будут протекать следующие реакции:
HCl + NaOH = NaCl + Н2O
СН3СООН + NaOH = СН3СООNа + H2O
Пока в растворе будет присутствовать соляная кислота, рН раствора будет намного меньше 7 (до 3 Точке эквивалентности первой реакции будет соответствовать значение рН около 3. После нейтрализации соляной кислоты произойдет некоторое скачкообразное увеличение рН, а при дальнейшей нейтрализации щелочью будет наблюдаться второй скачок титрования, отвечающий нейтрализации уксусной кислоты. Точке эквивалентности второй реакции будет соответствовать значение рН около 9. Для определения первой и второй точки эквивалентности можно использовать два индикатора, один из которых должен изменять окраску в сильнокислой среде (тимоловый синий, метиловый желтый), а второй- в щелочной (фенолфталеин). Очень удобен в этом случае для использования в качестве индикатора тимоловый синий, имеющий две области
перехода. В сильнокислой среде (рН 1,2) окраска его красная; при повышении рН до 2,8 она переходит в желтую и остается желтой до рН 8. При дальнейшем увеличении рН окраска раствора переходит в голубую. Установочный раствор: раствор щавельной кислоты CH2C2O4*2H2O
Рабочий раствор: раствор NaOH
Индикаторы: метилоранж и фенолфталеин.
20. Сущность метода пермаганатометрии , рабочие и установочные растворы их приготовление.
Условия перманганатометрического титрования. Определение молярной концентрации эквивалента и титра калий перманганата по щавельной кислоте.
Метод перманганатометрии применяется для пероксидазы, каталазы ( плазма крови) для определения общего кол-ва железа в крови.
Рабочий раствор перманганатакалия , который приготовят за несколько дней до начала титрования, точную навеску перманганатакалия растворяют теплой водой , при этом получают побочные реакции , приводящие к образованию MnO2, получившейся раствор хранят в темном стекле, темном месте, чтобы избежать попадания световых лучей , которые активизируют процесс реакции.
2KMnO4 ------- K2MnO4 + MnO2 + O2
Установочным раствором является раствор щавельной кислоты с точно известной концентрацией. Установочным раствором называют раствор по которому определяют концентрацию и титр рабочего раствора. Установочный раствор имеет стандартную конц. Раствор K2MnO4 наливают в колбу для титрования V=10 мл. добавляют из бюретки, титруют раствором H2C2O4 с известной конц. Титруют до появления бледно розовой окраски не исчезающей в течении 30 с.
При проведении перманганатометрического титрования необходимо соблюдать, по крайней мере, следующие
основные условия.
Влияние рН среды. Перманганатометрическое титрование проводят в сильно кислой среде при концентрации ионов водорода [НзО+] =1-2 моль/л. Кислая среда создается введением серной кислоты. Азотную кислоту применять нельзя, так как она сама является сильным окислителем и может окислять определяемое вещество. Хлороводородную кислоту в перманганатометрии также не используют, так как хлорид-ионы окисляются перманганат-ионами до хлора по схеме:
Cl - +2МnО4 - +16Н+ =5С12 +2Мn2+ +8Н2О
При этом часть титранта расходуется на окисление хлорид-ионов, что вызывает перерасход титранта и увеличивает ошибку анализа. В обычных условиях эта реакция идет медленно, однако ускоряется в присутствии соединений железа.
Всернокислой среде указанные побочные процессы отсутствуют, поэтому перманганатометрическое титрование ведут в сернокислой среде.Влияние температуры. Чаще всего перманганатометрическое определение проводят при комнатной температуре. Исключением является реакция перманганат-иона с щавелевой кислотой и оксалатами, которую проводят при нагревании титруемого раствора.
Фиксация конечной точки титрования. При перманганатометрическом титровании обычно не применяют посторонний индикатор, так как сам титрант - раствор перманганата калия - обладает интенсивной малиновофиолетовой окраской. Прибавление одной избыточной капли титранта в ТЭ приводит к окрашиванию титруемого раствора в розовый цвет. Так, чтобы придать отчетливую окраску 100 мл воды достаточно прибавить всего 0,2 мл раствора перманганата калия с молярной концентрацией эквивалента 0,1 моль/л. Окраска раствора в КТТ неустойчива, раствор постепенно обесцвечивается. Это происходит вследствие того, что избыточные перманганат-ионы, придающие раствору розовую окраску, взаимодействуют с образовавшимися катионами марганца (2) Мn2+:
МnО4-+ЗМn2++Н20=5МnО2?+4Н+
Хотя повышенная кислотность раствора способствует смещению равновесия влево, однако константа равновесия этой реакции велика и составляет ~1047. Поэтому реакция протекает даже в кислой среде. Правда, скорость данной реакции в обычных условиях мала, поэтому окраска раствора в КТТ ослабляется медленно, в течение одной-двух минут. Тем не менее, указанное обстоятельство необходимо иметь в виду во избежание перетитровывания раствора.
Внекоторых (редких) случаях перманганатометрическое титрование ведут очень разбавленным раствором титранта. В такой ситуации для более четкого фиксирования КТТ в титруемый раствор вводят редоксиндикатор, например ферроин или N-фенилантраниловую кислоту.
Ход титрования. Обычно в перманганатометрии к раствору определяемого вещества медленно, по каплям прибавляют раствор титранта, для того чтобы в растворе не было локального избытка окислителя - перманганат-иона и не протекали бы побочные процессы.

Для титрования применяют бюретки со стеклянными кранами; использование резиновых трубок исключается, так как резина взаимодействует с перманганатом калия.
21.
22.

Перманганатометрией называется метод объемного анализа, в котором в качестве рабочего раствора
применяют перманганат калия КМп04. Перманганат калия является сильным окислителем, особенно в кислой среде.
В зависимости от среды при восстановлении КМп04 получаются различные конечные продукты:
1)В кислой среде ионы Мп04-восстанавливаются до бесцветных ионов Мп2+
МnОH + 5е" + 8Н+ > Мn2+ + 4Н20.
2)В слабокислой, нейтральной и щелочной среде ионы Мп04~ восстанавливаются до соединений марганца (IV),
образуя темно-коричневый осадок диоксида марганца Мп02:
МnОH+ 2Н20 + Зе" >- Мn02| + 40Н_.
Образование темного осадка затрудняет определение конца реакции, поэтому титрование проводят в кислой среде, прибавляя большой избыток кислоты. ( Для подкисления применяют только серную кислоту.) Ионы Мп04_ придают раствору КМп04 малиновую окраску, в процессе титрования раствор обесцвечивается. В момент, когда в растворе не останется восстановителя, от прибавления одной капли КМп04 титруемая смесь приобретает розовую окраску. Таким образом, точно эквивалентности фиксируется при помощи самого же рабочего раствора. Индикатор в этом методе не применяется.
Исходным веществом для установки титра КМп04 служит щавелевая кислота Н2С204-2Н20. При титровании протекает следующая реакция:
2KMn04 + 3H2S04 + 5Н2С204 = 2MnS04 + K2S04 + 10СО3+8Н20.
С20|- — 2е~ -- v 2С02 5
Мп07 + 8Н+ + 5е" —-> Мп2+ 4Н20 2
Перманганатометрию чаще всего применяют для анализа солей железа (II), кальция (в виде оксалата),
щавелевой кислоты, меди (I), пероксида водорода.
(Метод перманганатометрии можно применить и для определения окислителей. В этом случае применяют обратное титрование, прибавляя к определяемому веществу заведомо избыточное, точно отмеренное количество раствора восстановителя. Затем избыток восстановителя титруют раствором перманганата калия.) Устр. р-р: раствор щавелевой кислоты (С1/z H2C2O4*2H2O)
Рабочий р-р: раствор калий перманганата ( KMnO4)
! Индикатор: безиндикаторное титрование Метод титрования: прямое титрование
ФОРМУЛЫ РАСЧЕТА:
C(1/z KMnO4)-v(бюр.ср) С(1/z H2O2)= -----------------------------------
V( H2O2)
C(1/z H2O2) * M(1/z H2O2 ) T (H2O2) = -------------------------------------
1000
M (H2O2)= T (H2O2) * v(мер.колбы)
23вопрос(растворы): Определение массы Са2+ методом перманганатометрии. Химизм , формулы расчета, метод титрования.

23вопрос(растворы) продолжение:

24вопрос(растворы): Реакции окисления-восстановления с участием перманганата калия в кислой, щелочной и нейтральных средах. Вычисление молярной массы эквивалента КМnО4.

25
