
u_zadachi_1
.pdf
в результаті додавання 10мл 0,2Н розчину NаОН. (відповідь: ∆рН = 0,14) 7) Як зміниться рН аміачного буферу, що складається із 100мл 0,15Н
розчину NН4ОН (КД = 1,8 · 10 -5) та 80мл 0,1Н розчину NH4Cl в результаті додавання до нього 15мл 0,1Н розчину HCl?
(відповідь: ∆рН = 0,15)
8)Як зміниться рН аміачного буферу, що складається із 70мл 0,1Н NН4NO3 та 45мл 0,1Н розчину NН4ОН (КД = 1,8 · 10 -5) в результаті додавання до
нього 20мл 0,1Н розчину NаOH? (відповідь: ∆рН = 0,31). 9) Обчислити буферну ємкість ацетатного буферу, який складається із 90мл
0,15Н розчину СН3СООН (КД = 1,8 · 10 -5) та 70мл 0,12Н розчину СН3COONa, якщо на титрування 5мл його витрачається 3,5 мл 0,1Н
розчину NаOH. |
(відповідь: 0,018) |
10) Обчислити буферну ємкість аміачного буферу, який складається із |
|
150мл 0,1Н розчину NН4ОН (КД = 1,8 · 10 -5) та 120мл 0,1Н розчину NН4Cl, якщо на титрування 10мл його витрачається 8,2 мл 0,1Н розчину HCl. (відповідь: 0,16)
11) Обчислити буферну ємкість сироватки крові за кислотою, якщо на титрування 20мл її пішло 3,6мл 0,1Н розчину HCl; рН сироватки при цьому змінився до 7,0. (відповідь: 0,05моль екв./од. рН)
Задачі підвищеної складності
1. Яка із двох буферних систем із рН = рК + 1 або із рН = рК – 1 стійкіша до дії кислоти, а яка до дії лугу? (відповідь: перша – до дії кислоти;
друга – до дії лугу)
2.Обчислити буферну ємкість сироватки крові за кислотою та за лугом, якщо на титрування 5мл її витрачається 7,5мл 0,1Н розчину HCl та 1,1мл 0,1Н розчинуNaOH. Яка буферна ємкість більша і чому?
КОЛІГАТИВНІ ВЛАСТИВОСТІ РОЗЧИНІВ. ОСМОС. КРІОМЕТРІЯ.
Колігативними називають властивості розчинів, що обумовлені тепловим рухом та кількістю кінетичних частинок системи.
Осмос це самовільна одностороння дифузія молекул розчинника через напівпроникну мембрану у бік розчину із більшою концентрацією. Напівпроникною називається мембрана, яка пропускає молекули тільки розчинника. Приклади : природні – тваринні та рослинні мембрани клітин, стінки кишечника, стінки судин; штучні – колодій, целофан, желатин, пергамент, стінки глиняної посудини, які заповнені осадовою мембраною.
41

Осмотичний тиск це надмірний гідростатичний тиск, який зупиняє осмос. Осмотична концентрація це концентрація всіх кінетичних частинок розчиненої речовини в розчині.
Закон Вант – Гоффа – осмотичний тиск розбавленого розчину неелектроліту дорівнює тому газовому тиску, який чинила би розчинена речовина, знаходячись в газоподібному стані та займаючи об'єм розчину за тієї ж температури.
Рівняння осмотичного тиску для неэлектролітів:
де С - молярна концентрація в моль/л;
R – універсальна газова стала 0,082 л · атм/град · моль; Т – температура за Кельвіном.
Для неелектролітів осмотична та молярна концентрації збігаються. Рівняння осмотичного тиску для електролітів:
 ,
,
де i – ізотонічний коефіцієнт Вант-Гоффа.
Для електролітів осмотична концентрація в i разів більша за молярну :
СОСМ. ЕЛ. = i · С.
Ізотонічний коефіцієнт Вант-Гоффа – i - показує, в скільки разів осмотичний тиск електроліту, осмотична концентрація електроліту більша, за осмотичний тиск та осмотичну концентрацію неелектроліту, за однакової молярної концентрації.
і = |
РОСМ .ЕЛ |
= |
СОСМ .ЕЛ . |
|
РЛОСМ .НЕЕЛ. |
СОСМ .НЕЕЛ. |
|||
|
|
Ізотонічний коефіцієнт Вант-Гоффа зв`язаний зі ступенем дисоціації α рівнянням:
де ν - число іонів, на яке дисоціює електроліт.
Осмотичний тиск крові = 7,7атм.
Онкотичний тиск крові це частина осмотичного тиску, яка обумовлена ВМС і становить 0,04атм.
Осмотичний тиск 1М розчину неелектроліту = 22,4атм.
Приклади розв`язання задач
1) Обчислити осмотичний тиск 0,1М розчину сечовини.
СХ(СЕЧОВИНИ)= 0,1моль/л; |
1) Сечовина це неелектроліт, тому РОСМ. |
|
|
|
знаходимо за формулою: |
|
|
РОСМ. НЕЕЛ. = СRT = 0,1· 0,082· 273 = 2,24атм. |
|
|
|
РОСМ. = ? |
Відповідь: 2,24атм. |
|
|
|
42 |
|
|
|
2) Обчислити осмотичний тиск 0,2М розчину калій хлориду. |
||
|
СХ(КСl)= 0,2моль/л; |
1) Оскільки КСl це електроліт, то РОСМ |
|
|
обчислюємо за формулою: |
|
РОСМ. = ? |
РОСМ. ЕЛ. = i СRT. |
2) Для знаходження i використовуємо формулу: i = 1 + α(ν– 1)
де α = 1; оскільки КСl це сильний електроліт і дисоціює на два іони, тому ν = 2. Звідси: i = 1 + 1(2 – 1) = 2;
3) Обчислюємо осмотичний тиск:
РОСМ. ЕЛ. = 2· 0,2· 0,082 · 273 = 8,95атм.
Відповідь: 8,95атм.
3) Чому 5%-ний розчин глюкози можна вводити інтравенозно? Підтвердити відповідними розрахунками.
ω = 5%; 1) Інтравенозно можна вводити ті розчини, які мають осмотичний тиск однаковий із осмотчним тиском крові. Тобто треба розрахувати осмотичний тиск 5%-го
РОСМ. = ? розчину глюкози.
Переводимо масову частку в молярну концентрацію
СХ |
= |
ϖ % • ρ •10 |
= |
5•1,1•10 |
= 0,3моль/л; |
|
|
||||
|
|
М Х |
180 |
|
|
2) Знаходимо РОСМ. глюкози як неелектроліту:
РОСМ. НЕЕЛ. = СRT = 0,3• 0,082· (273 +37) = 7,62 атм.
Осмотичний тиск 5%-го розчину глюкози близький до осмотичного тиску крові, тому його можна вводити інтравенозно.
Відповідь: 7,62 атм.
4) Обчислити осмотичний тиск 10%-го розчину натрій хлориду (ρ = 1,12).
ω = 10%; 1) Переводимо масову частку в молярну концентрацію:
NaCl; |
СХ |
= |
ϖ % • ρ •10 |
= |
10 •1,12 •10 |
= 1,91моль/ л. |
|
|
|||||
|
|
|
М Х |
58,5 |
|
|
РОСМ. = ? 2) Так як КСl це електроліт, то РОСМ обчислюємо за формулою: РОСМ. ЕЛ. = i СRT.
2) Для знаходження i використовуваний формулу: i = 1 + α(ν– 1)
де α = 1, оскільки NaСl це сильний електроліт і диссоціює на два іони, тобто ν = 2. Звідси: i = 1 + 1(2 – 1) = 2;
3) Обчислюємо осмотичний тиск:
РОСМ. ЕЛ. = 2· 1,91· 0,082· 273 = 49,04атм.
Відповідь: 49,04атм.
43

5) Обчислити молярну концентрацію глюкози, який ізотонічний із кров'ю за 370С.
|
t = 370С; |
1) Оскільки розчин глюкози ізотонічний із кров'ю, то його |
||||||||||||||||||||
|
|
|
|
|
РОСМ. дорівнює РОСМ. крові і становить 7,7атм. |
|
||||||||||||||||
|
|
|
|
2) Глюкоза це неелектроліт, тому |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
РОСМ. =? |
|
|
|
РОСМ. НЕЕЛ. = СRT |
|
|
|
||||||||||||||
|
|
|
|
|
|
Звідси C = |
P |
= |
7,7 |
= 0,303моль/л. |
|
|||||||||||
|
|
|
|
|
|
|
|
0,082 • (273 + 37) |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Відповідь: 0,303моль/л. |
|
|
6) |
Чи ізотонічні 1%-ні розчини сечовини та натрій хлориду? |
|
|||||||||||||||||||
|
|
ω((NH2)2СО) = 1%; |
|
1) Оскільки ізотонічні розчини мають |
|
|||||||||||||||||
|
|
ω(NaCl) = 1%; |
|
|
|
|
однаковий осмотичний тиск, то |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
необхідно обчислити осмотичний тиск |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
кожного розчину і порівняти. |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
РОСМ.( (NH2)2СО) = ? |
|
2) Сечовина це неелектроліт, тому РОСМ. |
|
||||||||||||||||||
|
РОСМ. (NaCl) = ? |
|
|
|
|
знаходимо за формулою: РОСМ. НЕЕЛ. = СRT |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
заздалегідь перевівши ω в СХ: |
|
||||||||||
|
|
СХ |
= |
ϖ % • ρ •10 |
|
|
= ; |
1•1,03•10 |
|
= 0,17моль/ л.; |
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
М Х |
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
РОСМ. .( (NH2)2СО)= СRT = 0,17· 0,082· 273 = 3,84атм. |
||||||||||||||||||
|
3) |
Знаходимо РОСМ. (NaCl), враховуючи, що це електроліт: РОСМ. ЕЛ. = i СRT: |
||||||||||||||||||||
|
|
СХ = |
ϖ % • ρ •10 |
|
|
= |
1•1,03•10 |
= 0,17моль/ л.; |
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
М Х |
|
|
|
|
|
58?5 |
|
|
|
|
|
|||||
|
|
|
|
|
i = 1 + α(ν– 1) = 1 + 1(2 – 1)= 2 |
|
|
|
||||||||||||||
|
|
|
|
РОСМ. (NaCl) |
|
= 2· 0,17· 0,082· 273 = 7,6 атм. |
|
|||||||||||||||
|
Оскільки осмотичний тиск різний, то ці розчини не ізотонічні |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Відповідь: розчини не |
ізотонічні. |
||
|
|
|
|
|
|
Задачі для самостійного розв`язання |
|
|||||||||||||||
|
1) |
Обчислити осмотичний тиск 0,2М розчину глюкози. |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(відповідь: |
4,47атм) |
|
2) |
Обчислити осмотичний тиск 0,3М розчину КCl. |
(відповідь: 13,43атм) |
|||||||||||||||||||
|
3) |
Обчислити осмотичний тиск 10%-го розчину СaСl2 (ρ=1,07). |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(відповідь: 64,73атм) |
|
|
4) |
Чи ізотонічні 2%-ні розчини ацетату(оцтової кислоти) та глюкози? |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(відповідь: не ізотонічні) |
|
|
5) |
Обчислити молярну концентрацію гемоглобіну, якщо 1%-ний розчин |
||||||||||||||||||||
|
|
його має осмотичний тиск 0,004атм. |
|
(відповідь: 62500г/моль) |
||||||||||||||||||
|
6) |
Обчислити осмотичну концентрацію крові. . |
|
(відповідь: 0,3моль/л.) |
||||||||||||||||||
|
7) |
Обчислити молярну концентрацію розчину сахарози, який є ізотонічний |
||||||||||||||||||||
|
|
крові. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(відповідь: |
0,3моль/л) |
|
|
8) |
Обчислити осмотичний тиск крові жаби, якщо осмотична концентрація її |
||||||||||||||||||||
|
|
крові за 70С становить 220ммоль/л. |
|
(відповідь: 5,05атм) |
||||||||||||||||||
44
9)Чим пояснюється послаблююча дія 25%-го розчину MgSO4? Підтвердити
відповідними розрахунками. (ρ=1,27; α=0,96). |
(відповідь: 131,5атм) |
|
10) |
4,5г NaCl розчинили у 0,5л води. Обчислити осмотичну концентрацію |
|
|
цього розчину. (ρ=1,07). |
(відповідь: 0,32моль/л) |
11) |
Чому 35%-ний розчин калій ацетату використовують як осмотичний |
|
|
діуретик? Підтвердити відповідними розрахунками (ρ=1,2; α=0,92). |
|
|
|
(відповідь: 208,89атм). |
12) |
Для зняття набряків під час алергії у ввену вводять 10%=ний розчин |
|
|
CaCl2. Розрахувати його осмотичний тиск. (ρ=1,14; α=0,96). |
|
|
|
(відповідь 49,78атм) |
13) |
Під час отруєння меркурієм або плюмбумом вводять в кров 10%-ний |
|
|
розчин MgSO4 (ρ=1,15; α=0,94). Розрахувати осмотичний тиск. |
|
|
|
(відповідь: 46,84атм) |
Задачі підвищеної складності
1.Осмотичний тиск розчину гемоглобіну у воді, який містить 124г/л гемоглобіну за t = 170, становить 0,0435. Розрахувати молярну масу
гемоглобіну. |
(відповідь: 68000) |
2.Обчислити масову частку NaCl в розчині, який є ізотонічний із кров`ю жаби, якщо осмотична концентрація її крові становить 220ммоль/л.
(відповідь: 0,64%)
3.Скільки грамів гліцерину треба розчинити у 500мл води, щоб осмотичний тиск цього розчину за 180С становив 3атм?
|
(відповідь: 5,75г) |
4. Скільки грамів глюкози необхідно взяти для приготування 1л розчину |
|
ізотонічного із кров'ю. |
(відповідь: 54г) |
5. Обчислити осмотичний тиск розчину гемоглобіну за 3000К, якщо в 1л |
|
3розчину міститься 124г гемоглобіну. (М(ГЕМОГЛОБІНУ) = 68000г/моль; |
|
R = 8,31•103 л•Па/ моль• К) |
(відповідь 4,54•103 Па) |
6.Обчислити осмотичний тиск розчину сахарози, в 1л якого міститься 91г її за 370С (М(САХАРОЗИ) =342г/моль; R = 8,31•103 л•Па/ моль• К)
(відповідь 685,5 к Па) 7. Яка маса етанолу міститься в 10л розчину, якщо осмотичний тиск цього
розчину становить 340кПа за 00С (М(СПИРТУ) =46г/моль; |
|
R = 8,31•103 л•Па/ моль• К). |
(відповідь: 69г) |
КРІОМЕТРІЯ. ЕБУЛІОМЕТРІЯ.
Тиск насиченої пари розчинника над розчином нижчий, за тиск над розчинником, оскільки під час розчинення речовини знижується концентрація розчинника в одиниці об'єму розчину, і тим самим зменшується
45

число молекул води, яке покидає поверхню розчину. Чим більше СХ, тим більше зниження тиску ∆Р.
I закон Рауля: відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини в розчині:
P0 |
− P |
n |
де Р0 |
‒ тиск пари над чистим розчинником; |
|
|
|
= |
|
||
|
|
|
|||
|
P0 |
n + n0 |
|
|
|
Р‒ тиск пари над розчином;
Р0 – Р ‒ зниження тиску пари;
n‒ число моль речовини;
n0 ‒ число моль розчинника.
Рідина замерзає за температури, за якої тиск пара її в твердому стані дорівнює тиску пари цієї речовини в рідкому стані. Наприклад: за 00С Р пари льоду = Р пари води. Якщо розчинити речовину, то Р пари розчину
буде нижчий. за Р пари води і Р пари льоду, тобто замерзлого розчину. Тому треба знизити температуру розчину, щоб Р пари розчину дорівнювало Р пари льоду.
II закон Рауля: зниження температури (депресія) замерзання розчину прямо пропорційно його молярній(моляльній) концентрації:
де ЕКР. – кріоскопічна стала, яка показує депресію 1М водного розчину неелектроліту.
ЕКР.(Н2О) = 1,86.
∆t молярного розчину неелектроліту = 1,86.
Для електролітів рівняння має вигляд:
де коефіцієнт Вант-Гоффа i показує, в скільки разів депресія розчину електроліту більша за депресію розчину неелектроліту за однакової молярноі (моляльноі) концентрації:
i = ∆tЕЛ.
∆tНЕЕЛ.
Рідина закипає за температури, за якої тиск насиченої її пари дорівнює атмосферному тиску. Під час розчинення речовини у воді тиск її пари знижується, і розчин закипить тільки тоді, коли тиск дорівнюватиме атмосферному. Для цього треба підвищити температуру. Для водних розчинів температура повинна бути вище 1000С.
Підвищення температури кипіння обчислюють за формулою:
ЕЕБ.(Н2О) = 0,56.
46

Приклади вирішення задач
1.Обчислити депресію 3,6%-го розчину глюкози (ρ = 1,014).
ω= 3,6%; 1) Оскільки глюкоза неелектроліт, то для знаходження ρ = 1,014; депресії використовуємо формулу:
|
|
|
|
∆tНЕЕЛ. = ЕКР.· С ; |
|
|
||
|
|
|
|
|
||||
|
∆t = ? |
|
2) Масову частку переводимо в СХ: |
|||||
|
|
|
|
CX = |
ϖ % • ρ •10 |
. = |
3,6 •1,014 •10 |
= 0,2моль / л.; |
|
|
|
|
180 |
||||
|
|
|
|
|
M X |
|
||
|
3) Знаходимо депресію: ∆t = 1,86 · 0,2 = 0,38. |
|||||||
|
|
|
|
|
|
|
Відповідь: 0,38. |
|
2. Обчислити температуру замерзання 2М розчину JaCl. |
||||||||
|
СХ = 2моль/л; |
|
1) Для знаходження температури замерзання |
|||||
|
|
|||||||
|
NaCl; |
|
необхідно знати ∆t. |
|
|
|||
|
|
|
|
Оскільки ∆t = 00 - tЗАМ., де 00 це температура |
||||
|
|
|
|
замерзання води. Звідси: tЗАМ. = 00 - ∆t; |
||||
|
|
|
|
|||||
|
tЗАМ. = ? |
|
2) Обчислюємо депресію розчину NaCl: |
|||||
|
|
|
|
∆tЭЛ.. = i · ЕКР.· С ; |
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
i = 1 + α(ν – 1)= 1 + 1(2 – 1)= 2; |
||||
∆tЭЛ.. = 2· 1,86.· 2 = 7,44.
3) Обчислюємо tЗАМ. = 00 - ∆t = 00 – 7,44 = – 7,440 .
Відповідь: – 7,440.
3. За якої температури замерзає 3%-ний розчин етанолу у воді?
ω = 3,%; |
|
|
1) Для знаходження температури замерзання |
|||||
|
||||||||
C2Н5ОН; |
|
|
необхідно знати ∆t, оскільки ∆t = 00 ‒ tЗАМ., |
|||||
|
|
|
звідси: tЗАМ. = 00 ‒ ∆t; |
|||||
|
|
|
||||||
tЗАМ. = ? |
|
2) Масову частку переводимо в СХ: |
||||||
|
|
|
CX = |
ϖ % • ρ •10 |
. |
= |
3•1,0 •10 |
= 0,65моль/ л. |
|
|
|
|
|
||||
|
|
|
|
M X |
46 |
|
||
3) Обчислюємо депресію розчину C2Н5ОН та tЗАМ : |
||||||||
∆tНЕЭЛ.. = |
ЕКР.· СХ .. = 1,86.· 0,65 = 1,2;. |
|||||||
tЗАМ. = 00 ‒ tЗАМ = 00 – 1,2 = |
– 1,2. |
|||||||
Відповідь: – 1,2.
4. Обчислити депресію крові за 370С, якщо осмотичний тиск крові 7,65атм.
РОСМ. = 7,65атм; |
1) В задачі дається два параметри крові ‒ |
|||||
t = 370С; |
|
депресія та осмотичний тиск, тому |
||||
|
|
запишемо дві формули: |
||||
∆t = ? |
||||||
|
|
∆t = ЕКР.· С та РОСМ. = СRT. |
||||
|
|
В цих формулах є загальний параметр С; |
||||
|
|
виводимо його з кожного рівняння: |
||||
|
|
C = |
∆t |
та С = |
РОСМ . |
, |
|
|
|
||||
|
|
|
ЕКР. |
|
RT |
|
47
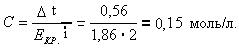
звідси |
∆t |
= |
РОСМ |
; звідси |
∆t = |
РОСМ •ЕКР |
||
EКР |
RT |
RT |
||||||
|
|
|
|
|||||
|
|
∆t = |
|
7,65•1,86 |
= 0,56. |
|||
|
|
|
|
|||||
|
|
0,082 • (273 + 37) |
||||||
|
|
|
|
|
|
|||
Відповідь: 0,56.
5.Обчислити молярну концентрацію розчину JaCl, який замерзає за температури - 0,560С.
tЗАМ = - 0,560С; |
|
|
1) tЗАМ. = 00 ‒ ∆t ; |
|
|||
NaCl; |
|
|
2) Знаходимо ∆t розчину NaCl: |
|
|
|
∆t = 00 ‒ tЗАМ = 00 ‒ (-0,56) = 0,56. |
С(NaCl) = ? |
|
|
|
|
|
|
3) Враховуючи, що NaCl електроліт: |
|
|
||
|
|
|
∆tЕЛ.. = i · ЕКР.· С |
|
|
|
i = 1 + α(ν– 1)= 1 + 1(2 – 1) = 2; |
|
|
|
|
Відповідь: 0,15моль/л. |
6) Обчислити осмотичний тиск сечі, якщо депресія її 1,3 – 2,0. |
||||
|
∆tЗАМ = 1,3 – 2,0; |
1) Осмоичний тиск обчислюють за формулою: |
||
|
сеча; |
РОСМ. = СRT; для цього треба знати С; |
||
|
|
|||
|
РОСМ. - ? |
2) Концентрацію сечі С можна обчислити |
||
|
|
використовуючи формулу: ∆tЗАМ =КС, |
||
|
|
|||
|
|
звідси: C = |
∆t |
, |
|
|
|
||
|
|
|
K |
|
де К – кріоскопічна стала води і становить 1,86.
Депресія дається в межах 1,3-2,0, тому знаходимо середню величину:
∆tСЕР. |
= |
1,3 + 2,0 |
= 1,65 ; |
|
|
|
|
|
|
|
|||
|
2 |
|
|
|
|
|
Знаходимо концентрацію: |
C = |
1,65 |
= 0,88 моль/л. |
|||
|
||||||
|
|
|
|
1,86 |
|
|
3) Знаходимо РОСМ.= 0,88•0.082•(273+37)=22,36атм.
|
Задачі для самостійного розв`язання |
|
1) |
За якої температури замерзає кров людини? (Зробити відповідні |
|
|
розрахунки). |
(відповідь: ‒ 0,560) |
2) |
Обчислити депресію розчину неелектроліту, якщо його осмотичний |
|
|
тиск за 00С становить 4,56атм. |
(відповідь: 0,38) |
3) |
Обчислити осмотичну концентрацію крові жаби, якщо |
|
|
температура замерзання крові її - 0,410С. |
(відповідь: 0,22моль/л) |
4) |
Чи ізотонічні два розчини, якщо депресія одного 0,31, а осмотичний |
|
|
тиск іншого за температури 370С становить 4,2атм. |
|
|
|
(відповідь: ізотонічні) |
5) |
За якої температури замерзає 3%-ний розчин етанолу у воді? |
|
48
(відповідь: ‒ 1,390) 6) Осмотичний тиск сечі за 00С становить 2,23атм. Обчислити депресію сечі.
(відповідь: 0,186)
Задачі підвищеної складності
1.Обчислити ступінь дисоціації хлороцтової кислоти СН2СlСООН в розчині, що містить в 100г води 1г кислоти. Депресія цього розчину 0,218.
(відповідь: α = 0,11)
2.Депресія розчину неелектроліту, який містить 29,5г речовини у 100г води, становить 1,6. Обчислити молярну масу цієї речовини.
(відповідь: 342) 3. Депресія розчину 0,9г сечовини у 10г води становить 2,79, Визначити молярну масу сечовини. (відповідь: 60)
4.Чи відрізняються температури замерзання 1М розчинуNaCl та 1М розчину
глюкози. (Зробити відповідні розрахунки). |
(відповідь: розчин NaCl |
замерзає за нижчої температури). |
|
3. За якої температури замерзає розчин, який містить 1г нітробензолу |
|
C6H5NO2 в 10г бензолу, якщо чистий бензол замерзає за температури |
|
5,5о.Моляльна депресія бензолу 5,1. |
(відповідь: 1,4о) |
4. |
Депресія розчину неелектроліту, що містить 29,5г речовини в 100г води, |
|
|
становить 1,6. Обчислити молярну масу речовини. |
(відповідь: 342) |
5. |
Депресія крові в нормі становить 0,56. Якщо депресія в патологічних |
|
|
випадках становитиме 0,8-1,0, то це говорить про осмотичну гіпертонію |
|
|
чи гіпотонію крові? |
(відповідь: 12,2атм) |
8, Яке значення для осмотичного тиску крові має виділення сечі, депресія якої 1,3-2,0? (Зробити відповідні розрахунки).
(відповідь: РОСМ. крові зменшиться)
49
