
otvety__tablitsa_Vlada
.pdf
Билет 4.
1. Опишите состояние интолерантности к сахарозе и лактозе..
Есть 2 наиболее встреч. ф-мы наруш. перевар-я дисахаридов в кишечнике – дефект лактазы (β-гликозидазного комплекса) и сахаразы (сахаразо-изомальтазного комплекса), которые называются как интолерантность к лактозе и сахарозе
или непереносимость лактозы и сахарозы Приобрет. недостаточ. - возникает в р-тате заболеваний стенок ЖКТ: энтериты, колиты, когда нарушается образов. ф-тов и их размещ. на щеточной каемке энтероцитов. К тому же ухудшается всасывание моносахаров. Наследств. недостат. - первич. патология лактазы - симптомы проявляются после первых кормлений. Патология сахаразы обнаруживается позднее, при введении в рацион сладкого. Недостаточн. лактазы может проявляться не только у младенцев, но часто развивается в подростковом и взрослом возрасте, что явл. физиологич. возрастным изменением. Такая недостаточность широко распространена среди монголоидов и негроидов (90% и выше). Среди россиян она проявляется (по разным
оценкам) у 8%-30% населения. Патогенез Отсутствие гидролиза
соответств. дисахаридов приводит к осмотич. эффекту и
задержке воды в просвете кишечника. Кроме этого, сахара активно потребляются
микрофлорой толстого кишечника и метаболизируют с
образованием орг. кислот (масляная, молочная) и газов. В р-тате указ. процессов симптомами лактазной или сахаразной недостаточности явл. дисбактериоз, диарея, срыгивания, метеоризм, вспучивание живота, его спазмы и боли. Из-за частого раздражения продуктами брожения эпителий кишечника нарушается и вероятно развитие атопического дерматита. Диагностика Диагноз фермент. недостаточности ставится на основании анамнеза, симптомов заболевания и анализа кала. Дифференц. диагностика нарушений переваривания и всасывания заключ. в контроле уровня глюкозы крови после раздельного приема дисахаридов и эквивалентного количества моносахаридов. Незначит. подъем концентрации глюкозы крови в первом случае указывает на нехватку ферментов, во втором – на нарушение всасывания. Основы лечения – Использ. препаратов, содержащих соотв. ф-ты, снижение в рационе содержания молока или продуктов с добавл. сахара в завис-ти от типа непереносимого углевода.
2.Аэробный гликолиз
Аэробный распад глюкозы (суммарн.): С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.
Ваэроб. гликолизе можно выделить 2 этапа. 1 подготовит.: глюкоза фосфорилируется и расщепляется на 2 молекулы фосфотриоз с использ. 2 молекул АТФ. 2. этап, сопряжѐн с синтезом АТФ.
Вр-тате фосфотриозы превращаются в пируват. Высвобожд. энергия использ. для синтеза 10 моль АТФ. Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата Глюкозо-6- фосфат, образов. в р-тате фосфорилир. глюкозы с
участием АТФ, в ходе след. р-ции превращ. в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием ф-та глюкозофосфатизомеразы. Затем ещѐ одна реакция фосфорилир. с использ-ем фосфатного остатка и энергии АТФ, катализируемая
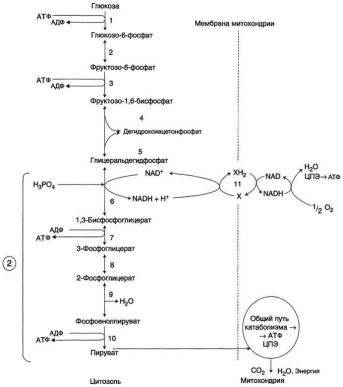
фосфофруктокиназой: фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Р-ция практич. необрат., + наиболее медленная из всех р-й гликолиза. Р-я, катализ. фосфофруктокиназой, опред. скорость всего гликолиза, => регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3- фосфат и дигидроксиацетонфосфат. Реакцию катализ.
фермент фруктозобисфосфатальдолаза, или просто альдолаза. Этот фермент катализирует как р-ю альдольного расщепл., так и альдольной
конденсации, т.е. обратимую р-цию. Превращение глицеральдегид-3-фосфата в пируват
Эта часть аэроб. гликолиза включает р-ции с синтезом АТФ. Наиболее слож. – р-я превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат - первая р-ция окисления в ходе гликолиза. Ее катализ. глицеральдегид-3-фосфатдегидрогеназа, которая является NAD-зависимым ферментом. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бисфосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаѐтся на АДФ с образованием АТФ. Фермент, катализ. это превращ. – фосфоглицераткиназа. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический фосфоэфир переходит в соед., содержащее высокоэнергетич. фосфат. В р-тате образуется замещѐнный енол - фосфоенолпируват – макроэргич. соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетоформу.
Эффект Пастера – сниж-е потребл. глюкозы и прекращ. продукции молоч. к- ты клеткой в присутствии О2. Биохим. механизм заключ. в конкуренции за пируват между пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и лактатдегидрогеназой, превращающей пируват в лактат. У пируватдегидрогеназы сродство гораздо выше и в обыч. аэроб. усл. она окисляет большую часть ПВК. Как только поступление О2 уменьш. (недостаток кровообращения, тромбоз и т.п.) происходит следующее:

внутримитохондриальные процессы дыхания не идут и НАДН в дыхательной цепи не окисляется,
моментально накапливающийся в митохондриях НАДН тормозит цикл трикарбоновых кислот,
ацетил-S-КоА не входит в ЦТК и ингибирует ПВК-дегидрогеназу.
Вэтой ситуации ПВК не остается ничего иного как превращаться в молочную. При наличии О2 ингибирование ПВК-дегидрогеназы прекращается и она, обладая большим сродством к пирувату, выигрывает конкуренцию.
Вопр. 3 Назовите способы регуляции концентрации глюкозы в крови
Нерв. регуляция выраж-тся в положит. влиянии n.vagus на секрецию инсулина и тормозящ. влиянии на этот процесс симпатич. иннервации. Также выделение адреналина в кровь подвержено симпатич. влияниям. Основными ф-рами гормональной регуляции являются глюкагон, адреналин,глюкокортикоиды, соматотропный гормон с одной стороны, и инсулин с другой. Все гормоны, кроме инсулина, влияя на печень,
увеличивают гликемию. Инсулин является единств. гормоном орг-ма, д-вие к-го нацелено на снижение уровня глюкозы крови. При его влиянии глюкозу усиленно поглощают мышцы и жировая ткань. Уменьш. конц. глюкозы в крови инсулином достигается след. путями: переход глюкозы в клетки – активация белков-транспортеров ГлюТ 4 на цитоплазматической мембране, вовлечение глюкозы в гликолиз – повышение синтеза глюкокиназы – фермента, получившего название "ловушка для глюкозы", стимуляция синтеза других ключевых ф-тов гликолиза - фосфофруктокиназы, пируваткиназы, увеличение синтеза гликогена –
активация гликогенсинтазы и стимуляция ее синтеза, что облегчает превращение излишков глюкозы в гликоген, активация пентозофосфатного пути – индукция синтеза глюкозо-6-фосфат-дегидрогеназыи 6-фосфоглюконатдегидрогеназы, усиление липогенеза – вовлечение глюкозы в синтез триацилглицеролов или фосфолипидов. Многие ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело,
хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты. Глюкагон повышает содержание глюкозы крови: увеличивая мобилизацию гликогена через активацию гликогенфосфорилазы, стимулируя глюконеогенез – повышение работы ферментов пируваткарбоксилазы,фосфоенолпируват-карбоксикиназы, фруктозо-1,6- дифосфатазы. Адреналин вызывает гипергликемию: активируя мобилизацию гликогена – стимуляция гликогенфосфорилазы, Глюкокортикоиды повышают глюкозу крови за счет подавления перехода глюкозы в клетку, стимулируя глюконеогенез – увеличивают синтез ферментов пируваткарбоксилазы,фосфоенолпируват-карбоксикиназы, фруктозо- 1,6-дифосфатазы.
5 билет.
1) Поясните роль различных органов на примере печени и скелетных мышц...
Одним из главных и основных моносахаридов, обеспечивающих энергией наш организм является глюкоза. Для того чтобы она всегда была в доступе, глюкоза депонируется в виде гликогена (разветвленного гомополимера глюкозы) – основного резервного полисахарида, который депонируется главным образом в печени и скелетных мышцах. После приема богатой углеводами пищи запас гликогена в печени может составлять примерно 5% от ее массы. В мышцах запасается около 1% гликогена, однако масса мышечной ткани значительно больше и поэтому общее количество гликогена в мышцах в 2 раза больше, чем в печени. Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы - источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки.
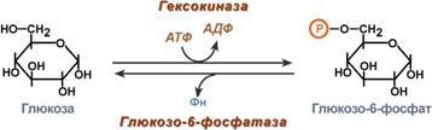
Часть глюкозы в печени депонируется в виде гликогена, а другая часть через общий кровоток доставляется и используется разными тканями и органами. В дальнейших превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов - обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации. Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе - фермент глюкокиназа.
Гексокиназа отличается от глюкокиназы высоким сродством к глюкозе (Кm <0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость еѐ внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфата. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Превращение глюкозо-6-фосфата в глюкозу возможно в печени, почках и клетках эпителия кишечника. В клетках этих органов имеется фермент глюкозо-6-фосфатаза, катализирующая отщепление фосфатной группы гидролитическим путѐм:

Образовавшаяся свободная глюкоза способна диффундировать из этих органов в кровь. В других органах и тканях глюкозо-6-фосфатазы нет, и поэтому дефосфорилирование глюкозо-6-фосфата невозможно. Пример подобного необратимого проникновения глюкозы в клетку - мышцы, где глюкозо-6-фосфат может использоваться только в метаболизме этой клетки.
2)Напишите реакции функционирования глицеролфосфатной и малатаспартатной челночных систем..
Цитозольный НАДH (полученный в 6 реакции гликолиза) не может передавать водород на дыхательную цепь, потому что митохондриальная мембрана для него непроницаема. Перенос водорода через мембрану происходит с помощью специальных систем, называемых "челночными".
Глицеролфосфатная челночная система работает в клетках белых мышц, печени, мозге.
Водород от НАДH в цитозоле передаѐтся на диоксиацетонфосфат глицерол-3- фосфатдегидрогеназой (НАД-зависимый фермент). Образовавшийся глицерол-3-фосфат окисляется ферментом внутренней мембраны митохондрий - глицерол-3- фосфатдегидрогеназой (ФАД-зависимый фермент). Затем протоны и электроны с ФАДH2 переходят на убихинон и далее по дыхательной цепи.
Малат-аспартатная челночная система в которой участвуют малат, цитозольная и митоховдриальная малат-дегидрогеназы, является более универсальной, и работает в сердечной мышце, печени, почках.
В цитоплазме НАДH восстанавливает оксалоацетат в малат, который при участии переносчика проходит в митохондрии, где окисляется в оксалоацетат НАД-зависимой малатдегидрогеназой. Восстановленный НАДН отдаѐт водород в митохондриальную ЦПЭ. Образованный из малата оксалоацетат выйти из митохондрий в цитозоль не может: мембрана митохондрий для него непроницаема. Поэтому оксалоацетат превращается в аспартат, который транспортируется в цитозоль, где снова превращается в оксалоацетат.
Обе челночные системы существенно отличаются по количеству синтезированного АТФ. В первой системе – 2АТФ (водород вводится в ЦПЭ на уровне убихинона). Вторая система энергетически более эффективна – 3АТФ (водород поступает в ЦПЭ с митохондриальным НАД+).
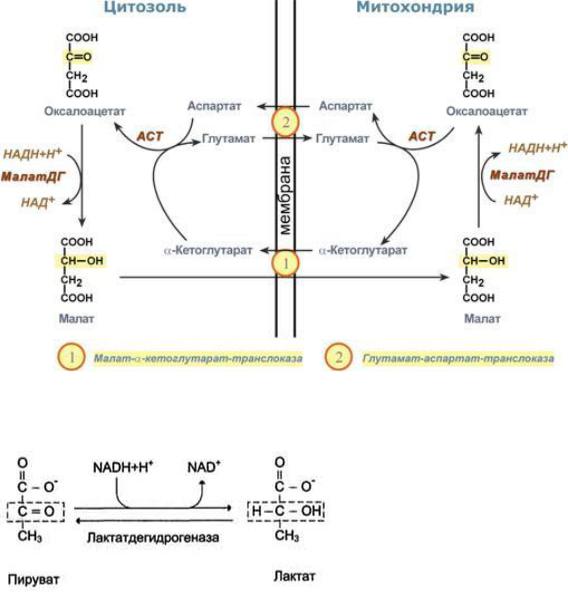
NADH в цитозоле может помимо этого вступать в 11 реакцию анаэробного гликолиза – превращение пирувата в лактат.
Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя еѐ аэробным путѐм. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). В сердечной мышце аэробный гликолиз также играет основную роль, т. к. для постоянной работы сердца ему необходим постоянный доступ энергии, а выход АТФ при аэробном гликолизе равен 38 молекулам, в то время как при анаэробном гликолизе образуется 2 молекулы АТФ и 2 молекулы лактата. В скелетных мышцах аэробный гликолиз происходит при длительной нагрузке, а в процессе быстрых и кратковременных нагрузок основную роль играет процесс анаэробного гликолиза.
3) Назовите и сравните 1 и 2 типы сахарного диабета...
Диабет 1 типа характеризуется потерей бета-клеток островков Лангерганса, производящих инсулин в поджелудочной железе, что приводит к инсулиновой
недостаточности. Этот тип может быть классифицирован как иммунный или идиопатический. Большинство заболеваний сахарным диабетом 1 типа имеет иммунную природу, в которой потери бета-клеток – это Т-клеточное аутоиммунное нападение. Этот тип в подавляющем большинстве случаев характерен для детей и лиц моложе 40 лет. Единственным методом лечения являются пожизненные инъекции инсулина, нормализующие обмен веществ пациента (т.к. инсулин регулирует синтез гликогена, при его недостаточности нарушается обмен глюкозы, она не депонируется в нормальных количествах, и ее количество в крови становится избыточным). Без лечения диабет 1-го типа быстро прогрессирует и приводит к возникновению тяжѐлых осложнений, таких как диабетическая кардиомиопатия, инсульт, почечная недостаточность, диабетическая ретинопатия, диабетическая язва стопы, кетоацидоз и диабетическая кома, которые приводят к инвалидности или заканчиваются смертью пациента.
Сахарный диабет 2-го типа (инсулиннезависимый диабет) — метаболическое заболевание, характеризующееся хронической гипергликемией, развивающейся в результате нарушения взаимодействия инсулина с клетками тканей. Этот тип заболевания обусловлен снижением чувствительности тканей к действию инсулина (инсулинорезистентность), который на начальных стадиях заболевания синтезируется в нормальных или даже повышенных количествах. Диабет 2 типа составляет 85—90% от всех типов сахарного диабета и наиболее часто развивается у людей старше 40 лет, и, как правило, ассоциирован с ожирением. Сахарный диабет проявляется повышением уровня глюкозы в крови, понижением способности тканей захватывать и утилизировать глюкозу и повышением мобилизации альтернативных источников энергии — аминокислот и свободных жирных кислот.
Высокий уровень глюкозы в крови и различных биологических жидкостях вызывает повышение их осмотического давления — развивается осмотический диурез (повышенная потеря воды и солей через почки), приводящий к дегидратации (обезвоживанию) организма и развитию дефицита катионов натрия, калия, кальция и магния, анионов хлора, фосфата и гидрокарбоната. У больного с сахарным диабетом возникают жажда, полиурия (частое обильное мочеотделение), слабость, повышенная утомляемость, сухость слизистых оболочек несмотря на обильное питьѐ воды, мышечные подѐргивания, сердечные аритмии и другие проявления дефицита электролитов. Кроме того, повышенный уровень глюкозы в крови и биологических жидкостях усиливает неферментативное гликозилирование белков и липидов, интенсивность которого пропорциональна концентрации глюкозы. В результате нарушается функционирование многих жизненно важных белков, и как следствие развиваются многочисленные патологические изменения в разных органах.

Билет №6.
1)Биосинтез гликогена. Реакции.
Гликоген – основной резервный полисахарид в клетках человека и животных, в котором остатки глюкозы соединены в линейных участках a – 1, 4 – гликозидной связью, а в точках ветвления - b – 1, 4 – гликозидной связью.
Т.е. Глюкоза поступает в клетку и фосфорилируется при участии АТФ с образованием глюкозо – 6 – фосфата (р – ция катализируется глюкокиназой) . Глюко – 6 фосфат в ходе обратимой р – ции превращается в глюкозо – 1 – фосфат (катализирующий фермент - фосфоглюкомутаза) . Т.к. эта р – ция является обратимой, необходима дополнительная стадия - образование УДФ – глюкозы из глюкозо – 1 – фосфата и УТФ (Т.Е. Глюкозо - 1- фосфат + УТФ = УДФ – глюкоза и H4P2O7) . И последняя р – ция – УДФ – глюкоза + гликоген затравка (C6H10O5)n = Гликоген.
Регуляция метаболизма гликогена.
В регуляции участвуют 2 ключевых фермента: гликогенфосфорилаза и гликогенсинтаза, а также глюкагон, инсулин и адреналин, которые как раз и запускают ход р – ций активирующих/инактивирующих данные ферменты.
1)Гликогенфосфорилаза сущ – ет в 2х формах: фосфорилированная (активная) и дефосфорилированная (неактивная). Взаимопревращение 2х форм гликогенфосфорилазы обеспечивается действием ферментов: киназы фосфорилазы и киназы фосфопротеинфосфатазы. Активация киназы фосфорилазы происходит под действием протеинкиназы А – ПК А(цАМФ - зависимой). цАМФ сначала активирует протеинкиназу А, которая фосфорилирует киназу фосфорилазы ,переводя ее в активное состояние ,а та, в свою очередь, фосфорилирует гликогенфосфорилазу. Синтез цАМФ стимулируется адреналином и глюкагоном. Активация фосфопротеинфосфатазы: Инсулин,
посредством реакций с участием Ras - белка, фосфорилирует и следовательно активирует протеинкиназу, которая активирует фосфопротеинфосфатазу. Актвиная фосфопротеинфосфатаза дефосфорилирует и инактивирует киназу фосфорилазы и гликогенфосфорилазу.
2)Гликогенсинтаза также существует в 2х формах: фосфорилированной и дефосфорилированной.
Отличия в регуляции гликогенсинтазы и гликогенфосфорилазы:
-фосфорилирование гликогенсинтазы катализирует протеинкиназу А и вызывает ее инактивацию;
-дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, ее активирует.
Особенности синетза гликогена в печени и мышцах:
Включение глюкозы в метаболизм начинается с образования - глюкозо-6-фосфата. В клетках мышц и других органах эту реакцию катализирует фермент гексокиназа, его Км менее 0,1 ммоль/л. В клетках печени эту же реакцию катализирует глюкокиназа, значение Км которой примерно 10 ммоль/л. (Следовательно, гексокиназа обладает большим сродством к глюкозе) Что значит, что насыщение глюкокиназы происходит только при высокой концентрации глюкозы.
Также различно физиологическое значение гликогенолиза в печени и в мышцах.
Мышечный гликоген является источником глюкозы для самой клетки ,а гликоген печени используется главным образом для поддержания физиологической концентрации глюкозы в крови. Различия обусловлены тем, что в клетке печени присутствует фермент глюкозо- 6-фосфатаза, катализирующая отщепление фосфатной группы и образование свободной глюкозы, после чего глюкоза поступает в кровоток. В клетках мышц нет этого фермента, и распад гликогена идет только до образования глюкозо-6-фосфата, который затем используется в клетке.
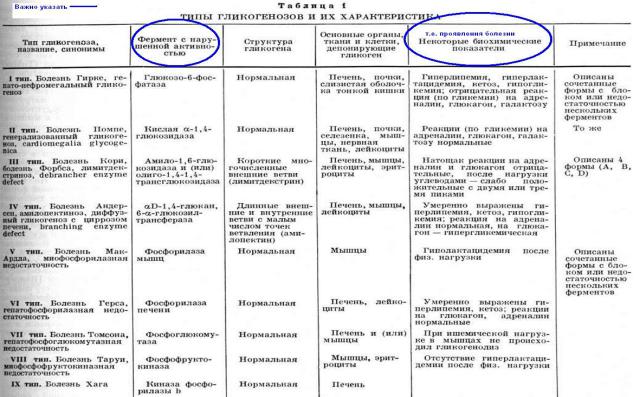
Гликогенозы – заболевания, обусловленные дефектом ферментов, участвующих в распаде гликогена.
2)Пентозофосфатный путь превращения глюкозы.
Является альтернативным путем окисления глюкозы – 6 фосфата. Соcтоит из 2х фаз: окислительной и неокислительной. ПФП обеспечивает клетки рибозой для синтеза нуклеотидов и гидрированным коферментов NADPH, который используется в восстановительных процессах.
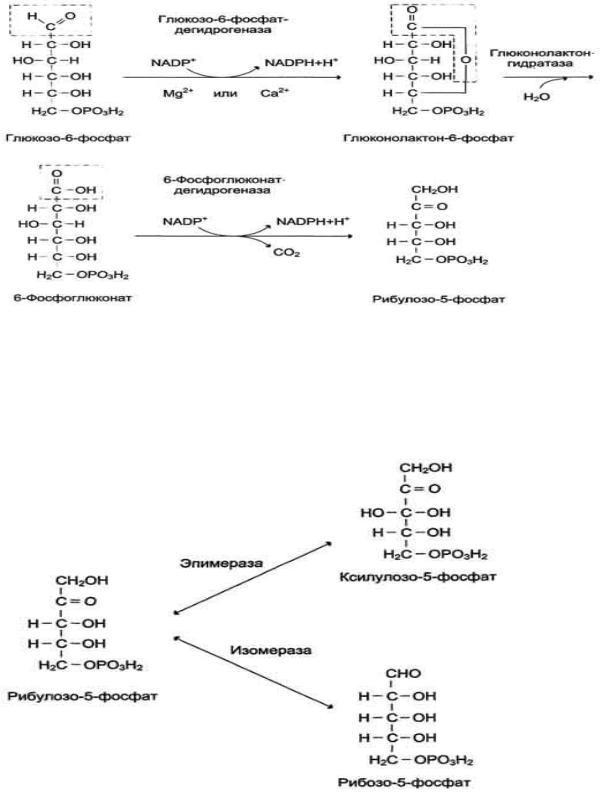
Суммарное ур. ПФП: 3 Глюкозо – 6 фосфат + NADP* -> 3 CO2 + 6(NADPH + H*) + 2фруктозо – 6 –фосфат + глицеральдегид – 3 –фосфат.
Окислительный этап:
Именно р-ции оксилительного этапа служат основным источником NADPH в клетках, который снабжает водородом биосинтетичекие процессы, оксилительно – восстановительные р – ции, вкл. Защиту клеток от активных форм кислорода.
Неокислительный этап:
