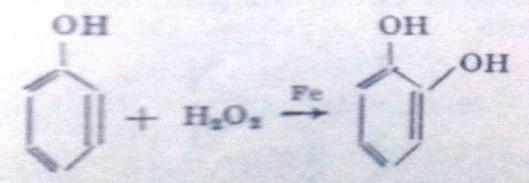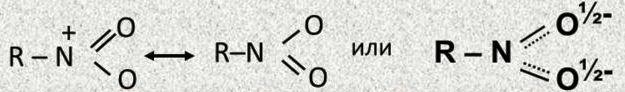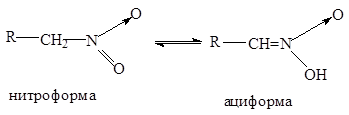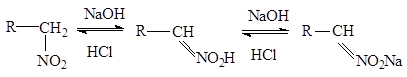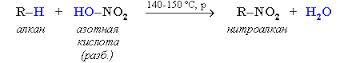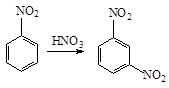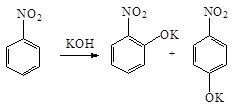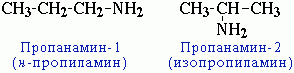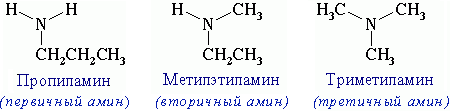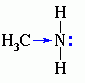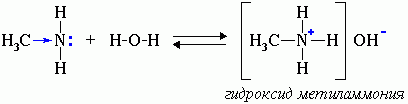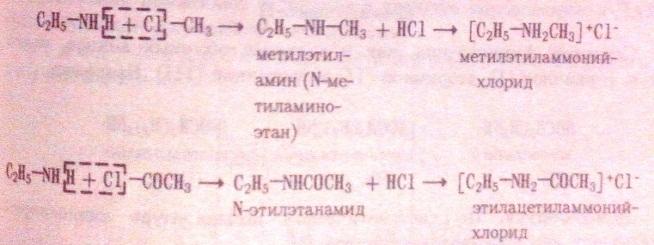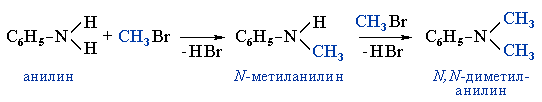Org_11-15
.docx
Спиртами назыв-т произ-ые углевод-в, в мол-ах кот-ых 1 или несколько водор-х атомов замещены на соответ-ее число гидроксил-х групп (-ОН). По стр-ю углев-ого радикала разл-ют:1)предельные (например, СH3–CH2–OH-этанол);2)непредел-е (CH2=CH–CH2–OH-пропиловый спирт);3)аромат-е (C6H5CH2–OH-фенилметанол). По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН). Например, СH3 – OH метанол, CH3 – CH2 – OH этанол; многоатомные (две и более групп -ОН). В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные (CH3 – OH метанол, CH3 – CH2 – OH-этанол, вторичные CH3 – CH – OH-пропанол-2, │ CH3 CH3 │ CH3 – C– OH-третичные-2-метилбутанол-2. │ C2H5 ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH). Имеют общую ф-лу СnH2n+1OH. Гомол-ий ряд начинается метанолом СH3-OH ,потом этанол-С2H5-OH и так далее увел кол С, подстав. в общую ф-лу. Номенкл-ра: для наимен-ия алканолов(одн-ые пред-ые спирты) хар-на систем-ая, радикально-функц-ая,карбинольная, тривиальная номен-ра. H3C – CH3-CH – OH-бутанол-2(системат-я). │ CH3 Спирт+углеводородн-й радикал (метиловый спирт-CH3 – OH)-рационал-я.Для нисших спиртов тривиал.-древесный- CH3 – OH. Карбинол-я-H3С – OH-карбинол- CH3 – CH2 – OH-метилкарбинол. Изомерия: 1)структурная изомерия:1. положения ОН-группы (начиная с С3); Например:
2)пространственная изомерия – оптическая -для алканов имеющих ассиметрический атом. Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
CH3 CH3 │ │ Н - C– OH │ OH-С-Н(антиподы,энантиомеры) │ │ C2H5 C2H5 Электронное строение мол-лы спирта:тСтр-ие самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства
спиртов определяются строением
гидроксильной группы, характером ее
химических связей, строением
углеводородных радикалов и их взаимным
влиянием.
Связи О–Н и С–О – полярные ковалентные. Вод-ая св в 20 раз меньше,чем ков.связь. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода: R→Оᵟ-←Нᵟ+
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. В связи с увел-ем кол-ва электродон-х замест-ей понижаются кислотные свойства. Кислотные св-ва: R-О-Н+Nа→ R-О-Nа+1 ∕ 2Н2↑; R-О-Н+NаОН→(не идёт). Основные св-ва спиртов прояв-ся при взаимод-ии с более сильными кислотами:CH3OH + HBr→ [CH3-О+-Н2]Br- (соль аксония-метилаксоний)→CH3Br + H2O Основ-е св-ва измен-ся в обратном порядке, чем больше элект-ая плотность на ат О, тем легче к нему присоед-ся протон. CH3OH +РСl5→ CH3Сl+РОСl3+НСl.
Р-я
взаимод-я спиртов с кисл-ми:
Спирт здесь как кислота(способ меченных атомов)Только стрелка ↔
Спирты
образ-ю сложные эфиры и с мин.к-тами:
R-[OH
+Н]ОNО2→R-О-NО2+Н2О.Р-я
дегидротации:при действии водоотнимающ-х
средств пол-ся:1)межмолекул-ая: CH3OH
+ HОС2H5→(над
стрел конц.серн.к-та) CH3-O-
С2H5+
Н2О.2)внутримолек-ое(наименее
гидрогинизирован.атом):
3)Р-я
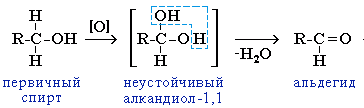
окисления: H3С-CH3-OH+[О]→
[H3С-CH-(ОН)2](внутримолекул-я
изомеризация)
→(-Н2О)
4)
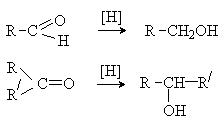
Третичные спирты окис-ся трудно и происх-т с разрывом С-С: C2H5-OH+3О2→2СО2+3Н2О. Способы получения:Спирты в природе в своб.сост-и вст-ся оч.редко,вст-ся в связ-м виде, в составе сложных эфиров.Получт синт-им методом.Основным промыш-м методом получ-т метанол: 1. Из водяного газа (получение метанола – древесный спирт) CO + 2H2 (t,Ni,Zn+Cr-смесь)→ CH3OH 2. Брожение глюкозы (получение этанола) C6H12O6(дрожжи) → 2C2H5OH + 2CO2↑ 3. Гидратация алкенов H3С-CH=Cᵟ-H2 + HOH t,kat-H3PO4→ H3C-CH(OH)-CH3 (пропанол-2)присоединение по правилу Марковникова 4.В лаборатории:взаимодействие галогеналканов R-Г с водными растворами щелочей CH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р. обмен)5.Р-я гидрирования карбонильных соед-й:
ПРИМЕНЕНИЕ.Метанол СН3ОН – используют как растворитель, в производстве муравьиной кислоты, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
|
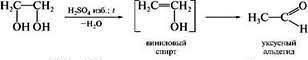
Двухатомные спирты – органические соединения, в молекулах которых содержится 2 гидроксильные группы (-ОН), соединённых с углеводородными радикалами.Общая ф-ла- СnH2n+1(OH)2. Первым предст-ем-этиленгликоль- HOСH2- СH2OH.,2-й- HOСH2- СHOH- CH3-пропиленгликоль. Номен-ра: Систем-ая-к назв-ю алкана доб-ся суф-с –диол, а цифрами указ-т место гидроксилов в углер-й цепи: CH3-CH2-CH-(OH)(вниз)-CH2OH-бутандиол-1,2.По рацион.номен-ре назв-е 2-хатом-х спиртов можно составить из названий соотв-их алкеновых углевод-ов с добавлением слова гликоль: HOСH2- СH2OH-этиленгликоль, HOСH2- СHOH- CH3-пропиленгликоль Изомерия:этих спиртов зависит от стр-ия углер-й цепи и распол-я в ней 2-х гидроксил-х групп (α-,β-,γ-гликоли и т.д.): H3C-HOСH- СH2OH(α-гликоль), HOСH2- СH2- CH2OH(β-гликоль) Получение:В методах пол-я много общего с одноат-ыми. 1)Гидролиз дигалогенопроизв-х:H3C-CH(Сl)(вниз)-CH2Сl(1,2-дихлорпропан)+2Н2О→ H3С-СHOH-СH2OH(пропандиол-1,2)+2НСl;2)Присоединение хлорноватистой к-ты:Н2С=СН2+НОСl→ Сl(вниз)Н2С-СН2-ОН(вниз)-этиленхлоргидрин; Сl(вниз)Н2С-СН2-ОН(вниз)+NаОН(водн)→ HOСH2- СH2OH;3)Хлорирование: Н2С=СН2+Сl(hῡ)→ Сl(вниз)Н2С-СН2- (вниз) Сl+2NаОНводн→ HOСH2- СH2OH+2NаСl. 3)Н2С=СН2 +О2(Ag) →CH2-CH2(оксид этилена) + H2O → CH2-CH2 \ / │ │ O ОН ОН 4)Р-я Вагнера: Н2С=СН2 +КМnО4+Н2О→ CH2-CH2+Мn2О+КОН │ │ ОН ОН Хим.св-ва: 1)Образ-е гликолятов-в отличии от одноат-х спиртов 2-хатом-е легко вступают во взаим-ие не только со щелоч.мет, но и с оксидами и гидрокс.тяж мет.
2)р-ии дегидротации:1)внутрим-ая дег-я-
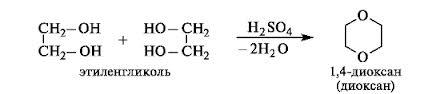
2)межмолекулярная дег-ия: HOСH2- СH2O[H+HO]СH2- СH2OH(-Н2О)→HOСH2-СH2-O-СH2-СH2OH (диэтиленгликоль) В 2-м случае процесс может идти и дальше-с образ-ем полимера: nHOСH2- СH2OH→[-СH2- СH2-O-]n (полиэтиленоксид)+nН2О При межмолек-ой дегидротации обр-ся не только линейные, но и цикл-е продукты:
3)Образование простых и сложных эфиров: Взаимод-я со спиртами или к-тами(орг или неорг), гликоли обр-ют прост и слож эфиры: HOСH2- СH2O[H+HO]-С2H5(Н+)→ HOСH2- СH2-O-С2H5+Н2О-простой эфир. CH2-CH2+2НNО3(Н+)→ CH2-CH2+2Н2О │ │ │ │ ОН ОН ОNO2 ОNO2 динитроэтиленгликоль(слож.эфир) 4)Окисление гликолей проходит ступенчато:гликолевый альдегид-глицер.альдегид+глиоксаль-далее окисл-ся до щавелевой к-ты
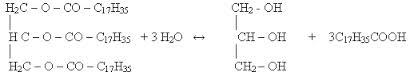
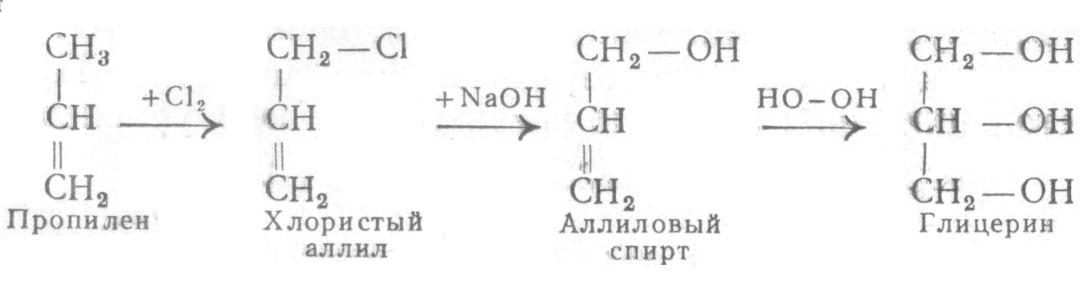
Трёхатомные спирты содержат 3 ОН-группы при разных угл-х атомах.Общая ф-ла- СnH2n+1(OH)3.Первый и основной предст-ль 3-хатом-х спиртов-глицерин(пропантриол-1,2,3)- HOСH2- СHOH-СH2OH.Номен-ра:Систем-я-добавить к наз-ю соотв-его алкана суффикс –триол.Изомерия: так же как и у дву-опр-ся строением углер-й цепи и полож-ем в ней 3-х ОН гр-п.Получение:1)В промышленности-гидролиз (омыление) жиров (триглицеридов) в присут-ии щелочей или к-т:
Триглицерид(жир) глицерин стеарин-я к-та Гидролиз в прис-ии щелочей приводит к обр-ю натриевой или калиевой солей высших к-т-мыла.2)Синтез из пропилена (способ Казанского)
Хим-ие св-ва: аналогичны св-вам одноат спиртов. В зав-ти от того, ск ОН групп спиртов вст-ет в р-ю, пол-ют 1,2 или даже 3 ряда соединений. При этом увел-ия числа ОН- групп в мол-ле усиливает кислотный характер многоат.спиртов. 1)С щелоч Ме:
2) Взаимодействие глицерина с галогеноводородными кислотами (происходит замещение гидроксогрупп).
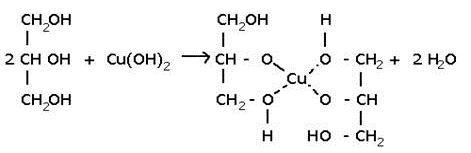
3)Образование глицератов-обр-ся глицерат меди (васил.р-р) Это качественная реакция на многоатомные спирты.
4)Обр-ие сложных эфиров.С орг-ими и мин к-ами обр-ет слож эф:
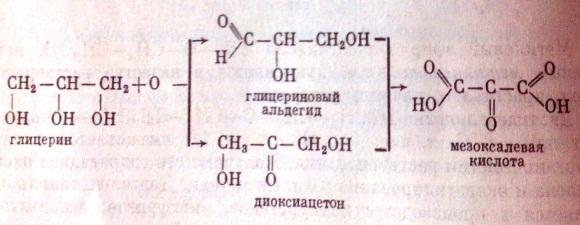
5)Окисление глицерина приводит к образ-ю глиц.альдегида и диоксиацетона, а затем, без разрыва углеродной цепи,мезоксалевой к-ты:
Особенностью многоатомных спиртов является большая подвижность атомов водорода в гидроксогруппе и легкая окислительность радикала. Причина: влияние этих групп друг на друга и на углеводородный радикал.Количественные изменения переходят в изменения качественные: накопление гидроксильных групп в молекуле обусловило в результате их взаимного влияния появление у спиртов новых свойств по сравнению с одноатомными (к примеру – взаимодействие с нерастворимыми основаниями-качест.р-ия).
|
|||||||||||||
|
13. Фенолы. Номенклатура, изомерия. Способы получения. Электронное строение фенола. Взаимное влияние гидроксигруппы и бензольного кольца. Сравнение кислотных свойств спиртов и фенолов. Химические свойства, применение фенолов. Произв-ые аром-х углевод-в, в мол-ле кот-ого атомы Н замещены на 1 или неск гидроксигрупп. Строение: в зав-ти от числаОН- в бенз-ом ядре разл-ют одно-,двух- и трёхатомные фенолы.
Номен-ра:Для
фенолов широко используют тривиальные
названия, сложившиеся
исторически-фенол(С6Н5ОН),
крезол(Н3С-С6Н4-ОН)
или по систем-ой,добавляя суффикс –ол
к систем-ому назв-ю аромат-ого
углевод-да
2. Изомерия боковой цепи (строения алкильного радикала и числа радикалов)
-СН-СН3
Радикалы
у 2-ого С:ортоизопропилфенол(1-гидроксо-2- изопропилбензол
СН3
-СН2-СН2-СН3- ортопропилфенол(1-гидроксо-2- пропилбензол
Способы получения фенола: в промышленности- 1)Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
1 стадия – получение кумола C6H6 + CH3-CH=CH2 t,kat-AlCl3→ C6H5-CH-CH3 │ CH3 (изопропилбензол – кумол) 2 стадия – каталитическое окисление
CH3 │ C6H5-CH-CH3+O2130,kat →[C6H5-C-O-O-H ]H2SO4→ C6H5-OH+аце-н │ │ CH3 CH3 неустойчивое соединение фенол
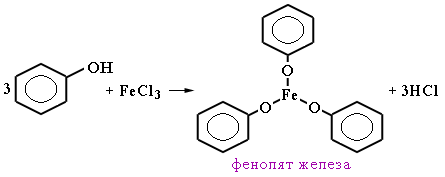
2)Из каменноугольной смолы (как побочный продукт – выход мал):
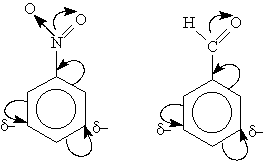
C6H5ONa + НОSO3H(разб) → С6H5 – OH + NaHSO4 фенолят натрия 3)Из галогенбензолов: С6H5-Cl + NaOHводн.р-р t,p → С6H5–OH + NaCl 4)Сплавлением натриевых солей бензолсульфокислот со щёлочью: C6H5-SO3Na+NaOH t→Na2SO3 + С6H5–OH натриевая соль бензолсульфокислоты Электронное стр-е фенола: Н в ОН-группе фенола слабее связан сО2, чем в мол-ле спирта, что явл-ся результатом сопряж-я своб-ой элетр-ой пары О2 с пи-электронной системой бензольного кольца.Происх-т смещение электронов от кислорода к бензольному ядру, поэтому Н2 в фенолах отщепляется легче, чем в спиртах.Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы,-I-эффект ): Именно этим обуслов-ы кисл-е св-ва фенола, кот яв-ся хотя и слабой, но к-ой(фенол-более сил.к-та,чем спирты).В связи с этим хим-ие св-ва неск-ко отличны от спиртов.
Взаимное влияние гидроксигр-ы и бензол-ого кольца. Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
Химические свойства.1.Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
C6H5OH
+ NaOH Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических. 3. Р-я,кот хар-ет фенол,как слабую к-ту(! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой) : C6H5ОNa + СО2+Н2О→C6H5OН↓+NaНСО3
2.Замещение
в бензольном кольце.
Наличие гидроксильной группы в качестве
заместителя в молекуле бензола приводит
к перераспределению электронной
плотности в сопряженной
Образуется 2,4,6-трибромфенол-осадок белого цвета. б) Нитрование (при комнатной температуре):
C6H5—OH
+ HОNO2(разб.) По второй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота-жёлтый)
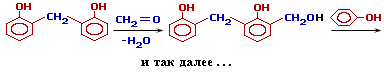
4. Поликонденсация с формальдегидами-при ↑t обр-ет формальд-ую смолу(новолок)
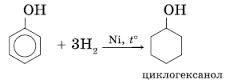
Р-ии ок-ия и гидр-ия:1)Гидрирование фенола(в произ-ве иск-ого капрона и нейлона)
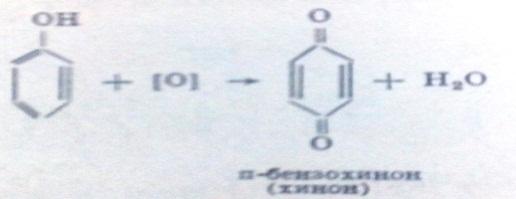
2)Р-я ок-ия
!Качественная реакция- коричнево-фиолетовая окр-а.
Применение фенолов:1.Производство синтетических смол, пластмасс, полиамидов. 2. Лекарственных препаратов. 3. Красителей. 4. ПАВ 5. Антиоксидантов 6.Антисептиков 7. Взрывчатых веществ.
|
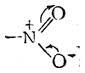
14.Нитросоединения алифатического и ароматического ряда. Нитрометан, электронное строение. Таутомерия (σ, π – сопряжение). Способы получения. Нитробензол, его электронное строение. Реакция нитрования бензола и его гомологов, ее механизм, условия нитрования в ядро /SЕ/ и в боковую цепь /SR/. Нитросоединениями называются органические вещества, производные углеводородов, в молекулах которых 1 или неск. водор-х атомов замещены на соотв-ее число нитрогрупп — NO2:R- NO2. В зависимости от харак-ра углер-ого атома, к кот связана нитрогруппа, разл-т перв-ые,втор-ые и трет-е нитросое-я:
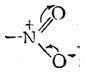
Строение нитрогруппы можно предст-ть такими стр-ами:
1-ые 3 ф-лы не совсем точно отраж-т стр-ие нитрогр-ы.. Уст-но,что связи в ней имеют промеж-ый хар-р-с вырав-ым распред-ем электр=й плотн-ти. Поэтому прав-ее стр-ие нитр-пы можно передать с пом-ью такой мезомерной формой(4).
Действие
щелочей
на нитр-ия. Нитрогруппа, яв-сь сильным
акцептором элек-в, способ-ет подвиж-ти
водор-х ат-в при α-угл-ом атоме:
Поэтому первичные и вторич нитрос-я в щелоч-й среде обр-ют новую форму нитр-я-кислотную аци-нитроформу, кот-я затем перех-т в соль:
Таутомерия-явл-е когда в-во может сущ-ть в виде неск-их изомерных форм, легко перех-х друг в др-а и нах-ся в динам-ом равн-ии(динамическая изомерия). Если щелочные растворы нитросоединений обработать минеральной кислотой то происходит медленный обратный сдвиг равновесия:
Поэтому нитр-ния относят к псевдокислотам . Для них хар-но-сами они нейтральны не обладают электропров-тью, но образуют нейт-ые соли щел-ых мет. «Нейтрализация» нитросоединений основаниями (образование нейтральных солей) происходит медленно,а истинных кислот – мгновенно. У нитрометане
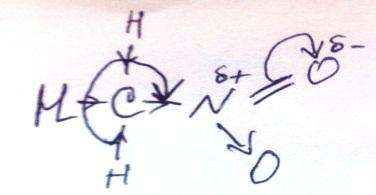
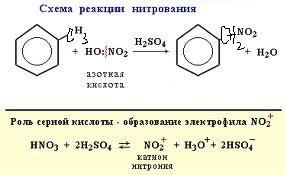
присут-ет (+М) (смещение элект-ой плотности с уч П-эл-ов), а по св С-N-(-I) (смещ-е элект плот-ти в стор. более электроотр-элемента).В ᵟ ,Пи-сопр-ии участ-ю только ат Н, в силу малого размера и бол. поляр-ти связи С-Н. NO2-явл-ся электроакц-ой гр-й. По ᵟ св-и С-N в мол-ле нитрометана дейст-ет (-I),т.к.элект плот-ть ᵟ-связи смещена в стор-у более электроотр-ого атома, однако сила М больше, мы видим это в составе нитрогруппы NO2, в ней Пи-элетроны смещ-ся в ст-у О, где соб-ся частично отр.заряд, а на ат N част пол.заряд, этот полож.заряд смещ-ет элект.плот трёх ᵟ-связей С-Н, только в α-пол-ии. Способы пол-я: Классическ.способ пол-ия нитрования углев-ов разб.аз.к-й-р-ия Коновалова.
Нитробензол. Строение:Правила ориентации (замещения) в бензольном кольце.Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов. В молекулах, имеющих только σ -связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта. Влияние заместителей, передающееся по сопряженной системе Пи-связей, называется мезомерным (М) эффектом. В молекуле бензола Пи-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним и относятся нитрогрупла —NO2. Она образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета-положениях:
Реакции замещения. 1-й-на примере-бензола.1 стадия-электрофил атакует бенз кольцо с повышен.электр.плот-ью.2-я ст-обр-ие Пи-комп,обл-ет аром.св-вами, отв-ет правилу Кюккеля-промеж-ое сост-ие,нельзя выделить в чист сост-и,3 ст- σ-комплекс неустойчив(карбокатион)-обр-ие связи с ат С,связь делокализована,идёт медленно, в кольце ост-ся 4 элек-на,2 ушли на об-ие связи, не облад-ет аром св-вами,не отвеч-ет прав.Кюккеля.4-ая р-ия идёт быстро,происх-т реаромат-я(возвр-е аром св-в),выталкивается Н+-протон.
В ядро(условияН+):Нитрогруппа в реакциях электрофильного замещения(SE)(ЭА-заместитель)направляет заместитель в мета - положение причем реакционная способность бензольного кольца уменьшается:
В реакциях нуклеофильного замещения(SN)(ЭД-заместитель) нитрогруппа направляет заместители в орто - и пара -положения. Так при нагревании нитробензола с порошкообразным KOH получается смесь о - и п -нитрофенолятов:
В боковой цепи:
Р-я Коновалова(на свету)-замещ-ся в R ат С.(SR) Активный радикал в этой реакции — O2NO·, продукт термического расщепления азотной кислоты. 2HNO3 —t°→ O2NO· + ·NO2 + H2O R—H + ·ONO2 → R· + HONO2 R· + ·NO2 → R—NO2
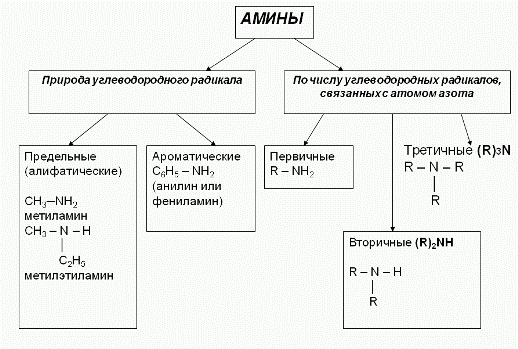
15.Амины алифатического и ароматического ряда /анилин/. Классификация, изомерия, номенклатура. Электронные строения аминов алифатического ряда и анилина. Химические свойства. Сравнение основных свойств аммиака, алифатических аминов и анилина. Амины – азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены алкильными группами (- R или – CnH2n+1). Функциональная группа:- NH2 аминогруппа. . Классификация аминов:деление на 1-ые,2-ые и 3-ые-связано со степенью замещ-я ат в мол-ле NH3
Номенклатура аминов: 1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса -амин. CH3-NH2- Метиламин, CH3-CH2-NH2 -Этиламин Различные радикалы перечисляются в алфавитном порядке. CH3-CH2-NH-CH3-метилэтиламин
При наличии одинаковых радикалов используют приставки ди- и три-.
(CH3)2NH-
Диметиламин
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин- (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи. Например: CH3-CH2-CH2-NH2- пропанамин-1, H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3 Изомерия аминов: 1.Структурная изомерия - углеродного скелета, начиная с С4H9NH2:
- положения аминогруппы, начиная с С3H7NH2:
- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
2.Пространственная изомерия: Возможна оптическая изомерия, начиная с С4H9NH2:
Свойства аминов: I. Основные свойства - для аминов характерны основные свойства, которые обусловлены наличием неподелённой электронной пары на атоме азота:
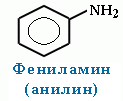
Алифатические амины(пред)– более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном. Ароматические амины(анилин) являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами. Ряд увеличения основных свойств аминов: C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH -------------------------------------------------→ возрастание основных свойств В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов. 1.Водные растворы аминов имеют щелочную реакцию-окр-ют лакмус в синий цвет (амины реагируют с водой по донорно-акцепторному механизму):
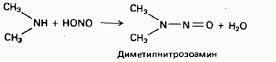
R-NH2 + H2O → [R-NH3]+ + OH- Ион алкиламмония Анилин с водой не реагирует и не изменяет окраску индикатора!!! 2. Взаимодействие с кислотами (донорно-акцепторный механизм):Сродство аминов к протону более ярко прояв-ся при их вз-ии с кисл-ми. H3C-NH2 + HСl→ [H3C-NH3]+ Сl- хлорид метиламмония 3. Взаимод-ие с азотистой к-ой:
С трет.аминами на холоду азотистая к-та не реаг,т.к.при азоте нет водорода.По этой р-ии можно отл-ть др от др-га 1-ые,2-ые и 3-ые амины. 4. Р-ии алкилирования и ацилирования:
II. Реакции окисления Реакция горения (полного окисления) аминов на примере метиламина: 4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2 Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны. III. Особые свойства анилина
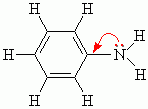
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. 1).Для анилина характерны свойства бензольного кольца – действие аминогруппы на бензольное кольцо приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
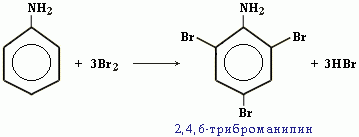
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
2)Свойства аминогруппы: С6Н5NН2 + HCl → [С6Н5NН3 ]+Сl- хлорид фениламмония Получение!1842 г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности Восстановление нитросоединений:R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O или R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина) Другие способы:1). Промышленный CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br 2). Лабораторный - Действие щелочей на соли алкиламмония (получение первичных, вторичных, третичных аминов): [R-NH3]Г + NaOH t → R-NH2 + NaГ + H2O 3). Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные.
|
|||||||||||||
|
|
|

 2.углеродного
скелета (начиная с С4);
Например, формуле
C4H9OH
соответствует изомеры:
2.углеродного
скелета (начиная с С4);
Например, формуле
C4H9OH
соответствует изомеры: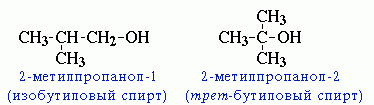 3.межклассовая
изомерия с простыми эфирами
Например,этиловый
спирт СН3CH2–OH и
диметиловый эфир CH3–O–CH3
3.межклассовая
изомерия с простыми эфирами
Например,этиловый
спирт СН3CH2–OH и
диметиловый эфир CH3–O–CH3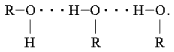 (водородная
связь)
(водородная
связь)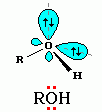 Атому
кислорода в спиртах свойственна
sp3-гибридизация.
В образовании его связей с атомами C
и H участвуют две 2sp3-атомные
орбитали, валентный угол C–О–H близок
к тетраэдрическому (около 108°). Каждая
из двух других 2 sp3-орбиталей
кислорода занята неподеленной парой
электронов.
Подвижность
атома водорода в гидроксильной группе
спирта несколько меньше, чем в воде.
Вода кислее спиртов. Более "кислым"
в ряду одноатомных предельных спиртов
будет метиловый (метанол).
Атому
кислорода в спиртах свойственна
sp3-гибридизация.
В образовании его связей с атомами C
и H участвуют две 2sp3-атомные
орбитали, валентный угол C–О–H близок
к тетраэдрическому (около 108°). Каждая
из двух других 2 sp3-орбиталей
кислорода занята неподеленной парой
электронов.
Подвижность
атома водорода в гидроксильной группе
спирта несколько меньше, чем в воде.
Вода кислее спиртов. Более "кислым"
в ряду одноатомных предельных спиртов
будет метиловый (метанол). 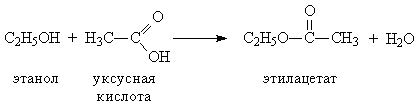
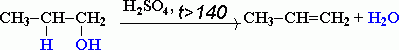
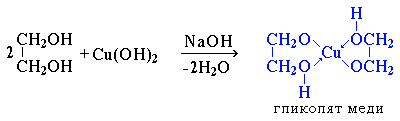


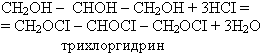

 -бензенол,или
гидроксибензол(фенол).В названиях
замещенных моноядерных фенолов
используются также приставки орто-,
мета- и пара -, употребляемые в
номенклатуре ароматических соединений.
Изомерия:Одноат-й
фенол изомеров не имеет. 2-х атом-е
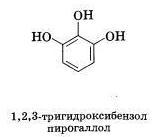
фенолы известны в виде 3-х изомеров(1.изомерия
положения заместителей в бензольном
кольце)
-бензенол,или
гидроксибензол(фенол).В названиях
замещенных моноядерных фенолов
используются также приставки орто-,
мета- и пара -, употребляемые в
номенклатуре ароматических соединений.
Изомерия:Одноат-й
фенол изомеров не имеет. 2-х атом-е
фенолы известны в виде 3-х изомеров(1.изомерия
положения заместителей в бензольном
кольце)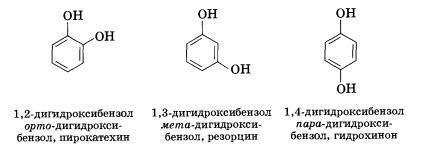
 1,2,4
и 1,3,5-будут изомерами.
1,2,4
и 1,3,5-будут изомерами.


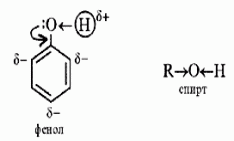
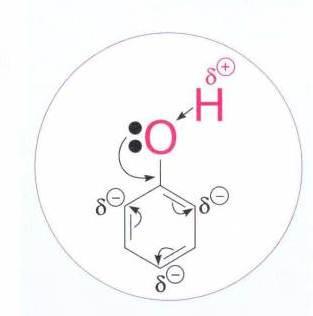
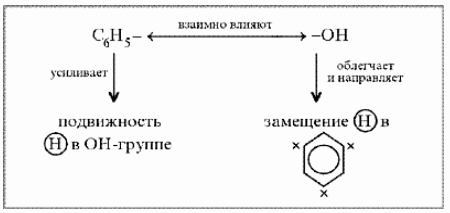
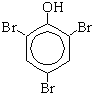

 (Почему?Взаимное
влияние атомов в молекуле фенола
проявляется не только в особенностях
поведения гидроксигруппы (см. выше),
но и в большей реакционной способности
бензольного ядра. Гидроксильная группа
повышает электронную плотность в
бензольном кольце, особенно, в орто-
и пара-положениях (+М-эффект ОН-группы))
(Почему?Взаимное
влияние атомов в молекуле фенола
проявляется не только в особенностях
поведения гидроксигруппы (см. выше),
но и в большей реакционной способности
бензольного ядра. Гидроксильная группа
повышает электронную плотность в
бензольном кольце, особенно, в орто-
и пара-положениях (+М-эффект ОН-группы))