
ДЗ Химия / Занятие 11
.docЗАНЯТИЕ 11
Методические указания для студентов
по теме "Аминокислоты, пептиды, белки. Классификация и структура белков"
Цель занятия: Сформировать у студентов знания о строении и биологической роли аминокислот, пептидов и белков, как основу для понимания их метаболических превращений в организме. Познакомить со строением и функциями гормонов, антибиотиков, лекарственных средств пептидной и белковой природы.
Исходный уровень
-
α –аминокислоты, входящие в состав пептидов, белков. Строение. Номенклатура. Стереоизомерия. Кислотно-основные свойства, диполярная структура.
-
Классификация α –аминокислот: по химической природе радикала, по кислотно-основным свойствам.
-
Химические свойства α –аминокислот: по аминогруппе (алкилирование, ацилироваение, образование оснований Шиффа); по карбоксильной группе (этерификации, образование галогенангидридов).
-
Биологически важные реакции α –аминокислот (декарбоксилирование, дезаминирование, окислительное дезаминирование).
-
Аналитически важные реакции обнаружения аминокислот (образование внутрикомплексных солей с катионом меди, нингидринная реакция, ксантопротеиновая реакция).
-
Теоретические вопросы
-
Образование пептидов, строение и свойства пептидной связи. Дипептиды, трипептиды, первичная структура белка.
-
Вторичная, третичная, четвертичная структура полипептидов, белков.
-
Функции белков в организме. Денатурация белков. Протеиды и протеины.
-
Важнейшие пептиды: глутатион, карнозин, 6-аминопенициллоновая кислота, инсулин, окситоцин, вазопрессин, метионин - энкефалин, лейцин - энкефалин.
II. Обучающие упражнения
Задание 1. Получите дипептиды, образованные фенилаланином и глицином, назовите их.
Ответ: Из данных аминокислот можно получить четыре дипептида.
1) О
∕∕
NН2 – СН2 – СООН + NН2 – СН2 – СООН ↔ NН2 – СН2 - С
-Н2О \
NН-СН2-СООН
глицил-глицин
2)

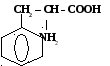
СН2 - СООН ↔
+ | -Н2О
NН2
фенилаланил-глицин
3
 )
)

+ ↔
-Н2О
фенилаланил-фенилаланин
4
 )
)
СН2 – СООН
| +
NН2 ↔
-
глицил-фенилаланин
Задание 2. Каковы особенности строения пептидной связи.
Ответ:
В составе пептидной (амидной) группы -СО-NH- атом углерода в sp2 гибридном состоянии, атом азота тоже в sp2 состоянии, неподеленная пара электронов атома азота вступает в сопряжение с - электронами двойной связи С=О. Пептидная группа представляет собой трехцентровую - р сопряженную систему, в которой электронная плотность смещена к кислороду, атомы С,О,N находятся в одной плоскости.

Вращение вокруг связи С-N затруднено, поэтому пептидная группа имеет плоскую, жесткую структуру.
Задание 3. Укажите строение и биологическую роль пептидных гормонов: окситоцина, вазопрессина и инсулина.
Ответ:
Окситоцин и вазопрессин - пептиды, выделяемые задней долей гипофиза. Оба гормона содержат по 9 аминокислотных остатка (нанопептиды). Окситоцин встречается только у женских особей. Он вызывает сокращение гладкой мускулатуры (матки), применяется в гинекологии и акушерстве.
Вазопрессин содержится в женском и мужском организмах. Он регулирует минеральный обмен и баланс жидкости (антидиуритический гормон).

Инсулин – гормон, ответственный за контроль метаболизма углеводов, жиров и белков, вырабатывается поджелудочной железой. Инсулин состоит из 2-х пептидных цепей А и Б, соединённых двумя сульфидными мостиками. Цепь А содержит 21, а Б – 30 аминокислотных остатков. С недостатком инсулина в организме связаны серьёзные нарушения углеводного обмена (сахарный диабет).

-
Задания для самостоятельной работы
Задание 1. Напишите схему образования глутатиона (γ-Глу-Цис-Гли) и его реакцию с гидропероксидом.
Задание 2. Напишите пептиды, которые могут образоваться при взаимодействии триптофана и α-аланина (in vitro).
Задание 3. Приведите систематическое название пептида с историческим названием везуген (Lis-Glu-Asp) . Представьте его структуру в ионизированной форме.
Задание 4. Приведите название ряда структурных белков, укажите их роль.
Задание 5. Приведите название некоторых транспортных белков. Укажите, какие белки переносят кислород, ионы меди, железа.
IV. Подведение итогов занятия
V. Домашнее задание:
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная литература
1. Тюкавкина Н.А., Бауков Ю.И. , Зурабян С.Э. .Биоорганическая химия. Учебник. ГЭОТАР-Медиа. 2010 – 416 с.
2. Тюкавкина Н.А., Бауков Ю.И., Зурабян С.Э. .Биоорганическая химия. Учебник. М., ГЭОТАР-Медиа.- 2009 – 416 с.
Дополнительная литература
1. Попков В.А., Пузаков С.А. Общая химия. Учебник для вузов, - М., ГЭОТАР - Медиа, 2007 - 976 с.
2. Биоорганическая химия: руководство к практическим занятиям: учебное пособие / ред. Н.А. Тюкавкина, Бауков Ю.И., Зурабян С.Э. - М., ГЭОТАР - Медиа, 2010 г. – 168 с.
Методическая рекомендация переработана 22 марта 2012г.
Зав. кафедры общей и Сторожок Н.М.
биоорганической химии, д.х.н., профессор
