
ДЗ Химия / Занятие 8
.docЗАНЯТИЕ № 8
Методические указания для студентов
по теме «Роль радикальных процессов. Свободные формы кислорода.
Пероксидное окисление липидов биологических мембран.
Ферментативные и неферментативные ингибиторы окисления»
Цель занятия: Сформировать у студентов представления о радикальных процессах. Показать образование свободных форм кислорода в условиях организма. Продемонстрировать механизм процесса пероксидного окисления липидов биологических мембран. Познакомить с игибиторами процесса пероксидного окисления ферментативной и неферментативной природы.
Значение изучения темы
Важным аспектом проблемы реакций окисления в организме человека являются процессы пероксидного окисления липидов (ПОЛ) биологических мембран. Эти процессы в норме протекают в организме, обеспечивая синтез ряда биологически важных соединений - биорегуляторов (простагландинов, лейкотриенов, тромбоксанов и др.). Интенсификация ПОЛ приобретает патогенетическое значение, поскольку может привести к нарушению целостности биологических мембран, к массовой гибели клеток. В связи с этим необходимо представлять способы коррекции патологических состояний, вызванных интенсификацией ПОЛ.
I. Теоретические вопросы
1. Значение протекания радикальных в организме.
2. Механизм зарождения активных форм кислорода в условиях организма.
3. Процессы пероксидного окисления липидов (ПОЛ) биологических мембран. Схема ПОЛ (инициирование, рост цепей, продолжение цепей, вырожденное разветвление, реакции обрыва цепей). Виды радикалов: пероксидный, алкильный, алкоксильный.
4. Основные представители ферментативных и неферментативных (антиоксидантных) систем организма, механизм их функционирования.
5. Биоантиоксиданты как ловушки алкильных (хиноны, каротиноиды) или пероксидных радикалов (-токоферол, кверцетин и др. фенолы).
II. Обучающие упражнения
Задание 1. Приведите механизм зарождения активных форм кислорода
В активном центре гемоглобина в результате переноса электрона от катиона железа к кислороду образуются супероксид-ион радикалы
Fe2+ - e Fe3+, О2 + е О2
При диспропорционировании супероксид-иона образуется пероксид водорода.
О2 + О2 + 2 Н+ Н2О2 + О2
При реакции супероксид-иона и пероксидом водорода образуется гидроксил-радикал Н2О2 + О2 2ОН + О2
В реакции супероксид-иона с гидроксил-радикалом образуется синглентный кислород:
ОН + О2 *О2(синглентный) + ОН- Образование высокоактивного ОН радикала происходит также по реакции Фентона: H2O2 + Fe2+ Fe3++ OH- + ОН
Задание 2. Напишите схему реакции пероксидного окисления на примере линолевой кислоты.
Ответ. В молекулах фосфолипидов связи С-Н, расположенные между двумя -связями ( в -положении к ним), атакуются гидроксильными или пероксильными радикалами. Рассмотрим этот процесс на примере линоленовой кислоты:
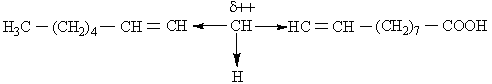
В результате образуются новые радикалы, существующие в двух мезомерных формах:
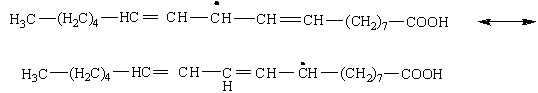
Радикал стабилизируется за счет делокализации электронной плотности в сопряженной системе: СН3-(СН2)4-СН. . . СН. . . СН. . . СН. . .СН-(СН2)7-СООН
Схематично описанный выше процесс представляется как
RH + OH H2O + R инициирование (0)
Таким образом, инициируется процесс неферментативного окисления липидов биологических мембран.
Образующийся алкильный радикал присоединяет молекулу кислорода (за время 10-6сек) и превращается в очень активный пероксидный (пероксильный) радикал:
R+ O2 RО2 рост цепей (1)
Пероксидный радикал RО2 взаимодействует с соседними углеводородными фрагментами молекулы фосфолипидов, что приводит к образованию гидропероксидов (RООН) и новому алкильному радикалу R, вновь присоединяющему молекулу О2 согласно реакции 1.
RО2 + RH RООH + R продолжение цепей (2)
Гидропероксиды способны разрушаться с разрывом О-О связей, что приводит к вторичному иницированию и, как следствие, ускорению окисления:
RООH RО + ОН вырожденное разветвление (3)
Последняя реакция крайне нежелательна для организма. Поэтому существуют ферментативные антиоксидантные системы, регулирующие в организме концентрацию активных кислородсодержащих ионов и радикалов.
Свободные радикалы взаимодействуют между собой, обрывая цепи окисления в соответствии с элементарными реакциями :
RO2+ RO2 молекулярные продукты
RO + RO молекулярные продукты
R + R молекулярные продукты
Задание 3. Покажите механизм действия ферментативной и неферментативной (антиоксидантной) системы.
Ответ. Ферменты каталаза и глутатионпероксидаза защищают аэробные клетки от окисления, предотвращая возможность радикального разрушения пероксидов. Субстратом для каталазы преимущественно служит пероксид водорода.
2 Н2О2 2Н2О + О2
В состав простетической группы каталазы входит гемовое железо, в активном центре происходит окисление (Fe2+ - e Fe3+).
Глутатионпероксидаза вместе с глутатионом разрушают пероксид водорода и гидропероксиды, защищая клетки от повреждающего действия радикалов, образующихся при гомолитическом разрыве связей RО-ОH.
Глутатион представляет собой трипептид, образованный глутаминовой кислотой, цистеином и глицином :

Реакционоспособной группой глутатиона (R-SH) является тиольная группа. Глутатион взаимодействует с пероксидом водорода и гидропероксидами липидов:
2 R-SH + H2O2 2 H2O + R-S-S-R
2 R-SH + R1OOH H2O +R1OH + R-S-S-R
Окисленный глутатион способен восстанавливаться:

 R-S-S-R
+ 2H+
+ 2 e
2 R-S-H
R-S-S-R
+ 2H+
+ 2 e
2 R-S-H
Активный центр
глутатионпероксидазы содержит остаток
селеноцистеина, в котором атом серы
цистеина заменен на атом селена: ![]()
Полагают, что действие глутатионовой ферментной системы может быть описано совокупностью реакций:
R-Se-H +H2O2 R-Se-OH + H2O (I)
R-Se-OH + 2 R-S-H R-Se-H + R-S-S-R + H2O (II)
R-S-S-R + НАДФ-Н 2 R-S-H + НАДФ+ (III)
Задание 4. Показать механизм действия антиоксидантов
Ответ. В присутствии относительно низких концентраций ингибиторов фенольного типа (IпН) (10-6 - 10-3 моль/л) обрыв цепей происходит на молекулах антиоксидантов согласно реакции:
IпН +RO2ROOH + Iп (обрыв цепей) (VII)
Радикал ингибитора (Iп) обычно неактивен и не участвует в продолжении цепей, в связи с чем антиоксидант выполняет роль ловушки свободных радикалов и способствует значительному торможению окисления.
формула основного липидного антиоксиданта - -токоферола:

В последние годы антиоксиданты применяются в клинической практике (антиоксидантотерапия).
III. Задания для самостоятельной работы
Задание 1. Приведите элементарные реакции инициирования, роста, продолжения и обрыва цепей на примере свободнорадикального окисления олеиновой кислоты. Дайте название радикалам, образующимся в результате этого процесса.
Задание 2. Покажите химизм взаимодействия липидов (RH) с гидроксильными и пероксидными радикалами. Перечислите соединения (антиоксиданты), способные тормозить процесс свободно радикального окисления липидов.
Задание 3. Напишите реакцию уничтожения свободных радикалов с участием важнейшего фенольного биоантиоксиданта (-токоферола).
Задание 4. Представьте механизм образования активных форм кислорода (О2, ОН, О2, Н2О2). Какие ферменты способны разрушать пероксид водорода и гидропероксиды?
Задание 5. В состав активного центра глутатионпероксидазы входит трипептид глутатион. Изобразите его структуру и приведите химизм реакции глутатиона с пероксидом водорода.
Задание 6. Соотнесите перечисленные ниже соединения к системам ферментативной и неферментативной защиты ПОЛ: супероксиддисмутаза, убихинон, каталаза, глутатионпероксидаза, флавоноиды, липоевая кислота, аскорбиновая кислота.
IV. Выполнение самостоятельной аудиторной работы «Пероксидное окисление липидов биологических мембран. Ферментативные и неферментативные ингибиторы окисления»
V. Подведение итогов занятия.
VI. Домашнее задание: Электронотранспортные цепи (митохондрий). Контрольное тестирование по II модулю.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная литература
1. Тюкавкина Н.А., Бауков Ю.И. , Зурабян С.Э. .Биоорганическая химия. Учебник. ГЭОТАР-Медиа. 2010 – 416 с.
2. Тюкавкина Н.А., Бауков Ю.И., Зурабян С.Э. .Биоорганическая химия. Учебник. М., ГЭОТАР-Медиа.- 2009 – 416 с.
Дополнительная литература
1. Зеленин К.Н., Алексеев В.В. Химия общая и биоорганическая. – СПб., «Элби-СПб» - 2003.-712 с.
2. Биоорганическая химия: руководство к практическим занятиям: учебное пособие / ред. Н.А. Тюкавкина, Бауков Ю.И., Зурабян С.Э. - М., ГЭОТАР - Медиа, 2010 г. – 168 с.
3. Попков В.А., Пузаков С.А. Общая химия. Учебник для вузов, - М., ГЭОТАР - Медиа, 2007 - 976 с.
Методическая рекомендация переработана 28.02. 2012г.
Зав. кафедрой общей
и биоорганической химии, д.х.н., профессор Сторожок Н.М.
