
- •8.Ионная связь. Металлическая связь.
- •12.Протонная теория кислот и оснований и. Бренстеда и т. Лоури.
- •13.Электронная теория Льюиса. «Жесткие» и «мягкие» кислоты и основания.
- •Качественное деление на жесткие, промежуточные и мягкие кислоты и основания
- •15.Химические свойства алкенов: реакции присоединения:
- •16.Особенности строения и свойств сопряженных алкадиенов. Реакции присоединения, полимеризации.
- •8.Ионная связь. Металлическая связь.
- •54. Гетерополисахариды. Полисахариды соединительной ткани. Понятие о хондроэтилсульфатах, гиаулуроновой кислоте, протеогликанах.
- •1) Азотистое основание - пиримидиновое или пуриновое
- •2) Моносахарид
- •3) Остаток фосфорной кислоты
- •4) Кессонная болезнь или Декомпрессионная болезнь,сокращенно — дкб.
- •39)Адсорбция на границе раздела твердое тело – газ.
- •40) 1) Молекулярная адсорбция из растворов на твердых адсорбентах.
- •2) Зависимость молекулярной адсорбции от различных факторов.
- •41) Поверхностно-активные, поверхностно-неактивные и поверхностно-инактивные вещества.
- •30.Дикарбоновые предельные кислоты (щавелевая, малоновая, янтарная). Ненасыщенные карбоновые кислоты (акриловая, малеиновая, фумаровая).
- •Гидроксикислоты (г/к)
- •Лактим-лактамная таутомерия
- •34.Понятие о кетокислотах на примере ацетоуксусной кислоты. Ацетоуксусный эфир, кето-енольная таутомерия. Кетонное расщепление ацетоуксусного эфира.
- •35.Гетерофункциональные производные бензольного ряда как лекарственные средства. Салициловая кислота и ее производные (ацетилсалициловая кислота, фенилсалицилат, метилсалицилат).
Гидроксикислоты (г/к)
Функц. группы Г/К : ОН и СООН (старшая)
Классификация
1) по у/в скелету:
алифат-кие; аромат-кие, циклические
2) по количеству СООН –групп:
моно-, ди- или трикарбоновые к-ты;
3) по количества ОН-групп: ди-, три- , тетра и т. д. гидроксикислоты.
По взаимному расположению функциональных групп различают α-, β-, γ-, δ-гидроксикислоты и т. д..Специфические свойства гидроксикислот обусловлены принадлежностью этих соединений одновременно к спиртам и карбоновым кислотам и во многом зависят от взаимного расположения
АМИНОКИСЛОТЫ, органические к-ты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной ф-ции аминокислоты подразделяют на аминокарбоновые, например, аминосульфоновые, например, аминофосфоновые, например, и аминоарсиновые, например. Согласно правилам ИЮПАК, название аминокислоты производят от названия соответствующей к-ты; взаимное расположение в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами, в нек-рых случаях - греч. буквами. Однако, как правило, пользуются тривиальными названиями аминокислот.Структура и физические свойства. По физ. и ряду хим. свойств аминокислоты резко отличаются от соответствующих к-т и оснований . Они лучше раств. в воде, чем в орг. р-рителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие т-ры плавления (часто разложения). Эти св-ва указывают на взаимод. аминных и кислотных групп, вследствие чего аминокислоты в твердом состоянии и в р-ре (в широком интервале рН) находятся в цвиттер-ионной форме. функциональных групп.
При нагревании a-аминокислот в результате межмолекулярной дегидратации образуются циклические амиды - дикетопиперазины:

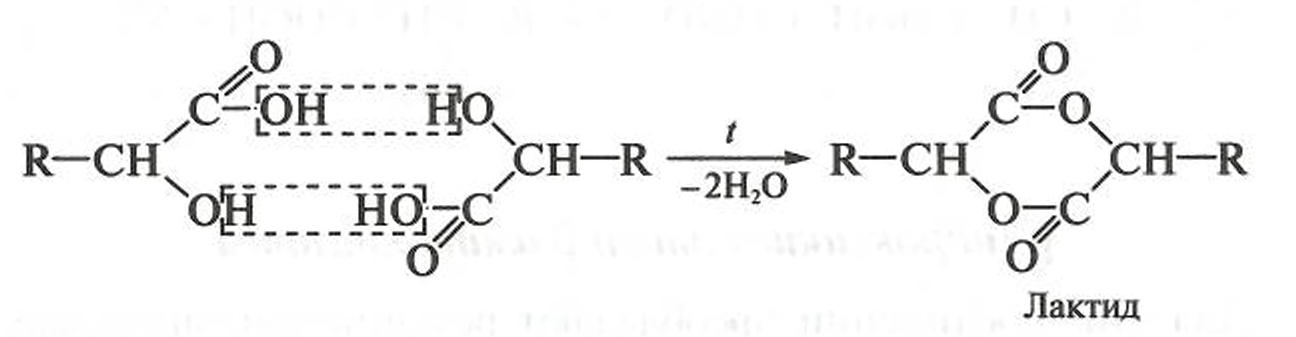
При близком расположении функциональных
групп реакция дегидратации проходит
межмолекулярно, при этом α-гидроксикислоты
образуют циклические сложные эфиры —
лактиды:
β-Гидрокси- и β-аминокислоты. Характерное общее свойство этих гетерофункциональных кислот заключается в способности к элиминированию молекулы воды или соответственно аммиака с образованием α,β-ненасыщенных кислот.

Реакции элиминирования протекают в мягких условиях. Это объясняется высокой протонной подвижностью α-атома водорода, обусловленной электронным влиянием двух электроноакцепторных
групп
(Х и СООН).

32.γ-гидрокси- и γ-аминокислоты. Реакции циклизации. Лактоны, лактамы. Лактим-лактамная таутомерия.
γ-Гидрокси- и γ-аминокислоты. Эти кислоты, как и кислоты с δ-расположением функциональных групп, при нагревании претерпевают внутримолекулярную циклизацию. Из гидроксикислот при этом образуются циклические сложные эфиры - лактоны, из аминокислот - циклические амиды - лактамы. Лактоны легко образуются уже при незначительном нагревании, а также в кислой среде.
|
|

Принципиально так же происходит внутримолекулярное взаимодействие амино- и карбоксильной групп в γ- и δ-аминокислотах.

Лактоны и лактамы, будучи соответственно сложными эфирами и амидами, гидролизуются в кислой или щелочной среде.
Лактим-лактамная таутомерия
Этот вид таутомерии характерен для азотсодержащих гетероциклов с фрагментом N=C—ОН.
Взаимопревращение таутомерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную ОН-группу, к основному центру — пиридиновому атому азота и наоборот. Обычно лактамная форма в равновесии преобладает.

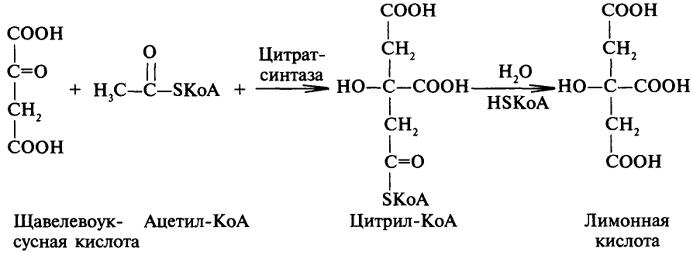
33.Двухосновные (яблочная, винные), трехосновные (лимонная) гидроксикислоты. Доказательство наличия 2-х карбоксильных групп в винной кислоте. Образование лимонной кислоты в результате альдольного присоединения. Разложение лимонной кислоты по типу α-гидроксикарбоновых кислот.
яблочная кислота(оксиянтарная
кислота, гидроксибутандиовая кислота)
НООС-СН(ОН)-СН2-СООН — двухосновнаяоксикарбоновая
кислота. Бесцветные гигроскопичные
кристаллы, хорошо растворимые в воде иэтиловом
спирте.
 Винная кислота является органическим
соединением – двухосновной оксикислотой.В
естественном виде винная кислота
встречается в винограде Винная кислота
(иначе – диоксиянтарная или тартаровая
кислота) представляет собой кристаллы
без запаха и цвета, которые имеют очень
кислый вкус. Как пищевая добавка винная
кислота имеет название Е334. Винная
кислота в естественном виде встречается
во многих фруктах. Особенно ее много в
винограде и цитрусовых. В некоторых
продуктах она сочетается с магнием,
кальцием или калием. Первоначально
винную кислоту получали как побочный
продукт винодельческой промышленности.
Она в основном использовалась для
предотвращения роста бактерий в вине
в чанах и бочках.Лимонная
кислота— одноводный кристаллогидрат.
Хорошо растворима
в воде: 133 грамма в 100 граммах воды при
20°С. Также растворяется в спирте,
диэтиловом эфире. При нагревании до
175°С лимонная кислота переходит в
аконитовую (А) и ацетондикарбоновую (Б)
кислоты, выше 175°С образует итаконовую
кислоту.
Винная кислота является органическим
соединением – двухосновной оксикислотой.В
естественном виде винная кислота
встречается в винограде Винная кислота
(иначе – диоксиянтарная или тартаровая
кислота) представляет собой кристаллы
без запаха и цвета, которые имеют очень
кислый вкус. Как пищевая добавка винная
кислота имеет название Е334. Винная
кислота в естественном виде встречается
во многих фруктах. Особенно ее много в
винограде и цитрусовых. В некоторых
продуктах она сочетается с магнием,
кальцием или калием. Первоначально
винную кислоту получали как побочный
продукт винодельческой промышленности.
Она в основном использовалась для
предотвращения роста бактерий в вине
в чанах и бочках.Лимонная
кислота— одноводный кристаллогидрат.
Хорошо растворима
в воде: 133 грамма в 100 граммах воды при
20°С. Также растворяется в спирте,
диэтиловом эфире. При нагревании до
175°С лимонная кислота переходит в
аконитовую (А) и ацетондикарбоновую (Б)
кислоты, выше 175°С образует итаконовую
кислоту.
Образование калиевых солей, обладающих
различными физическими свойствами,
является доказательством наличия двух
карбоксильных групп в винной кислоте.
 разложение
лимонной кислоты при нагревании в
присутствии серной кислоты происходит
по типу разложения а-гидроскикарбоновых
кислот. Образующаяся при этом муравьиная
и ацетодикарбоновая кислоты в результате
последующих превращений дают конечные
продукты- воду, оксид углерода, диоксид
углерода и ацетон.
разложение
лимонной кислоты при нагревании в
присутствии серной кислоты происходит
по типу разложения а-гидроскикарбоновых
кислот. Образующаяся при этом муравьиная
и ацетодикарбоновая кислоты в результате
последующих превращений дают конечные
продукты- воду, оксид углерода, диоксид
углерода и ацетон.

