
тесты по химии
.pdf
Министерство здравоохранения и социального развития Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
«Саратовский государственный медицинский университет имени В.И. Разумовского» Министерства здравоохранения и социального развития Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздравсоцразвития России)
«УТВЕРЖДАЮ» Зав. кафедрой общей и биоорганической
химии профессор ___________ П.В. Решетов
«______» ______________________ 2011 г.
СБОРНИК ТЕСТОВЫХ ЗАДАНИЙ ПО САМОСТОЯТЕЛЬНОЙ РАБОТЕ СТУДЕНТОВ
Специальность, курс: Лечебное дело 060101; курс I
Дисциплина: ХИМИЯ
Протокол заседания кафедры №2 от 22 сентября 2011г.
2011 г.
1

Тема: Основы количественного анализа. Протолитические
равновесия и процессы.
ТЕСТ 1
1.Выражение ω (СаС12)= 5% означает: а) 5 г СаС12 растворено в 95 г Н2О, б) 5 г СаС12 растворено в 100 г Н2О, в) 5 г СаС12 растворено в 1000 г Н2О.
г) 5 г СаС12 растворено в 1000 мл Н2О.
2.Эквивалентная масса меди в соединении СuSO4 равна: а) 80,0 г/моль б) 31,75 г/моль,
в) 79,5 г/моль г) 16 г/моль.
3.Укажите истинный раствор:
а) мел + вода б) вода + поваренная соль, в) вода + глина г) вода + масло.
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды; б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора; г) сколько мл растворенного вещества содержится в 1000 мл раствора.
5. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
а) МЭкв=2М; б) МЭкв=М/2 в) МЭкв=М/4;
г) МЭкв=М/n.
ТЕСТ 2
1.Нормальная концентрация – это количество моль вещества, растворенного в: а) 1 л раствора, б) 1 л растворителя,
в) 100 г растворителя г) 100 г раствора.
2.Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора, б) г вещества содержится в 1 мл раствра, в) г вещества содержится в 100 г раствора.
3. Приведите основную формулу для определения концентраций в объемном анализе.
а) С1V2= С2 V1
б) С1V1= С2 V2
в) 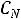 V2=
V2= 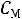 V1
V1
4. Масса хлорида натрия количеством вещества 0,8 моль равна:
а) 58,5 г,
2

б) 46,8 г, в) 29,25 г. г) 56,25г.
5. Массовая доля показывает количество: а) моль-экв/л;
б) г растворенного вещества на 100 г воды; в) 1 моль вещества в 1 л раствора; г) г растворенного вещества в 100 г раствора.
ТЕСТ 3
1. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора, б) г вещества содержится в 1 мл раствора, в) г вещества содержится в 100 г раствора.
2.Эквивалентная масса меди в соединении СuSO4 равна:
а) 80,0 г/моль, б) 31,75 г/моль,
в) 79,5 г/моль г) 16 г/моль.
3.Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды; б) сколько молей растворенного вещества содержится в 1 л раствора;
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора; г) сколько мл растворенного вещества содержится в 1000 мл раствора.
4. Приведите основную формулу для определения концентраций в объемном анализе.
а) С1V2= С2 V1
б) С1V1= С2 V2
в) 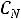 V2=
V2=  V1
V1
5. Укажите истинный раствор: а) мел + вода б) вода + поваренная соль, в) вода + глина
г) вода + масло.
Ответы к тестам
ТЕСТ 1
№ вопроса |
1 |
2 |
3 |
4 |
5 |
ответ |
а |
а |
б |
б |
б |
ТЕСТ 2 |
|
|
|
|
|
|
|
|
|
|
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
ответ |
а |
б |
б |
б |
г |
ТЕСТ 3 |
|
|
|
|
|
|
|
|
|
|
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
ответ |
г |
а |
б |
б |
б |
3

2. Протолитические реакции. Гетерогенные реакции в растворах
электролитов.
ТЕСТ 1
1.Кривой титрования в методе кислотно-основного титрования является зависимость: а) рН от объема прилитого титранта; б) СН+ от концентрации титранта;
в) концентрации кислоты от концентрации основания; г) рН от концентрации титранта.
2. MЭ KMnO4 при использовании его в качестве окислителя в нейтральной среде рассчитывается по формуле:
а) |
М KMnO4 |
,б) |
М КМnO4 |
,в) |
М КМnO4 |
г) |
|
М КМnO4 |
|
|
|
|
|
|
|
||||
|
3 |
2 |
|
5 |
|
с.о.Ме |
числоатомовМе |
||
3. Раствор точной концентрации можно приготовить из: |
|
|
|||||||
|
а) NaOH, |
б) НСl, |
|
|
|
|
|
|
|
|
в) Na2CO3, г) H2SO4. |
|
|
|
|
|
|
||
4.Интервал перехода окраски индикатора для кислотно-основных индикаторов это: а) изменение окраски индикатора вблизи точки нейтральности; б) интервал изменения рН вблизи точки эквивалентности; в) интервал изменения рН вблизи точки нейтральности;
г) интервал изменения рН, который приводит к изменению окраски индикатора.
5.Для создания кислой среды в перманганатометрии используют кислоту:
а) хлороводородную б) азотную в) серную
г) фосфорную
ТЕСТ 2
1.При титровании CH3COOH+КOH можно применить индикатор: а) ализариновый желтый (1,9-3,3 рН); б) метиловый красный (3,3-5,5); в)бромтимоловый синий (5,2-6,8рН); г) тимолфталеин (9,3-10,5).
2.Для точного измерения объема неприменима посуда: а) мерный цилиндр; б) пипетка; в) мерная колба;
г) химический стакан.
3.Для определения точной концентрации щелочи в растворе используется стандартный раствор:
а) НС1,
б) Н2С2О4,
в) Na2B4O7, г) H2SO4
4. В каком из титровании точка эквивалентности находится в щелочной среде:
а) KOH+HCl; б) NH4ОН+HCl;
в)CH3COOH+NH4ОН;
4

г) CH3COOH+NaOH.
5. В качестве первичного стандарта для кислотно-основного титрования могут быть использованы:
а) КОН;
б) H3PO4;,
в) H2SO4;
г) H2C2O4 2H2О.
ТЕСТ 3
1. Стандартный раствор – это раствор:
а) концентрация которого неизвестна, б) концентрация которого известна,
в) раствор, который получен при смешивании 2-х других растворов, г) раствор при титровании которого выпадает осадок.
2. Точка эквивалентности соответствует рН = 5 при титровании:
а) NH4 ОН + НCI,
б) NaOH + CH3COOH,
в) KOH + H2SO4,
г) CH3COOH + NH4OH.
3. Какой цвет будет иметь фенолфталеин в точке эквивалентности при титровании H2C2O4 раствором NaOH
а) малиновый, б) розовый, в) красный,
г) бесцветный.
1. Точка эквивалентности соответствует рН = 7 при титровании: а) КОН + НI, б) NaOH + CH3COOH,
в) KOH + H2SO4, г) CH3COOH + NH4OH.
5. Кривой титрования в методе кислотно-основного титрования является зависимость: а) рН от объема прилитого титранта; б) СН+ от концентрации титранта;
в) концентрации кислоты от концентрации основания; г) рН от концентрации титранта.
Ответы к тестам
ТЕСТ 1
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
ответ |
а |
б |
в |
б |
а |
|
|
|
|
|
|
ТЕСТ 2 |
|
|
|
|
|
|
|
|
|
|
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
ответ |
г |
г |
б |
г |
г |
|
|
|
|
|
|
ТЕСТ 3 |
|
|
|
|
|
|
|
|
|
|
|
№ вопроса |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
5
ответ |
б |
а |
б |
в |
а |
|
|
|
|
|
|
3. Буферные растворы
ТЕСТ 1
1.У больных сахарным диабетом за счет накопления в организме β- гидроксимасляной кислоты развивается:
а) метаболический алкалоз б) респираторный алкалоз в) метаболический ацидоз г) респираторный ацидоз
2.Буферная емкость при разбавлении растворов:
а) уменьшается, в результате уменьшения концентрации всех компонентов системы; б) увеличивается, т.к. увеличивается степень диссоциации электролитов; в) не изменяется, т.к. соотношение концентрации компонентов остается прежним; г) не изменяется, т.к. количество компонентов остается прежним.
3.В организме имеет место следующее равновесие:
Н+ + НСО3-↔ Н2СО3- ↔ Н2О + СО2 (плазма) ↔ СО2 (легкие) при гиповентиляции легких:
а) щелочной резерв крови уменьшается, рН мочи увеличивается; б) щелочной резерв крови уменьшается, рН мочи уменьшается; в) щелочной резерв крови увеличивается, рН мочи увеличивается; г) щелочной резерв крови увеличивается, рН мочи уменьшается.
4.При интенсивной физической нагрузке развивается метаболический ацидоз. Какой режим дыхания можно рекомендовать спринтеру перед началом бега для предварительной компенсации метаболического ацидоза:
а) гиповентиляцию легких б) режим дыхания не имеет значения в) гипервентиляцию легких.
5.Буферные растворы можно приготовить из растворов:
а) HNO3 и КОН, |
б) NH3Cl и NH4OH, |
в) HCl и KNO3, |
г) NH4OH и H2S |
|
ТЕСТ 2 |
1. рН буферной системы зависит от: а) концентрации компонентов, б) объѐма буфера, в) разведения,
г) соотношения концентрации компонентов.
2. При рН = 7,4 соотношение компонентов бикарбонатного буфера H2CO3/NaHCO3:
а) 1:20, б) 20:1, в) 1:1, г) 1:5
3.При компенсированном алкалозе:
а) рН = 7,4, щелочной резерв 55 объемных %, б) рН = 7,2, щелочной резерв 70 объемных %, в) рН = 7,4, щелочной резерв 70 объемных %, г) рН = 7,4, щелочной резерв 40 объемных %.
4.рН буферной системы зависит от: а) объѐма буфера, б) концентрации компонентов, в) разведения,
6
г) соотношения концентраций компонентов
5.Какая из буферных систем принимает участие в нейтрализации ионов водорода в почечной ткани:
а) бикарбонатная б) фосфатная, в) гемоглобиновая г) ацетатная.
ТЕСТ 3
1.Щелочной резерв крови определяется количеством мл СО2 в объѐмных % в расчете на:
а) 1000 мл, б) 100 мл, в) 10 мл, г) 1,0 мл сыворотки крови.
2. Буферная ѐмкость количественно определяется:
а) моль/экв сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу; б) моль/л сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу;
в) числом мл слабой кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу; г) числом мл сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН.
3.При заболеваниях, связанных с нарушением дыхательной функции легких
(бронхит, пневмонии), приводящих к увеличению содержания СО2 в легких, наблюдается:
а) дыхательный ацидоз б) рН крови не меняется в) дыхательный алкалоз
г) метаболический алкалоз.
4.Наиболее быстродействующей буферной системой в организме является:
а) бикарбонатная б) фосфатная в) белковая
г) гемоглобиновая.
5.Щелочной резерв крови – это количество мл СО2, находящегося в 100 мл сыворотки крови. В норме оно равно:
а) 24%, б) 55%в) 35%г) 76%.
Коллигативные свойства растворов. Осмос.
ТЕСТ 1
1.Если ∆Н растворения меньше нуля – это процесс: а) эндотермический б) экзотермический в) сбалансированный г) атермический.
2.Факторы, свидетельствующие о химизме процесса растворения? а) диффузия б) тепловой эффект, в) контракция
г) изменение окраски раствора.
7
3.Осмотическое давление рассчитывается по формуле:
а) πосм = СRT б) πосм = СT в) πосм = МRT
г) πосм = К2С
4.Криоскопической константой Кзам, называется:
а) понижение температуры замерзания раствора, обусловленное 1 молем вещества, растворѐнного в 1000 г растворителя,
б) повышение температуры замерзания раствора, обусловленное 1 молем вещества, растворѐнного в 1000 г растворителя,
в) понижение температуры замерзания раствора, обусловленное 1 молем вещества, растворѐнного в 100 г растворителя,
г) повышение температуры замерзания раствора, обусловленное 1 молем вещества, растворѐнного в 100 г растворителя
5.Идеальным раствором называется раствор:
а) раствор, образование которого не сопровождается химическим взаимодействием,
изменением объѐма и тепловым эффектом (∆Нсмеш. = 0), б) раствор, образование которого сопровождается химическим взаимодействием,
изменением объѐма и тепловым эффектом (∆Нсмеш. > 0), в) раствор, образование которого сопровождается химическим взаимодействием,
изменением объѐма и тепловым эффектом (∆Нсмеш. < 0), г) раствор, образование которого не сопровождается химическим взаимодействием, изменением объѐма и тепловым эффектом (∆Нсмеш. > 0).
ТЕСТ 2
1.Испарение – это процесс: а) экзотермический б) атермический в) эндотермический
г) сначала идет с выделением тепла, а затем с поглощением.
2.Чем выше концентрация растворенного вещества в растворе, тем: а) ниже температура кипения,
б) выше температура кипения, в) температура равна 00С
г) сначала идет повышение температуры, а затем понижение.
3.Эбуллиоскопической константой называется:
а) повышение температуры кипения, которое происходит при растворении 1 моля вещества в 1000 г растворителя,
б) понижение температуры кипения, которое происходит при растворении 1 моля вещества в 1000 г растворителя,
в) повышение температуры кипения, которое происходит при растворении 1 моля вещества в 100 г растворителя,
г) понижение температуры кипения, которое происходит при растворении 1 моля вещества в 100 г растворителя,
4.Движение растворителя из окружающей среды в осмотическую ячейку называют: а) экзоосмосом б) эндосмосом, в) тургором г) диффузией.
5.Осмотическое давление рассчитывается по закону:
а) Шредингера
8
б) Гейзенберга, в) Вант Гоффа г) Рауля.
ТЕСТ 3
1.Изотоническими растворами называются растворы, у которых: а) осмотическое давление одинаково, б) осмотическое давление неодинаково,
в) концентрации растворов равны между собой, г) осмотическое давление равно 0.
2.Плазмолиз – это процесс сжатие и сморщивание оболочки клетки, он наступает в результате:
а) эндоосмоса б) экзоосмоса, в) диффузии г) нагревании.
3.Основную роль осморегуляции выполняют: а) легкие б) печень и поджелудочная железа, в) почки г) кровь.
4.При помещении клеток в гипотонический раствор вода из внешнего раствора переходит внутрь клеток, что приводит к их набуханию, а затем разрыву оболочек и вытеканию содержимого. Этот процесс называют:
а) гемолизом б) лизисом в) плазмолизом г) тургором
5.В хирургии для очищения гнойных ран применяют повязки с гипертоническим раствором:
а) хлорида калия 1% б) хлорида кальция 5%
в) хлорида натрия 0,9% г) хлорида натрия 9%
Физико – химия поверхностных явлений Адсорбционные равновесия и процессы на границах раздела фаз. Хроматография. Физико – химия дисперсных систем.
Коллоидные системы. Физико – химия растворов ВМС. Студни. Гели.
1. Физико – химия поверхностных явлений Адсорбционные равновесия и процессы на границах раздела фаз. Хроматография.
ТЕСТ 1
1.Поверхностное натяжение уменьшают вещества:
а) Na2SO4 б) Ca(OH)2 в) C2H5OH г) H2SO4
2.Поверхностная активность будет выше у спирта: а) метанола б) этанола
9
в) пропанола г) бутанола
3.Поверхностное натяжение мочи будет выше, если к ней добавить: а) воду б) спирт
в) сахарозу г) соляную кислоту
4.К ПАВ относятся:
а) NaHSO4
б) C17H35COONa, в) H3PO4
г) H2O
5. Адсорбция – это процесс: а) физический б) физико-химический в) химический г) молекулярный
ТЕСТ 2
1.При адсорбционной хроматографии присутствуют: а) неподвижный растворитель б) подвижный растворитель в) подвижный адсорбент г) неподвижный адсорбент
2.Адсорбционная способность ионов будет больше у:
а) Li+
б) K+
в) Na+ г) Cs+
3.Адсорбция активированным углем является:
а) ионообменной б) распределительной в) молекулярной
г) молекулярно - ситовой
4.На твердом адсорбенте BaSO4 лучше адсорбируются ионы: а) СО32-
б) SO42-
в) Ca2+ г) Ba2+
5.С увеличением температуры физическая адсорбция: а) увеличивается б) уменьшается в) не изменяется
г) меняется периодически
ТЕСТ 3
1.С удлинением цепи углеводородного соединения растворимость его в воде: а) не изменяется б) уменьшается в) увеличивается
г) сначала увеличивается, затем уменьшается
10
