
работа с 1заоч лаб раб ВПООС / Определение рН в природных и сточных водах
.docМинистерство образования и науки Российской Федерации
федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Северный (Арктический) федеральный университет имени М.В. Ломоносова»
|
Институт энергетики и транспорта |
|
|
Кафедра теплоэнергетики и теплотехники |
|
|
13.03.02 Электроэнергетика и электротехника |
|
|
(код и наименование направления подготовки/специальности) |
|
Лабораторная работа №2 ОПРЕДЕЛЕНИЕ рН В ПРИРОДНЫХ И СТОЧНЫХ ВОДАХ
Водородным показателем (рН) называется величина, равная отрицательному десятичному логарифму концентрации ионов водорода:
РН=-lg(CH+)
Если CH+=10-7 моль/л, то рН=7 – среда нейтральная;
если CH+>10-7 моль/л, то рН<7 – среда кислая;
если CH+<10-7 моль/л, то рН>7 – среда щелочная.
Возможный диапазон изменения рН=014. В большинстве природных вод рН=6,58,5. При сбросе сточных вод в канализацию или в водоемы, рН также должна быть в этих пределах. В противном случае может иметь место повышенная коррозия труб, а также гибель или уменьшение биомассы на очистных сооружениях.
|
Значения pH для некоторых известных веществ |
|
||
|
Вещество |
pH |
Вещество |
pH |
|
Желудочный сок |
1,0—2,0 |
Кислотный дождь |
< 5,6 |
|
Лимонный сок (5% р-р лимонной кислоты) |
2,0±0,3 |
Слюна |
6,8–7,4 |
|
Пищевой уксус |
2,4 |
Молоко |
6,6-6,9 |
|
Кока-кола |
3,0±0,3 |
Чистая вода |
7,0 |
|
Яблочный сок |
3,0 |
Кровь |
7,36—7,44 |
|
Пиво |
4,5 |
Морская вода |
8,0 |
|
Кофе |
5,0 |
Мыло (жировое) для рук |
9,0—10,0 |
|
Шампунь |
5,5 |
Нашатырный спирт |
11,5 |
|
Чай |
5,5 |
Отбеливатель (хлорная известь) |
12,5 |
|
Кожа здорового человека |
5,5 |
Концентрированные растворы щелочей |
>13 |
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
-
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1–2 единицы.
-
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
-
Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
Устройство и работа pH- метра pH-410
Принцип работы приборов основан на измерении разности потенциалов в электродной системе при контроле температуры раствора датчиком температуры.
Прибор состоит из преобразователя и электродной системы. Электродная система может включать измерительный и сравнительный электроды или комбинированный электрод. Электронная плата внутри корпуса выполняет функции измерения поступающего сигнала, его усиления, преобразования, математической обработки, вывода выходного сигнала на дисплей.
Электрод сравнения - хлорсеребряный электрод с электрическим сопротивлением не более 20 кОм.
Измерительный электрод - стеклянный электрод с допускаемой величиной электрического сопротивления от 10 до 1000 МOм используют при измерениях pH.
Комбинированные электроды используются для контроля объектов окружающей среды, продукции и параметров технологических процессов в промышленности. Комбинированные электроды могут быть оснащены дополнительными устройствами для измерения рН в вязких и плотных средах.
Калибровку прибора выполняют с каждым измерительным электродом по растворам стандарт-титров. В памяти прибора сохраняются данные только последней калибровки.
Редоксметрический (платиновый) измерительный электрод используют при измерениях окислительно-восстановительного потенциала Eh.
В качестве датчика температуры (термокомпенсатора) используется термосопротивление.
Общий вид pH- метра
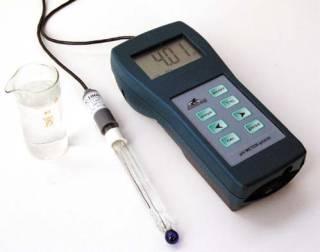
Режим калибровки прибора с электродной системой
Калибровку прибора выполняют по двум калибровочным растворам [РТ1] и РТК2], значения рН которых находится вблизи нижней [РТ1] и верхней [РТ2] границ диапазона.
Калибровку следует производить по возможности чаще, а при смене измерительного электрода обязательно.
Электроды, подготовленные в соответствии с паспортом, погружают в первый калибровочный раствор [РТ1]. Включают прибор нажатием кнопки «On/Off». На дисплее индицируется результат измерения ЭДС раствора в mV.
Режим калибровки включают нажатием и удерживанием около 5 секунд кнопки «CAL». На дисплее появляется значение рН первого калибровочного раствора [РТ1].
Нажатием кнопок «влево», «вправо» выбирают одно из стандартных значений рН первого калибровочного раствора [РТ1], заложенных в память прибора (например, 4.01 рН).
Если значение рН первого калибровочного раствора [РТ1] не соответствует ни одному из стандартных значений введенных в память прибора (например, требуется ввести 4.5 рН), то удерживанием кнопок «влево», «вправо» его можно установить.
Нажимают кнопку «ENTER» для подтверждения значения рН первого калибровочного раствора [РТ1]. Прибор автоматически переходит в режим измерения ЭДС первого калибровочного раствора [РТ1].
Необходимо дождаться установления показаний, после чего нажимают клавишу «ENTER» для ввода значения ЭДС первого калибровочного раствора [РТ1] в память преобразователя.
После того, как в память прибора было введено э.д.с. первого калибровочного раствора [РТ1] электродную систему промывают дистиллированной водой, остатки воды удаляют фильтровальной бумагой. Электроды, подготовленные в соответствии с паспортом, погружают во второй калибровочный раствор [РТ2]. Повторяют описанные выше операции.
После ввода значения ЭДС второго калибровочного раствора [РТ2] в память преобразователя на дисплее индицируется значение крутизны водородной характеристики применяемого электрода.
Прибор переходит в режим измерения рН раствора в который погружена электродная система.
Выполнение измерений рН
Датчик температуры и электроды погружают в измеряемую среду. Нажатием кнопки «On/Off» включают прибор. На дисплее прибора отображается результат измерения ЭДС раствора в мВ.
Нажатием кнопки «mV/pH» выбирают режим измерений рН. Проводят измерение. Показания прибора - результат измерения в рН отображается на дисплее. Результаты регистрируют после установления стабильного значения.
Перевод прибора в режим измерения окислительно-восстановительного потенциала осуществляют нажатием кнопки «mV/pH», не входя в режим калибровки.
После (или в процессе) получения результатов измерений, при необходимости, можно перейти в режим измерения температуры раствора, нажав кнопку «ToC». На дисплее появляется результат измерения температуры раствора в 0С.
Нажатием клавиши «On/Off» выключают прибор.
По окончании работы электроды промывают дистиллированной водой.
Измеренные начения pH
|
Образец № |
Вещество |
pH |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
|
7 |
|
|
