
Sovremennaya_khimia_predstavlyaet_soboy_sistemu_nauchnykh_distsiplin_vklyuchaya_v_sebya_obschuyu
.docxСовременная химия – система научных дисциплин, включающая в себя общую, неорг, аналит, орг, физ и коллоидную химию.
Химия – это наука, изучающая св-ва и превращения вещ-в, сопровождающееся изменениям их состава и строения.Атомно- молекулярные учения заключаются в следующем: 1. Все вещ-ва состоят из молекул 2. Все молекулы состоят из атомов 3. Молекулы и атомы нах-ся в непрерывном движении и между ними сущ-ют силы притяжения и отталкивания.Молекула – это наименьшая частица вещ-ва, обладающая его хим св-вами.Атом – это наименьшая частица хим элемента, сохраняющая все его хим св-ва.Хим элемент – вид атомов, характеризующий определенными зарядами ядер и строениемэлектронных оболочек. Ионы – одноатомные или многоатомные частица, несущие электрический заряд (положительный - катионы, отрицательный - анионы).Валентность – способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием хим связи.Международная единица атомных масс = 1/12 массы изотопа C.Относительная атомная масса Ar – безразмерная величина, равная отношению средней массы атома элемента к 1/12 массе атома С.Молярная масса показывает массу одной молекулы вещества.1) Закон сохранения массы (М.В.Ломоносов, А. Лавуазье): масса вещ-в, вступивших в хим реакцию = массе вещ-в, образовавшихся в результате реакции.
2)
Закон постоянства состава (Ж. Пруст):
каждое хим чистое соединение независимо
от способа его получения имеет строго
определенный состав.
2CO+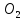 =C
=C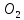 C+
C+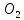 =
C
=
C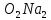 C
C +2HCl=
C
+2HCl=
C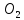
Из
данного закона следует, что при образовании
сложного вещ-ва элементы соединяются
друг с другом в определенных массовых
отношениях. CuS
– сульфид меди m(Cu):
m(S)=
A(Cu):
A(S)=
64:32=2:13) Закон
кратных отношений (Д. Дальтон): Если два
элемента образуют друг с другом несколько
хим соединений, то на одну и ту же массу
одного из них приходится такие массы
других, кот-ые относятся между собой
как простые целые числа.
N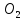 V(N
V(N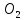 )
(
)
(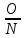 )=
)=
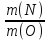 =
=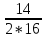 =
=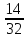
4)
Закон
Авогадро (А. Авогадро): В равных объемах
различных газов при одинаковой T
и P
содержат одинаковое кол-во молекул.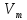 =
22.4 л/моль (при T=273
К и P=1.01*
=
22.4 л/моль (при T=273
К и P=1.01*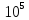 Па)
Па)
Из
данного закона вытекают
2 важных следствия:
1. Одно и тоже число молекул различных
газов при одинаковых условиях занимают
одинаковый объем. 2. При н.у. (T
и P)
один моль одного газа занимает
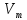 =
22.4 л/моль5) Закон
эквивалентов (В. Рихтер) : во всех хим
реакциях взаимодействие различных
вещ-в друг с другом происходит в
соответствии с их эквивалентами.
Эквивалент
– это реальная или условная частица,
которая присоединяет или отдает один
протон в кислотно- основных реакциях,
а в ОВР принимает или отдает один
электрон. Число, показывающие, какая
часть молекулы или другой частицы вещ-ва
соответствует эквиваленту, называется
фактором
эквивалентности.
=
22.4 л/моль5) Закон
эквивалентов (В. Рихтер) : во всех хим
реакциях взаимодействие различных
вещ-в друг с другом происходит в
соответствии с их эквивалентами.
Эквивалент
– это реальная или условная частица,
которая присоединяет или отдает один
протон в кислотно- основных реакциях,
а в ОВР принимает или отдает один
электрон. Число, показывающие, какая
часть молекулы или другой частицы вещ-ва
соответствует эквиваленту, называется
фактором
эквивалентности.
F(э)
=
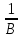 ,
где B-
валентность элементаf(э)(Cr)=
1/3
,
где B-
валентность элементаf(э)(Cr)=
1/3
F(э)
(для простого вещ-ва)=
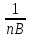 ,
где n-
число атомов элемента f(э)
(
,
где n-
число атомов элемента f(э)
( )=
)=

F(э)
(оксида)=
 ,
где B-
валентность металла или неметалла f(э)
(
,
где B-
валентность металла или неметалла f(э)
(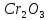 )=
)=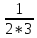 =
1/6
=
1/6
F(э)
(к-ты)=
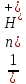 f(э)
(
f(э)
(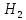 S
S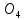 )=
½
)=
½
F(э)
(основания)=
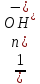 f(э)
(NaOH)=1/1
f(э)
(NaOH)=1/1
F(э)
(соли)=
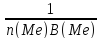 f(э)
f(э)
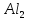 (S
(S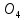 )3=
)3=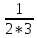 =1/6
=1/6
1. Электрон хотя и имеет заряд и ненулевую массу покоя, но обладает явно выраженными волновыми свойствами.
Длина
волны электрона может быть рассчитана
по ур-ю
Луи де Бройля:
λ=h/mν.
Она
легко выводится из формулы Планка
(E=hν)
и соотношения Эйнштейна
(E=m ),
если вместо c
подставить
ν.
),
если вместо c
подставить
ν.
Закон де Бройля (1924 г.): любая частица имеет корпускулярно- волновой характер движения.
В
1926 г. Э. Шредингер предложил описывать
движение микрочастиц с помощью ур-я,
кот. связывало энергию, координаты и
волновую
функцию(Ψ)
– величину, характеризующую св-ва
квантовой системы. У-е
Шредингера
яв-ся фундаментальным
у-ем
квантовой механики:
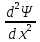 +
+
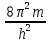 (E-U)
Ψ=0
(x
– расстояние, h
– постоянная Планка, E
– полная энергия, U
– потенциальная энергия частицы)
(E-U)
Ψ=0
(x
– расстояние, h
– постоянная Планка, E
– полная энергия, U
– потенциальная энергия частицы)
2.
Квантовое
число
– численное значение какой –либо
квантованной переменной микроскопического
объекта (элементарной частицы, ядра,
атома), характеризующее
состояние частицы.
Волновая
функция Ψ,
заданная тремя квантовыми числами:
главным n,
орбитальным l
и магнитным
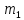 , называется атомной
орбиталью.
Главное
квантовое число n
равно номеру электронного ур-ня в атоме
и принимает значения 1,2,3, … или буквенные
значения K,
L, M, …; определяет
энергию ур-ня
при данном заряде ядра и соответствует
номеру периода
в периодической таблице Д. И. Менделеева.
, называется атомной
орбиталью.
Главное
квантовое число n
равно номеру электронного ур-ня в атоме
и принимает значения 1,2,3, … или буквенные
значения K,
L, M, …; определяет
энергию ур-ня
при данном заряде ядра и соответствует
номеру периода
в периодической таблице Д. И. Менделеева.
Орбитальное квантовое число l характеризует величину момента кол-ва движения электрона на орбитали; определяет форму орбитали и ее энергию в многоэлектронных системах. Определяет энергию электрона на энергетическом подуровне, номер подуровня, принимает значения от 0 до (n-1). Соответствующие буквенные обозначения: s при l=0, p при l=1, d при l=2, f при l=3.
Подуровни – это совокупность s-, p-, d-, f-орбиталей внутри данного у-я.
Магнитное
квантовое число
– целочисленная проекция
вектора l
на ось z,
отражающей направление
внешнего магнитного поля,
поэтому
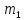 характеризует пространственную
направленность каждой орбитали.
характеризует пространственную
направленность каждой орбитали.
Спиновое
квантовое число.
Состояние
электрона
в атоме определяется
также проекцией
собственного
момента
кол-ва движения
(на ось z),
к-ое называется спиновым
квантовым числом
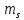 и может принимать
лишь два
значения +1/2
(когда направление вектора спина
совпадает с направлением внешнего
магнитного поля) и -1/2
(когда направления противоположны).
Условное
обозначение ↑↓.
Это число не связано с решением у-я
Шредингера.
и может принимать
лишь два
значения +1/2
(когда направление вектора спина
совпадает с направлением внешнего
магнитного поля) и -1/2
(когда направления противоположны).
Условное
обозначение ↑↓.
Это число не связано с решением у-я
Шредингера.
s-
орбитали
сферически
симметричны для любого n
и отличаются друг от друга только
размером сферы. Их максимально
симметричная форма обусловлена
тем, что при
l=0
и
 =0.
=0.
P-
орбитали
существуют при n
≥ 2 и l=1,
поэтому возможны три варианта ориентации
в пространстве:
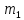 =-1,0,+1.
Все p-орбитали
обладают
узловой плоскостью,
делящей орбиталь на две области, поэтому
граничные поверхности имеют форму
гантелей, ориентированных в пространстве
под углом 90° друг относительно друга.
Осями
симметрии
для них яв-ся координатные
оси,
к-ые обозначаются
=-1,0,+1.
Все p-орбитали
обладают
узловой плоскостью,
делящей орбиталь на две области, поэтому
граничные поверхности имеют форму
гантелей, ориентированных в пространстве
под углом 90° друг относительно друга.
Осями
симметрии
для них яв-ся координатные
оси,
к-ые обозначаются
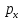 ,
,
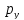 ,
,
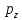 .
.
D-орбитали
определяются
квантовым числом l=
2 (n≥3),
при кот
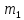 =
-2,-1,0,+1,+2, то есть характеризуются
пятью вариантами ориентации в пространстве.
D-
орбитали, ориентированные лопастями
по осям координат, обозначаются
=
-2,-1,0,+1,+2, то есть характеризуются
пятью вариантами ориентации в пространстве.
D-
орбитали, ориентированные лопастями
по осям координат, обозначаются
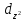 и
и
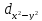 ,
а ориентированные лопастями по
биссектрисам координатных углов -
,
а ориентированные лопастями по
биссектрисам координатных углов -
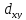 ,
,
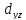 ,
,
 .
.
Семь f-орбиталей, соответствующих l=3 (n≥4), изображаются в виде граничных поверхностей.
3. Принцип Паули: в атоме не может быть двух электронов, у кот все четыре квантовых числа были бы одинаковыми.
Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при к-ом абсолютное значение суммарного спина атома максимально.
Правило Клечковского: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы.
4. Радиус атома- это расстояние от ядра атома до электронов, находящихся на последнем энергетическом уровне.
Энергия ионизации атома – кол-во энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому.
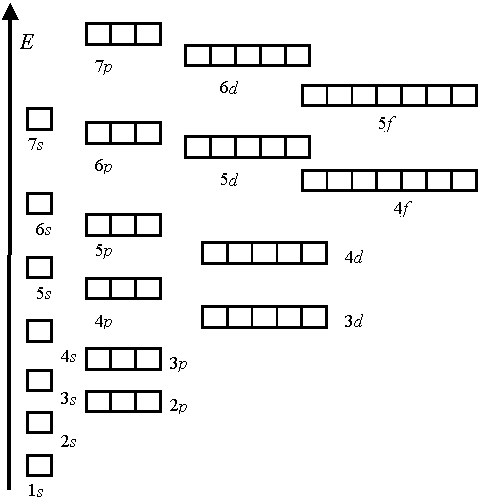
5. Современная формулировка периодического закона: свойства элементов, а также свойства и формы их соединений находятся в периодической зависимости от зарядов ядер атомов элементов.
Период – горизонтальную совокупность элементов, расположенных в порядке возрастания заряда ядра. Каждый период начинается s-элементом с конфигурацией внешнего электронного уровня ns1 и завершается p-элементом с конфигурацией внешнего электронного уровня ns2np6 (кроме первого периода, который заканчивается элементом гелием с конфигурацией внешнего электронного уровня 1s2). Номер периода определяется значением главного квантового числа внешнего электронного уровня.
Первые три периода (малые) состоят только из s- и p- элементов.
В составе больших четвёртого и пятого периодов появляются d- элементы, а в шестой и седьмой периоды входят f- элементы.
В связи с разным числом элементов в периодах в пределах малых периодов свойства элементов изменяются резко, в больших периодах – медленно.
Группа – совокупность элементов, расположенных в таблице вертикально в порядке возрастания заряда ядра.
В периодической системе имеется 8 групп. Каждая группа состоит из главной и побочной подгрупп.
В состав главных подгрупп входят только s- или p- элементы (элементы малых и больших периодов), а побочных – d- и f- элементы (элементы больших периодов, f- элементы вынесены в отдельные строки внизу таблицы).
Атомы элементов одной подгруппы являются полными электронными аналогами, т.е. распределение внешних валентных электронов по уровням у них полностью совпадает (за немногими исключениями, например, конфигурация внешнего электронного уровня Nb – 5s14d4 вместо 5s24d3 у остальных элементов побочной подгруппы V группы). Атомы элементов группы в целом не являются полными электронными аналогами.
Рассматривая связь между электронной конфигурацией элемента и его положением в пс, можно сделать некоторые обобщения: 1. Начало каждого периода совпадает с началом образования нового электронного слоя. 2. Элементы главных и побочных подгрупп отличаются характером заполняемых орбиталей. В атомах элементов главных подгрупп идет заполнение s- и p- орбиталей с главным квантовым числом равным номеру периода (s- и p-элементы). В атомах элементов побочных подгрупп идет заполнение (n-1)d- или (n-2)f-орбиталей. Основное отличие элементов побочных подгрупп (d- и f-орбиталей) от элементов главных подгрупп состоит в том, что в атомах этих элементов заполняется не внешний электронный слой, а предшествующие ему, причем заполнение d-орбиталей опаздывает на один период, а f- орбиталь заполняется с опозданием на два периода.
6. Величины радиусов закономерно увеличиваются в группах элементов в направлении сверху вниз. С увеличением порядкового номера элемента внутри периода радиусы уменьшаются по горизонтали слева направо к середине периода, а затем вновь увеличиваются. В периодах слева направо энергия ионизации атомов увеличивается. В группах сверху вниз энергия ионизации уменьшается. В периоде от начала к концу сродство к электрону увеличивается, а в группах увеличение идет в направлении снизу вверх. Электроотрицательность в периоде увеличивается, а в группе уменьшается. В группе металлические св-ва усиливаются, а в периоде ослабевают. В группе неметаллические св-ва ослабевают, а в периоде усиливаются. В группе основные св-ва высшего оксида и гидроксида усиливаются, а кислотные ослабевают. В периоде кислотные св-ва усиливаются, а основные ослабевают.
7. Переходные элементы — элементы побочных подгрупп ПС, в атомах к-ых появляются электроны на d- и f-орбиталях. Все переходные элементы имеют следующие общие свойства: 1.Небольшие значения электроотрицательности. 2. Переменные с.о. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2. 3. Начиная с d-элементов III группы ПС, элементы в низшей степени окисления образуют соединения, к-ые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные.
4. Для всех переходных элементов характерно образование комплексных соединений.
Металлы — группа элементов, обладающих характерными металл св-вами. Основные свойства металлов: твердые (кроме ртути); блестят; хорошие электро- и теплопроводники; пластичные; ковкие; легко отдают электроны. Неметаллы — химические элементы с типично неметаллическими свойствами. Свойства неметаллов прямо противоположны свойствам металлов: плохие проводники тепла и электричества; хрупкие; нековкие; непластичные; обычно принимают электроны.
8. Хим связь – связь, возникающая при вз-ии двух или более атомов, приводящим к снижению полной энергии системы. Энергия связи – кол-во энергии, выделяющееся в результате образования одинарной связи. Энергия связи выражается в КДж/моль и для одинарной связи составляет порядка 400. Рассчитывают энергию связи с помощью закона Гесса на основе энтальпии реакций, при к-ых образуется или разрывается изучаемая связь.Поляризуемость связи - это ее способность становится более полярной под действием внешнего электрического поля. Длина связи – расстояние между ядрами атомов в молекуле. Измеряется в нанометрах. Длину связи определяют экспериментально с помощью молекулярной спектроскопии, рентгеноструктурного анализа и другими физ методами. Устойчивость молекул, как правило, растет с уменьшением длины связи и увеличением ее энергии. Валентный угол - угол между линиями двух связей одного и того же атома. Единица измерения – градус. Валентные углы зависят от природы атомов и характера хим связи.
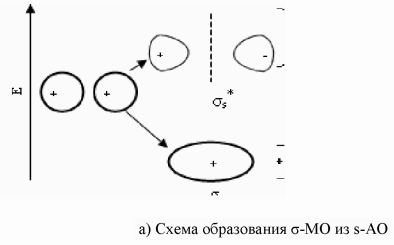
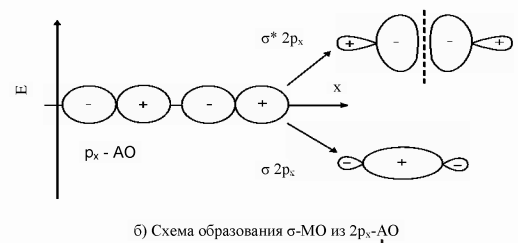
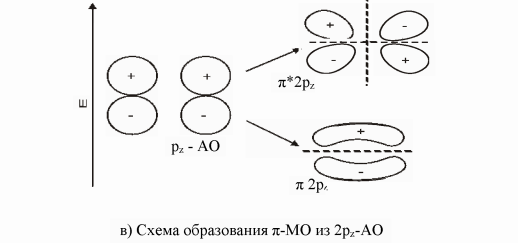
9. Согласно МВС связь образуется при перекрывании электронных орбиталей двух атомов и объединении двух электронов – возникает двухэлектронная, двухцентровая связь. Известны два механизма образования такой связи: либо оба атома предоставляют в общее пользование по одному электрону, либо один атом (донор) предоставляет пару электронов, а другой (акцептор) –пустую орбиталь (донорно-акцепторный механизм). Результат один и тот же: две орбитали перекрываются, и на них находятся два электрона. Например, в иона аммония три связи H-N образованы перекрыванием одноэлектронных облаков, а четвертая – по донорно-акцепторному механизму. В результате все четыре связи неразличимы и равноценны. В МВС ковалентная связь характеризуется насыщаемостью, поляризуемостью и направленностью. Насыщаемость - фундаментальное св-во ограниченного заполнения атомных орбиталей передается и ковалентной связи и в этом проявляется ее насыщаемость. Направленность - это св-во определяется способностью орбиталей к максимальному перекрыванию по определенным направлениям. Поляризуемость. Если связь образована двумя одинаковыми атомами, то электроны в равной степени принадлежат обоим атомам и молекула неполярная. В том случае, когда связь образована двумя разными атомами, электронная плотность смещена в сторону более электроотрицательного атома. Такая связь называется полярной. σ- связью называют хим связь, образующуюся при перекрывании электронных облаков вдоль линии связи. Между двумя атомами в молекуле возможно только одна σ- связь. Причем связи, образованные s- орбиталями, всегда яв-ся σ- связями. При образовании π-связи перекрывание электронных облаков происходит перпендикулярно линии связи, поэтому s-орбитали никогда не образуют π-связи. π-связи слабее Ϭ- связей, так как при π-связывании достигается меньшая степень перекрывания атомных орбиталей. Гибридизация – смещение орбиталей по энергии и форме. С позицией теории Полинга гибридизация валентных орбиталей центрального атома – это перераспределение энергии между неравноценными орбиталями, учавствующими в образовании σ- связывании, с образованием такого же числа равноценных между собой гибридных орбиталей имеющих одинаковую форму и энергию. Гибридные орбитали имеют большую вытянутость по одну сторону от ядра и ориентированы в пр-ве так, что оказываются максимально удаленными друг от друга. Это обеспечивает им наиболее полное перекрывание с орбиталями соседних атомов и минимальную энергию отталкивания. Поэтому хим связи, образованные гибридными облаками, оказываются прочнее обычных, а молекулы устойчивее. Sp- гибридизация возникает при образовании атомом двух связей за счет электронов, находящихся на s- и p-орбиталях и обладающих близкой энергией. Этот тип гибридизации характерен для молекул типа AB2 и ее геометрия всегда линейная, валентный угол =180° (CO2).Sp2-гибридизация имеет место в частицах состава AB3, геометрия молекулы плоская треугольная под углом 120°. (SO3) Sp3-гибридизация образует тетраэдр свойственно молекулами типа AB4 (CH4). Sp3d-гибридизация характерна для молекул типа AB5 и ее геометрия тригональная бипирамида(PF5). Sp3d2 – гибридизация характерна для молекул типа AB6 и ее геометрия октаэдр (SF6). Модель Гиллеспи основывается на предположении о том, что связь осуществляется за счет пары электронов, а геометрическое строение молекул или ионов определяется общим числом электронных пар, окружающих центральный атом. При этом должны выполняться следующие правила: 1. Электронные пары поделенные и неподеленные располагаются вокруг центрального атома так, чтобы их отталкивание было минимальным, т.е. на максимальном удалении друг от друга. 2. Неподеленная электронная пара занимает больший объем, чем поделенная. 3. Объем, занимаемый связывающей электронной парой, тем меньше, чем больше электроотрицательность атома, связанная с центральным. 4. Две электронные пары двойной связи занимают больший объем, чем одна электронная пара одинарной связи. Метод Гиллеспи весьма ограничен и достаточно хорошо описывает лишь строение молекул и ионов p-элементов с большим кол-вом одинарных связей, например, межгалогенных соединений и галогенидов благородных газов. К недостаткам модели Гиллеспи относятся: 1. Неприменимость к большинству соединений d- и s-элементов. 2. Неприменимость к соединениям с существенной долей ионности связи. 3. Невозможность предсказать геометрию молекул и ионов с «инертной» неподеленной электронной парой. 4. Неспособность объяснить строение частиц, содержащих электроны на разрыхляющих орбиталях.
10. Теория, использующая представление о молекулярных орбиталях для расчета различных характеристик молекул, была названа методом молекулярных орбиталей (ММО). В ее развитии особая заслуга принадлежит Малликену и Гунду. ММО исходит из предположения, что при образовании хим связей электроны с АО переходят на новые энергетические у-и, называемые МО. Каждой МО соответствует волновая функция Ѱ, характеризующая область наиболее вероятного пребывания электронов определенной энергии в молекуле. С точки зрения квантовой механики, электроны в молекулах делокализованы, совершают движение по всей молекуле, а не в пределах одного атома, и на них действуют одновременно несколько ядер. Это приводит к уменьшению энергии электронов при переходе с АО на МО, следовательно, процесс заполнения МО оказывается энергетически выгодным. Заполнение электронами МО происходит по тем же законам, что и атомных. МО обозначаются буквами греческого алфавита (σ,π,Ϭ,ϕ). При сложении АО образуется связывающая МО, а при вычитании – разрыхляющая. Электроны, находящиеся на связывающих МО, имеют энергию меньшую, чем на атомных, они связывают ядра атомов. Электроны, находящиеся на разрыхляющих МО, имеют энергию большую, чем на атомных, и, следовательно, ослабляют связь между двумя атомами.
Хим связь между двумя атомами возникает при соблюдении следующих условий: 1) комбинируемые АО должны быть близкими по энергии; 2) АО, образующие МО, должны перекрываться; 3) обе перекрываемые АО должны быть расположены симметрично относительно межъядерной оси.
11. Хим связь между ионами, осуществляемая электростатическим притяжением, называется ионной. Ионы можно представить в виде электрических зарядов шаровой симметрии, притяжение между к-ми определяется по закону Кулона. Любая ионная связь содержит доля ковалентности, причем чем больше разность электроотрицательности атомов, тем выше степень ионности и ниже доля ковалентности. Основными св-ми ионной связи яв-ся не направленность и ненасыщаемость. Ионы образуют силовое поле, близкое к сферически симметричному, поэтому силы притяжения не будут зависеть от относительного положения ионов. В этом проявляется не направленность. Вз-ие ионов противоположного знака не приводит к компенсации силовых полей, у них остается способность притягивать ионы противоположного знака по другим направлениям. В этом проявляется не насыщаемость. Ионные соединения состоят из отдельных молекул только в парообразном состоянии. В кристаллическом состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют. Кристалл в целом представляет гигантскую молекулу, состоящую из таких ионов. Соединения с ионным типом связи – это прочные твердые кристаллы с высокой температурой плавления. Расплавы содержат ионы и яв-ся проводниками. Энергия ионной связи высока – до 1000 кДж/моль.
12. Металлы кристаллизуются в форме металлических решёток. Узлы в металлической решётке заняты положительными ионами металлов. Валентные электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической решётки ионы, более или менее свободно перемещаются в пространстве между катионами и обуславливают электрическую проводимость металлов. Между ионами и свободными электронами возникают электростатические вз-ия, к-ые и яв-ся причиной возникновения металлической связи.Металлическая связь имеет сходство как с ионной (образуется за счёт вз-ия между заряженными частицами: электронами и ионами), так и с ковалентной (происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом. Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило возрастает с увеличением числа валентных электронов в их атомах.
13. Ван-дер-ваальсовы силы имеют электростатическую природу, но относятся к слабым вз-ям (энергия = 8-20 кДж/моль) Суммарная энергия ван-дер-ваальсового вз-ия молекул на 1-2 порядка ниже энергии хим связей. Это вз-ие проявляется на значительно больших расстояниях, чем хим, и характеризуется отсутствием насыщаемости и направленности. Водородной называется связь между двумя электроотрицательными элементами, принадлежащими разным молекулам, посредством атома водорода, соединенного с одним из них хим связью. Атом водорода, связанный с сильно электроотрицательным атомом, в значительной степени поляризован. Состояние атома водорода приближается к состоянию протона, обладающего уникальными св-ми. Он не имеет электронной оболочки и потому испытывает только притяжение к другим атомам. К тому же протон очень мал и может внедряться в электронные оболочки других атомов. Таким образом, водородная связь имеет электростатический характер. По величине энергии она яв-ся промежуточной между ван-дер-ваальсовыми силами и донорно-акцепторным вз-ем, энергия водородной связи составляет 20-150 кДж/моль.
14. Хим термодинамика – раздел физ химии, в к-ом термодинамические методы применяяются для анализа хим явлений: хим реакций, фазовых переходов и процессов в р-рах. Объект изучения термодинамики – термодинамические системы, т.е. макроскопические объекты, отделенные от окружающего пространства реальной или мысленной поверхностью. Системы бывают: открытые, где существует обмен энергией и вещ-ом с окружающей средой; закрытые, где существует обмен энергии, но нет с вещ-вом; изолированные, в к-ых нет обмена с окружением ни энергией, ни вещ-ом. Состояние системы описывают с помощью макроскопических параметров, например, температуры, давления, объема и т.д., а также с использованием термодинамических функций, зависящих от параметров. Функция состояния – величина, значение к-ой зависит только от состояния системы и не зависит от способа достижения этого состояния. Функция перехода – величина, значение к-ой зависит от пути по к-ому происходит изменение системы. Энергия – это такая хар-ка движения и вз-ие тел, к-ое связано с их способностью совершать изменения в состоянии системы и внешней среды. Работа – энергия, передающаяся за счет упорядоченного движения большого числа элементов системы или окр среды. Теплота – энергия, передающаяся за счет хаотического движения элементов системы и окр среды. Хим равновесие – такое состояние хим системы, при к-ом кол-ва исходных вещ-в и продуктов не меняются со временем. Термодинамическими называются такие процессы с участием макроскопических систем, при к-ых начальное и конечное состояние систем яв-ся термодинамическим. Обратимый процесс – термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окр среде остались какие- либо изменения. Необратимый процесс – термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окр среде остались к-л изменения. Самопроизвольный процесс – процесс, происходящий без внешних воздействий. Э
