
Sovremennaya_khimia_predstavlyaet_soboy_sistemu_nauchnykh_distsiplin_vklyuchaya_v_sebya_obschuyu
.docx-
Амфотерные электролиты дисс-т в вод растворе по типу кислоты и по типу основания. К ним относятся: Al(OH)3, Zn(OH)2, Cr(OH)3, Pb(OH)2
-
Вода
36. константа автопротолиза. Понятие о рН.
Многие растворители в очень небольшой степени ионизированы, те 2 молекулы р-ля реагируют друг с другом, образуя ионы противоположного заряда. Это явление называется автопротолизом.



В
случае автопротолиза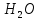 ,
образующийся положительный ион называется
ионом гидроксония
,
образующийся положительный ион называется
ионом гидроксония
Константа
автопротолиза :
:
При
25 значение постоянно и равно 1*
значение постоянно и равно 1*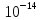
pKw=-lg
В
1909г было предлож обознач конц водород.
и гидроксидн. ионов в виде рН и рОН.
рН=-lg[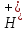
В
р-рах сил. кислот:
В
р-рах сил. осн:



37. Теория Льюиса.
Основывается
на рассмотрении электронного строения
частиц и не считает наличие
 обязательным признаком кислоты. По
Льюису, кислоты- частицы с незаполненной
внешней электронной оболочкой, а
основание – это частицы со свободной
парой электронов. Таким образом, L-
кислоты, выступают как акцепторы
электронов, а L-основание-
как доноры.Во время взаимодействия
происходит обобществление электронной
парой основания, что отличает р-ции
кислотно-основного взаимодействия от
р-ции окисления -восстановления, в
которых окислитель забирает электроны
восстановителя B
обязательным признаком кислоты. По
Льюису, кислоты- частицы с незаполненной
внешней электронной оболочкой, а
основание – это частицы со свободной
парой электронов. Таким образом, L-
кислоты, выступают как акцепторы
электронов, а L-основание-
как доноры.Во время взаимодействия
происходит обобществление электронной
парой основания, что отличает р-ции
кислотно-основного взаимодействия от
р-ции окисления -восстановления, в
которых окислитель забирает электроны
восстановителя B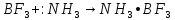 Такое
слишком сильное расширение понятий
кислот и оснований является одним из
недостатком теории Льюиса, кроме того
классификация поставлена в тесную
зависимость от взглядов на природу
химической связи.
Такое
слишком сильное расширение понятий
кислот и оснований является одним из
недостатком теории Льюиса, кроме того
классификация поставлена в тесную
зависимость от взглядов на природу
химической связи.
38. буферные растворы. Понятия. Примеры. Расчет рН для буферных растворах
Буферные
р-ры
– р-ры,содержащие смеси слабых к-т и
осн-й. (Пр-р:СН3СЩЩН
и СН3СООNа).
Готовят для поддержания пост знач-я рН
в р-ре, связ. с выдел-м или поглащ-м Н+.
не изменяют знач-е рН при разбавлении
или при добавлении сил.к-т или осн-й.
Вычисление рН: К= ,предположим
Ск=
,предположим
Ск= ,
, =Сосн,подставляем
знач-я в Кк-ты:
КНА=
=Сосн,подставляем
знач-я в Кк-ты:
КНА=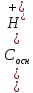 =>
=>
 .
Прологарифмируем: рН=рКНА+lg
.
Прологарифмируем: рН=рКНА+lg
39. окислительно-восстановительные реакции. Основные понятия. Элемент Даниеля. Гальванический элемент, электролитическая ячейка. Электродный потенциал
О/В
реакция
(окислительно-восстановит)-сумма 2х
полуреакций, одна из которых отражает
процесс превращения окислителя до
восстановителя.
Характерная особ-ть:
передача электронов между частицами
(окс-ль принимает
 ,
восст-ль отдает
,
восст-ль отдает
 Гальвани́ческий элеме́нт —
химический источник электрического
тока, основанный
на взаимодействии двух металлов и/или
их оксидов в электролите,
приводящем к возникновению в замкнутой
цепи электрического
тока.Полуэлемент
– каждый из сосудов, содержащий компоненты
реакций. Гальвонический элемент
отличается от электролитической ячейки,в
кот о/в реакция самопроизвольно протекает
в обратном направлении. А в прямом
– под воздействием внешних сил.
Гальвонический элемент(элемент Даниэля):
ОВР протекает самопроизвольно
Электролитическая ячейка: ОВР идет в
направлении, обратном самопроизвольному.
Электродвижущая сила гал. эл-та –
разность потенциалов для 2х полуэл-в
(измеряется потенциометром): Е=Еок–
Евос
Гальвани́ческий элеме́нт —
химический источник электрического
тока, основанный
на взаимодействии двух металлов и/или
их оксидов в электролите,
приводящем к возникновению в замкнутой
цепи электрического
тока.Полуэлемент
– каждый из сосудов, содержащий компоненты
реакций. Гальвонический элемент
отличается от электролитической ячейки,в
кот о/в реакция самопроизвольно протекает
в обратном направлении. А в прямом
– под воздействием внешних сил.
Гальвонический элемент(элемент Даниэля):
ОВР протекает самопроизвольно
Электролитическая ячейка: ОВР идет в
направлении, обратном самопроизвольному.
Электродвижущая сила гал. эл-та –
разность потенциалов для 2х полуэл-в
(измеряется потенциометром): Е=Еок–
Евос
40. стандартный электродный потенциал . стандартный водородный электрод. Уравнение Нернста.
Стандартный
водородный электрод – электрод из
платинированной платины, покрытой
электролитическим способом платиновой
чернью и омываемой газообразным водородом
при давлении=1 атм. и погружен. В р-р
кис-ты с активностью=1. Потенциал
стандартного водород.эл-да = 0 при всех
температурах. Зависимость о/в потенциала
редокс-пары от концентрации и тмемпературы
описывается уравнением
Нернста:
Е=Е0+ ln
ln (R-универс.газ.пост,
-пост. Фарадея, n-число
(R-универс.газ.пост,
-пост. Фарадея, n-число
 ,
принимающий участие в полуреакции,
Е0-станд.
о/в потенциал данной редокс-пары)
Стандартный о/в потенциал (Е0)
– потенциал сис-мы, в кот.все участники
полуреакции находятся в станд. состоянии.
Характеризует ЭДС электрохимической
цепи, в кот. на катоде протекает дан.
полуреакция , анод –станд. водород.
электрод =>станд. электрод. потенциал
соответствует полуреакции восстановления.
Е0ок/вос>0
– ОВР идет самопроизвольно в прямом
направлении; Е0ок/вос<0
– ОВР идет самопроизвольно в обратном
направлении
,
принимающий участие в полуреакции,
Е0-станд.
о/в потенциал данной редокс-пары)
Стандартный о/в потенциал (Е0)
– потенциал сис-мы, в кот.все участники
полуреакции находятся в станд. состоянии.
Характеризует ЭДС электрохимической
цепи, в кот. на катоде протекает дан.
полуреакция , анод –станд. водород.
электрод =>станд. электрод. потенциал
соответствует полуреакции восстановления.
Е0ок/вос>0
– ОВР идет самопроизвольно в прямом
направлении; Е0ок/вос<0
– ОВР идет самопроизвольно в обратном
направлении
41. связь константы равновесия со стандартными потенциалами. Факторы, влияющие на направление ОВР
Уравнение
Нернста: Е=Е0+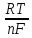 lnКa
отражает связь константы равновесия
со стандартным потенциалом
lnКa
отражает связь константы равновесия
со стандартным потенциалом
Е – стнадартный потенциал Ка – константа равновесия
Факторы, влияющие на глубину протекания ОВР: 1. Природа реагирующих веществ. 2. Активность (концентрация) всех веществ, присутствующих в системе. 3. Температура раствора. 4. Кислотность раствора (pH). 5. Образование малорастворимых веществ. 6. Образование комплексных соединений. 7. Природа растворителей.
42. электролиз. Электрохимические источники энергии.
Электролиз – совокупность о/в процессов, протекающих при прохождении электрич. тока серез р-р или расплав электролита, в который погружены электроды. При электролизы энергия электрического тока превращается в химическую.
|
Электролиз расплавов |
Электролиз вод.р-ров |
|
На катоде протекает процесс восстановления, на аноде- окисления |
Осложняется: в электродном процессе участвуют молекулы воды, кот.способны восст-ся на катоде и ок-ся на аноде |
43. скорость химической реакции, ее зависимость от природы и концентрации реагентов, температуры. Порядок и молекулярность реакции.
Скорость хим. Р-ции равна изменению концентраций реаг-их в-в в единицу времени в единице реакционнного пространства. Скорости гомогенной гетерогенной реакции существенно различаются.Различают скорость среднюю и истинную, которая для гомогенной реакции выражается след.,ур.


 используются
для того что бы скорость реакции всегда
была+
используются
для того что бы скорость реакции всегда
была+
. Большинство хим реакций проходят через ряд промежуточных стадий которые называются элементарными стадиями.
Послед., элементарных стадий хим реакции называют ее механизмом. Число частиц учавст., в элементарном хим акте называют его молекулярностью. Различают одно двух и трем молек., реакции. К одно молекулярным реакциям относят р-и типа A=B, A=B+C то есть распады молекул на более простые состав., части. Двум молекулярные реакции типа A+B=C, 2A=B. Значительно реже встречаются 4,5 и выше молек., реакцииДля 3 молек., реакции 3A=B, A+2B=C
В большинстве случаев молек., определяется эксперементально.
При протекании хим., реакции необходимым условием взаимодействия веществ явлсясталкновение частиц, причем число таких столкновений в ед., времени пропорционально концентрации реагирующих веществ. На основании этого был устан., закон действующих масс Гульдбери И ВААГЕ:припост., температуре скорость хим., реакции прямо пропорционально произведению концентрации реагирующих веществ. Уравнение показывающие зависимость скорости реакции от концентрации называются кинетическим. Для любой элементарной стадии гомогенной реакции скорость будет прямо пропорциональна произведению концентрации реагентов в степенях = стехиометрических коэфицентам в уравнении реакции для этой элементарной стадии
44.константа скорости и ее зависимость от температуры. Уравнение Аррениуса. Энергия активации
.
Зависимость скорости р-ции
от t(
в широк. Интервал t-ур)
опред-ся по ур-нию Аррениуса: (K
– конст. ск-ти, А- число соудар-ий,
e-экспоненты):
чем меньше энерг. активации, тем
большескор-тьр-ии. Сильная зависимость
скорости р-ции от t
- резкое возрастание числа успешных
столкновений, α заканчиваются образованием
продуктов р-ции
(K
– конст. ск-ти, А- число соудар-ий,
e-экспоненты):
чем меньше энерг. активации, тем
большескор-тьр-ии. Сильная зависимость
скорости р-ции от t
- резкое возрастание числа успешных
столкновений, α заканчиваются образованием
продуктов р-ции
Энергия активации- это min энергия, кот. должны облад. реаг. Частицы, чтобы столкновение м/у ними привело к р-ции
45. понятия о механизме реакций в гомогенных и гетерогенных системах.
Механизм реакции - последовательность элементарных стадий в химической реакции. 1) гомогенные р-ии–реакции, протекающ. в однородной среде, 2) гетерогенные р-ии –р-и, протекающ. на поверхности раздела двух фаз. Возможны р-ии, в кот.все реагенты находятся в твер. фазе. В гет. р-ях важную роль играет скорость диффузии реаг-в и прод-в р-ии в направлении поверхности раздела фаз и в направлении от этой поверхности.
46. понятие о катализе. Роль и механизм действия катализатора.
Катализ – явление изменения скорости хим. Р-ции подвоздействием катализатора. Катализатор – нерасходуемый
реагент, ускоряющий хим. Р-ции. Р-ции, протекающие с участиемкатализатора-каталитические. Если в присутствии катализатора
скорость р-ции увел-ся, то катализ положительный, если уменьшается-отрицательный, а такой катализатор наз-ют ингибитором. Если катализатор один из продуктов р-ции, то р-цииавтокаталитические.Само явление автокатализ. Общие законом-ти катализа:1) катализатор активно учав-ет в элементар. Акте р-ции,образуя промежуточные соед-ния с одним из участников р-ции, но при этом после каждого хим. Акта он регенерируется может вступать в новые взаим-вия. 2) Дей-виекатализт. Сводится к уменьшению энергии активации. 3) катализатор не влияет на положениетермодин.равновесия, но ускоряет его в одинаковой степени изменяя константы прямой и обратной р-ции. Катализ бываетгомог., гетероген.Пригомог. Катализатор и все реаг-щие в-ва находятся в одной фазе( в жидк.), при гетерог. Взаим-виепроисходит на границе раздела фаз либо тв. И жидк., либо тв и газообр
