
- •Федеральное агентство по образованию
- •Растворимость. Способы выражения состава растворов Краткие теоретические сведения
- •Примеры решения задач
- •156, 2 Г раствора — 100,0 г н2о;
- •50,0 Г раствора — m1 г н2о;
- •1 Моль (278 г) FeSo4 ·7h2о содержит 1 моль (152 г) FeSo4 ;
- •50 Г FeSo4 ·7h2о содержит m2 г FeSo4 ;
- •Разбавленные растворы неэлектролитов Краткие теоретические сведения
- •Примеры решения задач
- •Растворы электролитов Краткие теоретические сведения
- •Примеры решения задач
- •Ионное произведение воды. Буферные растворы Краткие теоретические сведения
- •Примеры решения задач
- •Произведение растворимости Краткие теоретические сведения
- •Выражение для произведения растворимости имеет вид
- •Примеры решения задач
- •Гидролиз солей Краткие теоретические сведения
- •Примеры решения задач
- •Список литературы
- •Содержание
Примеры решения задач
Пример 1. Вычислите давление насыщенного пара над раствором, содержащим 6,4 г нафталина (С10Н8) в 90 г бензола (С6Н6) при 20 °С. Давление насыщенного пара над чистым бензолом при данной температуре возьмите в справочнике.
Р е ш е н и е
Определим молярные массы нафталина (растворенное вещество) и бензола (растворитель)
М2(С10Н8) = 128 г/моль; М1(С6Н6) = 78 г/моль.
По формуле (8) определяем мольную долю нафталина в растворе
![]() .
.
Из справочника
[8] при 20 °С для чистого бензола Р ![]() = 9953,82 Па. Тогда, из формулы (13) выразим
давление насыщенного пара над раствором
= 9953,82 Па. Тогда, из формулы (13) выразим
давление насыщенного пара над раствором
![]() .
.
Пример 2. Вычислите температуру кипения и температуру замерзания водного раствора фруктозы с массовой долей 5 % масс.
Р е ш е н и е
Поскольку массовая доля фруктозы равна 5 % масс., это значит, что в 100 г раствора содержится 5 г растворенного вещества и 95 г воды. Молярная масса фруктозы С6Н12О6 равна М2 = 180 г/моль. Тогда, по уравнению (3) моляльная концентрация раствора равна
![]() .
.
Из справочника для растворителя выбираем
КЭ(Н2О) = 0,52 (К·кг/моль); а КК(Н2О) = 1,86 (К·кг/моль).
По формуле (14) определяем изменение температуры кипения
DTкип = КЭ × Сm = 0,52 0,292 = 0,152 С.
По формуле (15) определяем изменение температуры замерзания
DTзам = КК × Сm = 1,86 0,292 = 0,543 С.
Чистая вода кипит при 100°С и замерзает при 0 °С,а раствор глюкозы кипит при более высокой температуре, замерзает при более низкой
![]() °С;
°С;
![]() °С.
°С.
Пример 3. Рассчитайте осмотическое давление 20 %-ного водного раствора глюкозы (плотность раствора ρ = 1,08 г/мл = 1080 г/л) при 310 К, применяемого для внутривенного введения при отеке легкого. Каким будет этот раствор гипо-, гипер- или изотоническим по отношению к крови, если учесть, что Росм крови лежит в пределах 740 – 780 кПа?
Р е ш е н и е
Для определения осмотического давления необходимо перейти от процентной концентрации к молярной. Молярная масса глюкозы С6Н12О6 равна М2 = 180 г/моль. Тогда, по уравнению (4) молярная концентрация раствора равна
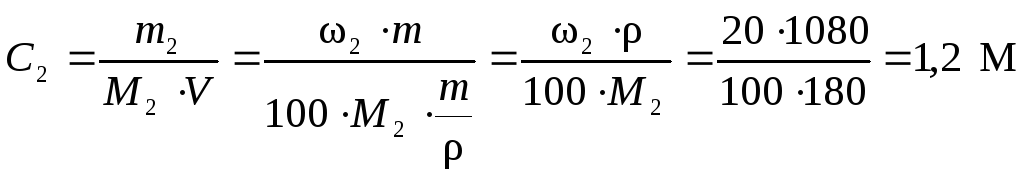 .
.
По закону Вант-Гоффа (уравнение (18))
Росм = 1,2 8,314 310 = 3093 кПа.
Поскольку 3092,81 кПа > Росм(крови), то 20 %-ный раствор глюкозы является гипертоническим по отношению к крови.
Пример 4. Определить массу глюкозы С6Н12О6 , которую должен содержать 1 дм3 раствора, чтобы быть изотоничным раствору, содержащему в 1 дм3 9,2 г глицерина С3Н8О3.
Р е ш е н и е
Определим молярную концентрацию глицерина по формуле (4)
С2(С3Н8О3)
=![]() =
=![]() =0,1 моль/дм3.
=0,1 моль/дм3.
При одинаковой температуре изотоничными будут растворы с одинаковой молярной концентрацией неэлектролита. Следовательно, масса глюкозы будет равна
m2(С6Н12О6) = С2(С3Н8О3) × M2(С6Н12О6) × V;
m2(С6Н12О6) = 0,1 моль/дм3 × 180 г/моль × 1 дм3 = 18 г.
Пример 5. При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,24. Вычислить молекулярную массу растворенного вещества.
Р е ш е н и е
По формуле (17)
M2
= KК
![]() .
.
Растворы электролитов Краткие теоретические сведения
Электролитами называют вещества, которые в растворе или расплаве полностью или частично распадаются на ионы. Сила электролита определяется степенью диссоциации , которая равна отношению числа молекул, распавшихся на ионы N, к общему числу растворенных молекул Nобщ, доли единицы или %
=
![]() 100
%
.
(19)
100
%
.
(19)
По величине степени диссоциации электролиты делят на сильные ( > 0,3) и слабые ( < 30 %).
Расчет концентраций ионов для слабого электролита следует вести по формуле
[ион] = n C2 , (20)
где n – число ионов данного сорта, образующихся при диссоциации одной молекулы.
Для сильного электролита степень диссоциации практически равна 1 и формула (20) принимает вид
[ион] = nC2 . (21)
Для слабых электролитов процесс диссоциации является обратимым и характеризуется константой равновесия, которая называется константой диссоциации КД(иначе константой ионизации).KДхарактеризует способность электролита распадаться на ионы: чем меньше константа диссоциации, тем слабее электролит и тем в меньшей степени его молекулы диссоциированы на ионы. Она не зависит от концентраций электролита и ионов, а зависит от природы электролита и температуры. Значения констант диссоциации для большинства электролитов содержаться в справочниках.
Для электролита, распадающегося на ионы по схеме
(Kt)х(Аn)у xKtz+ + yАnz–
выражение для константы диссоциации имеет вид
 ,
(22)
,
(22)
где Ktz+,Аnz–,(Kt)x(Аn)y– равновесные концентрации катиона, аниона и недиссоциированных молекул, моль/дм3.
Для бинарного электролита, то есть для электролита, дающего при диссоциации одной молекулы два иона по уравнению
KtАn Ktz+ + Аnz–
между KД и существует количественная зависимость (закон разбавления Оствальда)
![]() .
(23)
.
(23)
Для растворов очень слабых электролитов << 1 и (1 – ) 1, тогда формула (23) примет вид
KД = 2 С2 . (24)
Отсюда
=
![]() . (25)
. (25)
Для слабых электролитов, для которых из одной молекулы образуется более двух ионов, процесс диссоциации протекает ступенчато. Например, для ортофосфорной кислоты:
Н3РО4
Н+
+ Н2РО![]() ,
KД
1 = 7,110–3,
1
= 27 % – для I
ступени;
,
KД
1 = 7,110–3,
1
= 27 % – для I
ступени;
Н2РО![]()
Н+
+ НРО
Н+
+ НРО![]() ,
KД
2 = 6,210–8
, 2
= 0,15 % – для II
ступени;
,
KД
2 = 6,210–8
, 2
= 0,15 % – для II
ступени;
НРО![]()
Н+
+ РО
Н+
+ РО![]() ,
KД
3 = 5,010–13,
3
= 0,005 % – для III
ступени.
,
KД
3 = 5,010–13,
3
= 0,005 % – для III
ступени.
Константа диссоциации суммарного процесса равна произведению констант диссоциации по всем ступеням:
Н3РО4
3Н+
+ РО![]() ,
KД
= KД
1
KД
2
KД
3 = 2,2
10–22.
,
KД
= KД
1
KД
2
KД
3 = 2,2
10–22.
В растворах сильных электролитов в результате их практически полной диссоциации создается высокая концентрация ионов.
Для учета взаимодействия между ионами в растворе сильного электролита введено понятие «активность». Активность – это эффективная концентрация ионов, в соответствии с которой ионы проявляют себя в химических реакциях. Концентрация и активность ионов а связаны соотношением
а = [ион] , (26)
где – коэффициент активности иона.
В сильно разбавленных растворах сильных электролитов 1, и следовательно а = [ион].
Активность электролита (Kt)х(Аn)у можно оценить по формуле
а2
=
![]() ,
(27)
,
(27)
где а – средняя ионная активность электролита; – средний ионный коэффициент активности; С – средняя ионная молярная или моляльная концентрации; = (х + у) – сумма числа катионов х и числа анионов у, образующихся при диссоциации одной молекулы электролита.
Средняя ионная активность а и средний ионный коэффициент активности связаны с активностями и коэффициентами активности катионов и анионов соотношениями
а
=
![]() ,
(28)
,
(28)
=
![]() .
(29)
.
(29)
Среднюю ионную концентрацию электролита следует оценивать по формуле
С
=
![]() ,
(30)
,
(30)
В разбавленных растворах электролитов средний ионный коэффициент активности можно вычислить по уравнению (предельный закон Дебая-Гюккеля)
lg
= – 0,5
![]()
![]()
![]() ,
(31)
,
(31)
где
![]() ,
,![]() – заряды ионов; I
– ионная сила раствора.
– заряды ионов; I
– ионная сила раствора.
По уравнению Дебая-Гюккеля можно вычислять и коэффициенты активностей отдельных ионов, при этом формула (31) примет вид
lg
+
= – 0,5
![]()
![]() ,
(31 а)
,
(31 а)
lg
–
= – 0,5
![]()
![]() ,
(31 б)
,
(31 б)
Ионной силой раствора I называют полусумму произведения молярных или моляльных концентраций каждого иона на квадрат его заряда
![]() .
(32)
.
(32)
Наличие взаимодействия между ионами в растворах сильных электролитов приводит к тому, что найденная экспериментально степень диссоциации сильного электролита оказывается несколько меньше 1. Ее называют кажущейся степенью диссоциации и рассчитывают по формуле
=
![]() ,
(33)
,
(33)
где i – изотонический коэффициент Вант-Гоффа.
Изотонический коэффициент i показывает, во сколько раз экспериментально найденное свойство раствора электролита отличается от такого же свойства, вычисленного для раствора неэлектролита при той же концентрации:
i
=
![]() ,
,
где «свойство раствора» – Росм, Р, Ткип или Тзам.
Коллигативные свойства для разбавленных растворов электролитов следует оценивать с учетом изотонического коэффициента по формулам
![]() =
=
 ,
(34)
,
(34)
DTкип =
Tкип–
Т ![]() = i
КЭ ×
Сm,
(35)
= i
КЭ ×
Сm,
(35)
DTзам =
Т ![]() – Tзам =
i
КК ×
Сm,
(36)
– Tзам =
i
КК ×
Сm,
(36)
Росм = i С2 R T , (37)
