
- •Федеральное агентство по образованию
- •Энергетика химических процессов Краткие теоретические сведения
- •Примеры решения задач
- •Химическая кинетика и равновесие Краткие теоретические сведения
- •Примеры решения задач
- •Комплексные соединения Краткие теоретические сведения
- •Типы гибридизаций и геометрические конфигурации некоторых комплексов
- •Примеры решения задач
- •Таким образом, в данном комплексном ионе имеет место sp3гибридизация ао, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2–имеет тетраэдрическую структуру.
- •Литература
- •Содержание
Примеры решения задач
Пример
1.Для простой реакции А + 2ВDначальные концентрации
А и В равны 0,03 и 0,05 моль/дм3. Константа
скорости реакции равна 0,4![]() .
Вычислите начальную скорость реакции
и скорость реакции, когда концентрация
вещества А уменьшится на 0,01 моль/дм3.
.
Вычислите начальную скорость реакции
и скорость реакции, когда концентрация
вещества А уменьшится на 0,01 моль/дм3.
Р е ш е н и е
Кинетическое уравнение данной реакции имеет вид
= k[A][B]2.
Тогда скорость реакции в начальный момент времени равна
0=
0,40,03(0,05)2= 310-5![]() .
.
Определим концентрации реагентов, когда концентрация А уменьшится на 0,01 моль/дм3. Концентрация вещества А будет равна разности между начальным значением и израсходованным
[A] = 0,03 – 0,01 = 0,02 моль/дм3.
Согласно уравнению реакции расход по веществу В в два раза больше относительно расхода вещества А, поэтому
[B] = 0,05 – 20,01 = 0,03 моль/дм3.
Тогда скорость реакции
= 0,40,02(0,03)2= 7,210-6![]() .
.
Пример 2.Во сколько раз изменится скорость реакции 2NO+O2= 2NO2, если приТ=constповысить общее давление в 2 раза?
Р е ш е н и е
Поскольку все участники реакции являются газообразными веществами, то увеличение общего давления в 2 раза при постоянной температуре вызовет уменьшение объема системы в 2 раза, то есть концентрация каждого из веществ увеличится в 2 раза. Согласно закону действующих масс скорость реакции до повышения давления равна
1 = k[NO]2[O2],
а после повышения давления
2 = k(2[NO])22[O2] = 8k[NO]2[O2].
Так
как kне зависит от
концентраций реагентов, то![]() ,
то есть, при повышении давления в 2 раза
скорость реакции увеличится в 8 раз.
,
то есть, при повышении давления в 2 раза
скорость реакции увеличится в 8 раз.
Пример 3. Для
реакции 2NO+Cl2= 2NOCl(все вещества газы)
начальные концентрации реагентов
одинаковые и равны 0,2 моль/дм3.
Определите константу скорости реакции,
если в момент, когда разлагается 25 %
хлора, скорость реакции равна 7,810–3![]() .
.
Р е ш е н и е
Определим концентрацию Cl2, когда его расход составит 25 %
![]() моль/дм3.
моль/дм3.
Определим концентрацию NO, учитывая, что расходNOв 2 раза больше расхода хлора
![]() моль/дм3.
моль/дм3.
Запишем кинетическое уравнение данной реакции
= k[NO]2[Cl2].
Отсюда определяем константу скорости реакции
![]()
![]() .
.
Пример 4.При 150С реакция заканчивается за 16 минут. Определите время, необходимое для протекания реакции при 200С, если температурный коэффициент Вант-Гоффа равен 2,5.
Р е ш е н и е
Между скоростью протекания химической реакции и ее продолжительностью существует обратно пропорциональная зависимость
![]() ,
,
тогда правило Вант-Гоффа в данном случае можно записать в виде
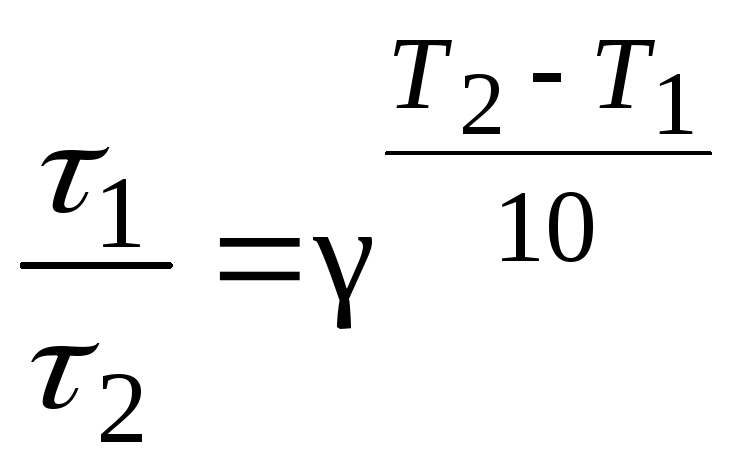 ,
откуда
,
откуда
![]()
![]() мин.
мин.
Пример 5. Вычислите энергию активации реакции, если при повышении температуры от 290 К до 320 К скорость реакции увеличивается в 7 раз.
Р е ш е н и е
Согласно основному закону химической кинетики, скорость реакции и константа скорости реакции прямо пропорциональны друг другу, то есть выполняется соотношение
![]()
![]() .
.
Подставим это в формулу для расчета энергии активации
ЕА=![]() Дж/моль.
Дж/моль.
Пример 6.В состоянии равновесия для реакцииN2+ 3H22NH3концентрации участников равны (моль/дм3): [N2] = 3; [H2] = 9; [NH3] = 4. Вычислите константу равновесия реакции и определите исходные концентрации азота и водорода, полагая, что до начала реакции аммиак в системе отсутствовал.
Р е ш е н и е
Данная реакция является гомогенной, поэтому константа равновесия

![]() .
.
Из
уравнения реакции следует, что для
образования 4 моль продукта требуется
![]() 4 = 2 моль азота и
4 = 2 моль азота и![]() 4 = 6 моль водорода. Следовательно, исходная
концентрация азота составляет [N2]0= 3 + 2 = 5 моль/дм3, а исходная
концентрация водорода равна [H2]0= 9 + 6 = 15 моль/дм3.
4 = 6 моль водорода. Следовательно, исходная
концентрация азота составляет [N2]0= 3 + 2 = 5 моль/дм3, а исходная
концентрация водорода равна [H2]0= 9 + 6 = 15 моль/дм3.
Пример 7.Константа равновесия реакцииFeOтв+ СОFeтв+ СО2при некоторой температуре равна 0,5. Определите равновесные концентрации газов, если до начала реакции газовая смесь содержала 0,05 моль/дм3СО и 0,01 моль/дм3СО2.
Р е ш е н и е
Для
данной гетерогенной реакции константа
равновесия определяется выражением
![]() .
Пусть к моменту равновесия в реакцию
вступилохмоль СО. Тогда, согласно
уравнению реакции, образовалось столько
же моль СО2. Следовательно,
равновесные концентрации газов будут
равны, моль/дм3:
.
Пусть к моменту равновесия в реакцию
вступилохмоль СО. Тогда, согласно
уравнению реакции, образовалось столько
же моль СО2. Следовательно,
равновесные концентрации газов будут
равны, моль/дм3:
[CO] = 0,05 –х ; [CO2] = 0,01 +х.
Подставим эти концентрации в выражение для константы равновесия
![]() или
или
![]() .
.
Таким образом, [CO] = 0,05 – 0,01 = 0,04 моль/дм3;
[CO2] = 0,01 + 0,01 = 0,02 моль/дм3.
Пример 8.Константа равновесия реакции Н2+I22HIравна 64,8. Определите равновесные концентрации компонентов, если исходная смесь содержала 1,4 моль/дм3водорода и 1,0 моль/дм3йода.
Р е ш е н и е
Выражение для константы равновесия данной реакции имеет вид
![]() .
.
Пусть
к моменту равновесия образовалось хмольHI. Тогда, согласно
уравнению реакции, было израсходовано
по![]() хмоль йода и водорода. Следовательно,
можно составить уравнение
хмоль йода и водорода. Следовательно,
можно составить уравнение
 или 15,2 х2– 77,76 х+ 90,72 = 0.
или 15,2 х2– 77,76 х+ 90,72 = 0.
Решение данного уравнения даст корни, моль/дм3:х1= 3,32;х2= 1,8. Первый корень не удовлетворяет условию задачи по физическому смыслу (концентрацияHIне может быть больше, чем удвоенная концентрация йода или водорода, то есть 2 или 2,8 моль/дм3). Таким образом, используем второй корень уравнения. Равновесные концентрации компонентов равны, моль/дм3:
[HI] = 1,8;
[H2]
= 1,4 –
![]() 1,8
= 0,5; [I2]
= 1,0 –
1,8
= 0,5; [I2]
= 1,0 –
![]() 1,8
= 0,1.
1,8
= 0,1.
Пример
9. Какие меры
следует предпринять для повышения
выхода продукта реакции N2
+ 3H2
2NH3
; Н![]() =
–92,4
=
–92,4
![]() .
.
Р е ш е н и е
По условию задачи требуется сместить равновесие в сторону прямой реакции, поэтому следует:
1) увеличивать концентрации азота и водорода, то есть постоянно водить в систему свежие порции реагентов; уменьшать концентрацию аммиака, иначе выводить его из реакционного пространства;
2) понижать температуру, так как прямая реакция является экзотермической;
3) увеличивать давление (уменьшать объем), потому что в прямом направлении происходит уменьшение числа моль газообразных веществ (из 4 моль газа образуется 2 моль).
Пример 10. Как изменится равновесная концентрация кислорода, если в системе 2Ств + О2 2СО при постоянной температуре увеличить концентрацию СО в 3 раза?
Р е ш е н и е
Запишем
выражение для константы равновесия
данного гетерогенного процесса
![]() .
По условию задачи
.
По условию задачи![]() .
Поскольку константа равновесия не
зависит от концентраций реагентов, то
должно выполняться равенство
.
Поскольку константа равновесия не
зависит от концентраций реагентов, то
должно выполняться равенство
![]() или
или
 .
.
Таким образом, при повышении концентрации СО в 3 раза равновесная концентрация кислорода должна увеличится в 9 раз.
