
- •Министерство образования и науки российской федерации
- •Гоу впо череповецкий государственный университет
- •Методические указания к практическим занятиям по курсу «физическая химия»
- •Учебно-методическое пособие
- •Введение
- •1. Первый закон термодинамики
- •1.1. Термодинамические процессы
- •1.2. Теплоемкость. Зависимость теплоемкости от температуры.
- •1.3. Закон Гесса
- •1.4. Зависимость теплового эффекта химической реакции от температуры:
- •2. Второй закон термодинамики
- •2.1 Вычисление изменения энтропии в различных процессах
- •2.2. Вычисление изменения изобарного и изохорного потенциалов в различных процессах
- •3. Химическое равновесие
- •3.1. Расчет равновесий по экспериментальным данным
- •3.2. Расчеты по уравнениям изотермы, изобары и изохоры химической реакции
- •Основной
- •162600, Г. Череповец, пр. Луначарского, 5
3.2. Расчеты по уравнениям изотермы, изобары и изохоры химической реакции
Изменение изобарного потенциала при протекании химической реакции в газовой фазе: aA + bB = gG + rR при Р, Т = const можно вычислить по уравнению изотермы Вант-Гоффа:
![]() .
.
При V, T = const уравнение изотермы позволяет вычислить изменение изохорного потенциала:
![]()
По знакам ∆G и ∆F можно судить о возможности и направлении протекания данной реакции. Если ∆GP, T < 0 или ∆FV, T < 0, реакция может протекать самопроизвольно в прямом направлении.
Зависимость константы равновесия от температуры выражается уравнениями изобары и изохоры Вант-Гоффа:
![]() или
или
![]() ;
;
![]()
![]() или
или
![]() .
.
В небольших температурных интервалах можно принять, что ∆Н ≠ f(T), тогда в интегральной форме уравнение изобары имеет вид
![]()
Графически
в координатах
![]() это уравнение изображается прямой
линией, тангенс угла наклона которой
равен
это уравнение изображается прямой
линией, тангенс угла наклона которой
равен

Постоянная интегрирования j определяется отрезком, отсекаемым прямой на оси ординат, или вычисляется по формуле
![]() .
.
Интегрируя в пределах от Т1 до Т2, получаем
![]() .
.
Это уравнение позволяет вычислять ∆Н в небольших интервалах температур, если известны значения констант равновесия при двух температурах. При более точном интегрировании следует учитывать, что ∆Н = f(T).
Пример 15
Степень диссоциации фосгена по реакции СОCl2 = CO + Cl2 при 873 К и 1,38 · 105 Н/м2 равна 0,9. Определить, в каком направлении будет протекать процесс при следующих заданных значениях парциальных давлений компонентов:
|
№ п/п |
|
|
|
|
1 |
1,013 |
1,013 |
1,013 |
|
2 |
1,048 |
2,026 |
3,039 |
|
3 |
1,048 |
3,039 |
3,039 |
Решение
Определяем константу равновесия реакции
СОCl2 = CO + Cl2:
n(1 - α) nα nα
![]()
![]()
![]()
Подставим в уравнение для KР :

Направление процесса определяем по ∆G из изотермы химической реакции. В первом случае

значит, процесс идет самопроизвольно в прямом направлении.
Во втором случае

значит, система находится в равновесии.
В третьем случае

значит, процесс идет самопроизвольно в обратном направлении.
Пример 16
Возможен
ли термодинамический процесс получения
анилина из хлорбензола по уравнению![]() ,
если известны стандартные изменения
изобарного потенциала веществ, входящих
в данную реакцию:
,
если известны стандартные изменения
изобарного потенциала веществ, входящих
в данную реакцию:
![]()
![]() ,
,![]() ,
,
![]()
![]() ,
,![]() .
.
Вычислить Kр реакции при 298 К.
Решение
1.
![]() ,
,
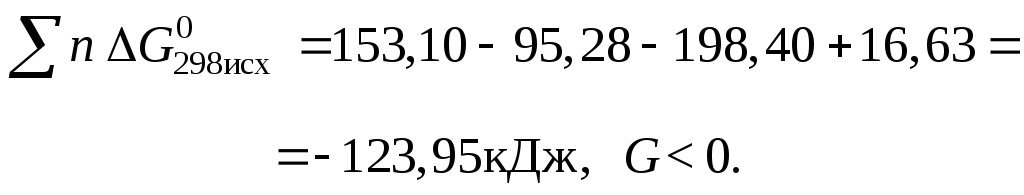
Следовательно, процесс возможен.
2. Kр вычисляется по уравнению изотермы для нормального сродства:

Пример 17
Рассчитать констант равновесия реакции СО + 2Н2 = СН3ОНг
при
800 К,
если
![]() ,
,![]() и мольные теплоемкости газов:
и мольные теплоемкости газов:

Решение
Определяем тепловой эффект по уравнению Кирхгофа:



Константу равновесия определяем по формуле
![]()

Пример 18
Константа
равновесия реакции
![]() может
быть выражена уравнением
может
быть выражена уравнением
![]()
Определить тепловой эффект этой реакции при 1000 К и KР.
Решение
Зависимость константы равновесия от температуры описывается уравнением изобары:
![]() .
.
Для
определения ∆Н
необходимо продифференцировать уравнение
![]() по температуре и полученную зависимость
умножить на 2,303R T2
.
по температуре и полученную зависимость
умножить на 2,303R T2
.

![]()

3.3. Расчет равновесий по таблицам стандартных величин и методом Темкина – Шварцмана
Стандартное изменение изобарного потенциала выражается уравнением
![]() .
.
Отсюда
![]()
![]()
или
![]() .
.
Для расчета константы равновесия при любой температуре используют уравнение
![]() ,
,
где

Подставляя
значения
![]() и
и![]()
![]() в
уравнение дляlgKp, T
и преобразуя его, можно получить
в
уравнение дляlgKp, T
и преобразуя его, можно получить
![]() ,
,
где М0, М1, М2 и М–2 – функции температуры.
![]() ;
;
![]() приn
≠ 0.
приn
≠ 0.
Указанные коэффициенты могут быть найдены по таблице, составленной М.И. Темкиным и Л.А. Шварцманом. Расчеты при использовании метода Темкина – Шварцмана значительно упрощаются.
Таким образом, для расчета константы равновесия по стандартным термодинамическим данным необходимо:
1.
Найти в справочной литературе для всех
участников реакции:![]() иа-2.
иа-2.
2.
Рассчитать для реакции
![]() и Δа-2
путем вычитания из суммы соответствующих
величин для конечных продуктов суммы
этих величин для исходных веществ с
учетом стехиометрических коэффициентов
уравнения химической реакции.
и Δа-2
путем вычитания из суммы соответствующих
величин для конечных продуктов суммы
этих величин для исходных веществ с
учетом стехиометрических коэффициентов
уравнения химической реакции.
3. Найдя по таблицам Темкина – Шварцмана значения М0, М1, М2 и М-2 для своей температуры Т, рассчитать Kp, T.
Пример 19
Вычислить
константу равновесия по методу Темкина
–Шварцмана для реакции
![]() в
газовой фазе при 1200 К. Полученное значение
константы равновесия сравнить с
экспериментальным
в
газовой фазе при 1200 К. Полученное значение
константы равновесия сравнить с
экспериментальным![]()
Решение
Находим
из справочника значения
![]() и Δа2
для Н2,
СО, СО2
и СН4.
Данные записываем в виде таблицы:
и Δа2
для Н2,
СО, СО2
и СН4.
Данные записываем в виде таблицы:
|
Вещество |
|
|
а0 |
а1 .103 |
а2 .106 |
а–2 .10-5 |
|
Дж/(моль·К) | ||||||
|
СО |
-110,50 |
197,40 |
28,41 |
4,10 |
– |
-0,460 |
|
Н2 |
0 |
130,60 |
27,28 |
3,26 |
– |
0,502 |
|
СН4 |
-74,85 |
186,20 |
17,45 |
60,46 |
1,17 |
– |
|
СО2 |
-393,50 |
213,60 |
44,14 |
9,04 |
– |
8,530 |
По данным таблицы вычисляем:
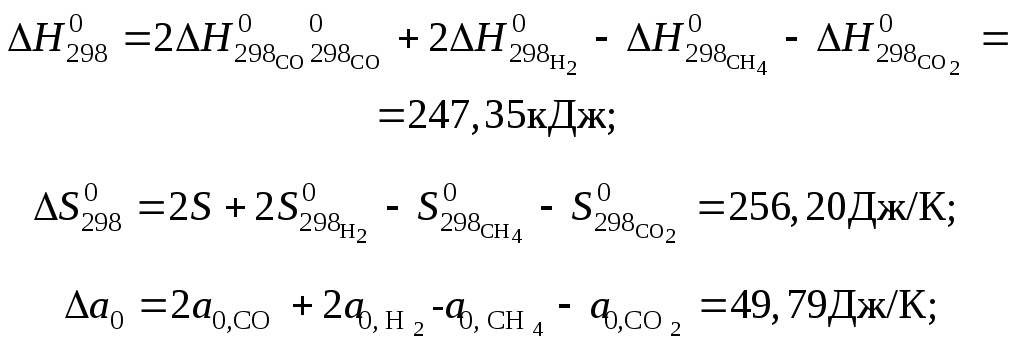
![]()
![]()
![]()
По таблице Темкина – Шварцмана при Т = 1200 К находим:
М0 = 0,641, М1 = 0,339 · 103 , М2 = 0,203 .106 , М-2 = 0,318 .10-5 .
По приведенной выше формуле находим:

Таким
образом, Kр, 1200 = 3,127·103,
![]() вычисляем расхождение между расчетными
и экспериментальными данными:
вычисляем расхождение между расчетными
и экспериментальными данными:
![]()
Список литературы
