
Радіобіологія фул вершин (передмовалесс, вступлесс етс. едишн)
.pdf81
потенціальних ушкоджень проявляється з певною імовірністю. Ця модель за використання спеціальної системи рівнянь дозволяє передбачити в певних межах прояв радіобіологічних ефектів.
Згідно з імовірнісною моделлю на першому етапі радіаційно-індукованих уражень формуються первинні потенціальні ушкодження, які виникають внаслідок „влучення” випромінювання у мішені-клітин. Клітини мають здатність до відновлення на цій стадії формування пошкоджень, якщо енергія випромінювання, що передається певній мішені (об’єму), не порушує репараційні процеси. На другому етапі відбувається реалізація потенціальних уражень, які не підпали під дію репараційних процесів. Третій етап радіаційно-індукованих уражень супроводжується різноманітними вторинними порушеннями протікання внутріклітинних процесів, які викликані реалізацією потенційних уражень. На цьому етапі також можливі відновні процеси або компенсація ушкоджень.
За всієї привабливості, імовірнісної моделі вона не визначає природу радіаційних уражень.
ГІПОТЕЗА ЛІПІДНИХ РАДІОТОКСИНІВ. Наслідком поглинання енергії випромінювання біологічними об’єктами є утворення високореакційних сполук, які називаються радіотоксинами. Вони здатні викликати різноманітні пошкодження клітинних структур. Одними з таких речовин є продукти пероксидного окислення ліпідів, які становлять собою комплекс продуктів окиснення ненасичених жирних кислот: гідропероксиди, епоксиди, альдегіди, кетони тощо.
Гіпотеза ліпідних радіотоксинів базується на вирішальній ролі у початкових процесах радіаційного ураження окисних реакцій вільнорадикального типу, які протікають за участю ліпідів.
Утворення ліпідних радіотоксинів відбувається в ланцюгових реакціях, коли первинні вільні радикали призводять до появи наступних у так званих реакціях з розгалуженими ланцюгами. Згідно з теорією ліпідних радіотоксинів за дії іонізуючої радіації спочатку уражуються ліпіди біомембран, що призводить до порушення ряду метаболічних процесів у клітині. Слід відмітити, що значні порушення функцій мембран можуть навіть призвести до загибелі клітин.
Гіпотеза ліпідних радіотоксинів має певні обмеження. Згідно з нею ліпіди у клітинах є мішенями, первинне ураження яких викликає розвиток різноманітних порушень. Ця гіпотеза обмежена певними явищами, не враховує багатогранність радіаційних ефектів. Так, наприклад, ліпідні радіотоксини не здатні проявляти мутагенну дію, яка викликається дією іонізуючої радіації. Крім того, протікання ланцюгових реакцій окиснення ліпідів продемонстровано в експериментальних умовах, а їх наявність в організмі не виявлена. Існує також певна відмінність ефектів прояву дії іонізуючої радіації від інтенсивності утворення ліпідних радіотоксинів за різних доз опромінення. Слід врахувати, що радіотоксини необмежені тільки ліпідними, є також багато інших – хінони, холін, продукти автолізу тощо.
СТРУКТУРНО-МЕТАБОЛІЧНА ТЕОРІЯ. В основі цієї теорії лежить твердження, що порушення за дії іонізуючої радіації обумовлені деструкцією всіх основних біополімерних молекул, цитоплазматичних та мембранних структур у живій клітині. Наслідком цього є порушення притаманної клітинам упорядкованості протікання біохімічних реакцій і утворення радіотоксинів. Серед них особлива роль надається первинним радіотоксинам, які утворюються в клітинах одразу або в перший момент
82
після опромінення, яким притаманна властивість викликати радіобіологічні ефекти. Вони здатні стимулювати утворення нових токсичних сполук.
Структурно-метаболічна теорія робить спробу пояснити дію іонізуючої радіації як на окремі клітини, так і на багатоклітинні організми; як уражуючу дію летальних і сублетальних доз, так і можливу стимулюючу дію малих доз. Ця теорія має певні переваги перед іншими, але все ж таки не є універсальною. Вона не дає кількісних оцінок дії іонізуючої радіації, приділяє необґрунтовано велику увагу первинним радіотоксинам.
ГІПОТЕЗА ЕНДОГЕННОГО ФОНУ ПІДВИЩЕНОЇ РАДІОРЕЗИСТЕНТНОСТІ. За цією гіпотезою іонізуюче випромінювання є подразником, на який опромінений організм реагує подібно до дії інших постійних подразників довкілля. Ступінь відповідної реакції організму підпорядковується загально-біологічним закономірностям та залежить від дози подразнювача. За дії іонізуючої радіації в організмі не виникає принципово нових хімічних сполук. Зокрема, ця гіпотеза пояснює чому надзвичайно мала кількість енергії, яка передається випромінюванням організмам, здатна викликати виражені радіаційно-індуковані ефекти. Розрахунки свідчать, що приблизно така ж кількість енергії поглинається тканинами та клітинами організму і за дії високоактивних хімічних речовин.
Первинні фізичні явища (поглинання енергії молекулами, їх збудження, іонізація або дисоціація) та радіаційно-хімічні процеси, за яких утворюються вільні радикали, що взаємодіють в окисно-відновних реакціях з неорганічними і органічними речовинами, викликають біологічні реакції. Вони обумовлюють зміну функцій і структури органів та їх систем, реакції цілісного організму, які опосередковані дією іонізуючої радіації через нервову, ендокринну, імунну та інші системи.
Існує думка, що променеве ураження є однією з форм стрес-реакцій організму, оскільки в перші часи після опромінення спостерігається гіперсекреція наднирників, зменшення розміру тимусу і селезінки, розвиток лімфопенії тощо.
Опосередкований дією іонізуючої радіації гуморальний шлях променевого ураження пов’язаний з утворенням радіотоксинів, які викликають якісні та кількісні зміни в крові, лімфі, тканинній рідині та інших середовищ. До радіотоксинів у певні етапи розвитку променевої хвороби (див. підрозділ 4.2) можна віднести продукти обміну речовин і розпаду клітин, тощо. Таким чином, гіпотеза ендогенного фону підвищеної радіорезистентності дає, у порівнянні з іншими, більш ширші уявлення про первинні біологічні механізми дії іонізуючої радіації на організми.
Слід відмітити, що наведені тільки найпоширеніші теорії та гіпотези. Не одна з них не може бути поки що універсальною, пояснити прояв всіх радіаційно-індукованих ефектів, які виявлені в експериментальних дослідженнях. Разом з тим інтенсивний розвиток радіобіології, накопичення великої кількості експериментальних даних дає надію на те, що створення єдиної теорії прояву радіобіологічних ефектів – це справа не так далекого майбутнього.
3.3. Дія іонізуючих випромінювань на біомолекули
83
Іонізуючі випромінювання здатні викликати зміни як простих неорганічних молекул, так і складних молекулярних структур, які входять до складу клітини, в результаті процесів, що протікають на первинних стадіях дії опромінень (рис.3.1). Інактивація макромолекули може відбуватись як в результаті прямої, так і непрямої дії іонізуючої радіації. При дослідженні прямої дії іонізуючої радіації на макромолекули використовують, як правило, безводні чи кристалічні препарати ферментів, нуклеїнових кислот тощо. У цьому випадку молекула інактивується переважно у результаті прямого поглинання енергії випромінювань.
Дослідження радіаційно-хімічних перетворень біомолекул у водних розчинах дозволяє оцінити ступінь реакції окремих молекул на опромінення внаслідок її непрямої дії. Для цього використовують таку одиницю, як величина радіаційнохімічного виходу (G) - відповідає числу змінених чи утворених молекул (моль) на 100 эВ поглиненої енергії випромінювань.
Слід відмітити, що при опроміненні в дозі 10 Гр (абсолютно летальної для більшості савців) внаслідок прямої дії пошкоджується лише незначна частина низькомолекулярних компонент клітини, які містяться у водних розчинах.
Опосередковане пошкодження органічних молекул у водних розчинах обумовлено дією високоактивних дифундуючих вільних радикалів, що виникають внаслідок радіолізу молекул води. Вільні радикали (е-гідр, Н·, ОН·, НО2· тощо) володіють високою реакційною здатністю. Вони можути викликати розрив хімічних зв’язків у білках, нуклеїнових кислотах, фосфоліпідах та інших органічних молекулах.
Розглянемо детальніше поведінку органічних молекул у водних розчинах за умов непрямої дії іонізуючої радіації. Серед різних класів макромолекул – білків, вуглеводів, ліпідів, ДНК, амінокислот тощо – найбільших змін зазнають ліпіди, зокрема фосфоліпіди.
Ліпіди. Радіаційно-хімічні ушкодження ліпідів пов’язані, насамперед, з окисненням жирних кислот, які входять до їх складу. Основним механізмом цього процесу є утворення радикалів, які викликають ланцюгові реакції пероксидної деградації молекул жирних кислот, розщеплення С – Н -зв’язку.
Пероксидне окиснення ліпідів (ПОЛ) викликається появою в ліпідах вільних радикалів, які можуть взаємодіяти з компонентами ліпідів, зокрема залишками жирних кислот. Вільні радикали, які є продуктами радіолізу води (е-гідр, Н·, ОН·, НО2· тощо), ініціюють появу пероксидного радикалу ліпідів, що вступає в реакцію з молекулами жирних кислот сусідніх молекул ліпідів. Це супроводжується утворенням гідропероксиду і нового вільного радикалу молекули ліпідів.
Радіочутливість фосфоліпідів перевищує радіочутливість усіх інших неполімерних молекул. Основні продукти радіолізу фосфоліпідів – гідропероксиди, карбонільні сполуки, основи Шиффа. Останні утворюються в реакції продуктів ПОЛ з фосфоліпідами та білками, які містять вільні аміногрупи, та здатні до флуоресценції. Серед продуктів радіолізу фосфоліпідів є карбонільні сполуки, що реагують із тіобарбітуровою кислотою. Це суміш ненасичених альдегідів, самий низькомолекулярний із яких – малоновий діальдегід. Перераховані продукти радіолізу фосфоліпідів реєструються після опромінення суспензії клітин, мітохондрій, організму та використовуються при дослідженні протікання ПОЛ.
Нуклеїнові кислоти. Полінуклеотиди або інакше нуклеїнові кислоти – це біополімери, які побудовані з нуклеотидів (лат. nucleus – ядро). Вони відіграють
84
провідну роль в біосинтезі білків, передачі спадкових ознак і властивостей організмів.
Відомі рибонуклеїнова (РНК) і дезоксирибонуклеїнова (ДНК) кислоти.
За умов радіолізу нітрогенвмісні основи (аденін, гуанін, тимін і цитозин в ДНК, а в РНК замість тиміну – урацил) можуть зазнавати перетворень, які супроводжуються розмиканням кільцевих структур, утворенням похідних внаслідок протікання хімічних реакцій. В пентозах, які входять до складу нуклеїнових кислот, окислюються спиртові групи, розриваються карбон-карбонові зв’язки тощо.
Молекулі РНК, яка має одноланцюгову будову (у деяких вірусів є дволанцюгові РНК), притаманні одноланцюгові розриви. Вони викликають появу фрагментів, деградацію. У молекулі ДНК можливі розриви водневих зв’язків на окремих ділянках дволанцюгової ДНК, поява одно- і дволанцюгових розривів, відщеплення залишку фосфорної кислоти.
Число пошкоджень азотистих основ ДНК лінійно залежить від дози. Найбільш чутливі дії випромінювань пиримідинові основи, радіоліз яких відбувається в результаті взаємодії з вільними радикалами води (OН.). Водночас, пуринові основи в 1,5–2,0 рази більш стійкі до дії іонізуючих випромінювань.
Кількість одноланцюгових розривів – лінійно залежить від дози опромінення в дуже широкому діапазоні (від менше, ніж 0,2 Гр до 60 000 Гр). Інакше кажучи, наскільки б малою не була доза опромінення, повинно виникати певне число розривів однієї з ланцюгів ДНК. Середня енергія на один розрив для випромінювання з низькою ЛПЕ становить близько 2∙10-18Дж. Вихід дволанцюгових розривів ДНК за доз опромінення до 500 Гр зростає лінійно із дозою опромінення, причому в середньому у 10–20 раз менший за виходу однониткових розривів. Рівень деградації ДНК залежить від багатьох факторів. Дволанцюгові розриви частіше спостерігаються за опромінення α- частинками, протонами та нейтронами. Значна частина одноланцюгових розривів відбувається за участю ОН·-радикалів води. Відновлення одноланцюгових розривів ДНК у клітинах ссавців відбувається досить ефективно.
Білки. Первинні зміни у молекулі білка, які викликані радіолізом внаслідок поглинання енергії випромінювання, пов’язані з утворенням вільних радикалів. Радикали можуть приводити до розриву пептидного зв’язку, відщеплення карбоксильних і аміногруп, атомів гідрогену від нітрогену і карбону тощо. У сульфурвмісних амінокислот спостерігається окиснення сульфуру, а у циклічних – розрив кільця. Це призводить до порушення структурної організації молекули білка, у тому числі розриву поліпептидного ланцюга, появи фрагментів, деградації тощо. Радіаційно-хімічні зміни молекули білка, в тому числі вторинної та третинної структури, можуть призвести до втрати їх функціональних властивостей.
Вуглеводи. Зміни структури вуглеводів спостерігається за високих доз опромінення. Можливе відщеплення атома гідрогену від карбону із утворенням радикалів. Радіоліз вуглеводних полімерів (крохмалю, целюлози тощо) призводить до зменшення ступеню полімеризації, появи макрорадикалів, які здатні перетворюватися, що супроводжується рощепленням зв’язків карбон-оксиген, карбон-карбон, а також дегідратацією. Можливе відщеплення олігосахаридів, фрагментація молекул.
Органічні кислоти, коферменти. Дія іонізуючої радіації на органічні кислоти
супроводжується окисно-відновними перетвореннями, відщепленням деяких груп (зокрема карбонільної), заміною груп на атом гідрогену тощо.
85
Опромінення металовмісних сполук супроводжується, як правило, окисновідновними перетвореннями в яких беруть участь атоми відповідних металів. Може відбуватися також порушення спряжених зв’язків, розкриття порфіринових кілець тощо.
Коферменти – це сполуки, які входять до складу ферментів і обумовлюють їх активність. В першу чергу це нікотинамідаденіндинуклеотид (НАД), його фосфорильована форма (НАДФ), флавінаденіннуклеотид (ФАД). За дії іонізуючої радіації відновлені форми цих сполук здатні окиснюватися, а окиснені – відновлюватися. Радикали НАД можуть утворювати димери. Можливий також процес розщеплення цих сполук за участю продуктів радіолізу води.
Ушкодження коферментів поряд з порушенням білкової частини ферментів може зумовити зміну активності ферментів, що вплине на протікання біохімічних реакцій і в кінцевому результаті на життєдіяльність клітин і багатоклітинних організмів у цілому.
Коферменти беруть також участь в енергетичних перетвореннях у клітинах і радіаційно-хімічні їх зміни можуть викликати порушення енергозабезпечення життєдіяльності клітин.
В клітинах, крім нуклеїнових кислот, білків, ліпідів, органічних кислот і коферментів містяться також інші речовини – вільні амінокислоти, етери фосфорної кислоти, вітаміни, гормони та багато інших, які піддаються радіаційно-хімічним перетворенням за дії іонізуючої радіації.
3.4.Дія іонізуючої радіації на клітини
Уживих організмах пошкодження низькомолекулярних сполук та макромолекул, які розвиваються на фізичній, фізико-хімічній та хімічних стадіях дії іонізуючих випромінювань, являються основою для розвитку різноманітних процесів, що послідовно реалізуються на всіх рівнях біологічної організації, починаючи від субклітинного та завершаючи організменним. Відбувається „біологічне посилення” первинного радіаційного пошкодженя. Різноманітні та взаємопов’язані зміни на біологічній стадії формуються протягом секунд, годин, діб, всього періоду життя клітини чи організму.
Вплив іонізуючих випромінювань на клітинному рівні розглядається не лише з точки зору змін окремих молекул, а як складна реакція–відповідь клітини, що включає взаємопов’язані порушення структури та функції її елементів, які залежать від характера та ступеня радіаційного пошкодження. За дії іонізуючих випромінювань у клітині розгортається складна багатопланова картина системної відповіді.
У результаті протікання сукупності радіаційно-індукованих процесів можуть виникнути порушення життєдіяльності чи загибель клітин. З іншого боку, можливе відновлення клітин, що забезпечить нормалізацію функціонального стану організму. Із збільшенням кількості пошкоджень, зменшується ймовірність відновлення. Зупинимось детальніше на розгляді цих проблем.
ФОРМИ ЗАГИБЕЛІ ОПРОМІНЕНИХ КЛІТИН. Форми загибелі клітин різноманітні. Класифікація, залежно від часу настання загибелі відносно акту поділу клітини, наступна: 1) до поділу (під променем); 2) без поділу; 3) після першого поділу; 4) у наступних поділах; 5) загибель частини клітин популяції, що ділиться.
86
У залежності від безпосереднього зв'язка летального ефекту із процесом поділу,
класифікація наступна: |
|
1) інтерфазна загибель клітини - не |
залежна від фаз клітинного цикла (до неї |
відносяться 2 перших видів загибелі, що відмічені вище); |
|
2) репродуктивна або мітотична |
загибель клітини – пов’язана з процесом |
клітинного поділу ( відносяться 3-5 види загибелі що відмічені вище).
У природі найпоширеніша репродуктивна форма променевої загибелі клітин. За дії опромінення може настати стан повного пригнічення мітозу, за якого клітина продовжує жити протягом деякого часу, але цілком втрачена здатність до поділу. Цей стан клітин називають репродуктивною чи проліферативною (лат. proles – нащадки та facere – робити) загибеллю. Таким чином, репродуктивна загибель характерна лише для клітин, що діляться, і частіше відбувається у процесі першого післярадіаційного поділу.
Основною причиною цього явища є структурні перетворення ДНК у вигляді так званих аберацій (лат. aberratio – відхилятися) хромосом. Основними видами хромосомних аберацій є: фрагментація хромосом, формування хромосомних мостів, виникнення кільцевих хромосом, поява міжхромосомних обмінів, утворення мостів, які механічно перешкоджають поділу клітини. Поява обмінів призводить до нерівномірного поділу або втрати генетичного матеріалу, що викликає загибель клітини через недостачу метаболітів, синтез яких кодувався ДНК втраченої частини хромосоми.
Проявом репродуктивної загибелі нащадків опромінених клітин є формування гігантських клітин, що містять поліплоїдні ядра. Їх виникнення може бути пов'язано як із багаторазовим проходженням клітиною S-фази цикла без мітоза, так і результатом злиття двох сусідніх, частіше сестринських, клітин. Гігантські клітини гинуть при наступних поділах.
Цілковита втрата життєздатності клітин називається інтерфазною загибеллю. Вона не залежить від фаз клітинного цикла та спостерігається як у клітин, що діляться так і тих, які не діляться. Загибелі клітин в інтерфазі передує ряд фізіологічних та морфологічних її змін: пригнічується клітине дихання, змінюється проникність клітинних мембран, спостерігається набухання та пікноз ядер, вакуолізація та розпад ядерець тощо.
За дії доз до 10 Гр загибель настає у перші години після опромінення (малі лімфоцити, юні ооцити) чи в протягом перших діб після опромінення (нервові, м’язові, печінкові клітини) і обумовлена дегенеративними змінами клітин, зокрема пікнозом або фрагментацією хроматину. За дії доз більше 10 Гр загибель клітин може відбуватися миттєво або відразу після опромінення.
Виділяють три варіанта інтерфазної форми променевої загибелі клітин:
1.Інтерфазна загибель клітин, що обмежено діляться, після опромінення в малих дозах (десятих долей – одиниці грей).
2.Інтерфазна загибель клітин, що не діляться чи рідко діляться, після опромінення
вдозах порядка десятків та сотні грей.
3.Інтерфазна загибель клітин, які діляться, до настання мітозу після опромінення високими дозами.
МЕХАНІЗМИ ЗАГИБЕЛІ КЛІТИН (АПОПТОЗ ТА НЕКРОЗ). Клітини тканин можуть гинути різними шляхами, найголовніші з яких некроз та апоптоз. Апоптоз (гр. apoptos), означає „опадання листя” – регульована (програмована) загибель клітин.
87
Некроз (гр. nekros) – незворотне припинення життєдіяльності клітин внаслідок їх деструкції. Ключові відмінності некрозу та апоптозу наведено в табл.3.2.
У більшості випадків некроз починається із пошкодження плазматичної мембрани, що призводить до порушення здатності клітин зберігати свій іонний гомеостаз (набряк мітохондрій та клітини у цілому) і, як наслідок, клітина руйнується шляхом лізису. Некротична смерть клітини за умов іп vіvо супроводжується значним пошкодженням тканини, що сприяє розвитку запального процесу в місці цього пошкодження. Тобто некроз зачіпає групи клітин, що мають взаємні контакти.
Некротична форма загибелі найбільш характерна при опроміненні клітин організма у високих (летальних) дозах. Вона є проявом неспецифічної реакції клітини на різного роду впливи, у тому числі й іонізуючої радіації. В основі цієї реакції – механізм оксидативного пошкодження структури клітинних мембран (окислення тіолових груп білків, гідроліз фосфоліпідів тощо), що призводить до утворення пор та зростання іонної проникності мембран і, як результат – набухання клітини із подальшою її некротичною дезінтеграцією.
Таблиця 3.2. Порівняльна характеристика некрозу та апоптозу
Ознака |
Апоптоз |
Некроз |
|
|
|
Індукція |
Активується |
Відрізняється у |
|
фізіологічними чи |
залежності від |
|
патологічними |
пошкоджуючого |
|
стимулами |
фактору |
|
|
|
Поширеність |
Одинокі клітини |
Група клітин |
|
|
|
Біохімічні |
Енергозалежна |
Порушення чи |
|
фрагментація ДНК |
зупинка іонного |
зміни |
ендогенними |
обміну. Вивільнення |
|
ендонуклеазами. |
ферментів із лізосом. |
|
Лізосоми інтактні. |
|
|
|
|
Розпад ДНК |
Внутрішньоядерна |
Дифузна |
|
конденсація та |
локалізація в |
|
розщеплення на |
некротизованій |
|
фрагменти. |
клітині |
|
|
|
Цілісність |
Збережена |
Порушена |
клітинної |
|
|
мембрани |
|
|
|
|
|
Морфологія |
Зморщення клітин та |
Набуханання та |
|
фрагментація із |
лізис клітин |
|
формуванням |
|
|
апоптичних тілець |
|
|
|
|
88
Запалювальна |
Не виникає |
Зазвичай присутня |
відповідь |
|
|
|
|
|
Виділення |
Поглинання |
Поглинання |
загинувших |
(фагоцитоз) сусідніми |
(фагоцитоз) |
клітин |
клітинами |
нейтрофілами та |
|
|
макрофагами |
|
|
|
Апоптоз, на відміну від некрозу – це активний процес, який призводить до самознищення клітини. У відповідь на зовнішні або внутрішні сигнали запускається генетично запрограмований каскад реакцій, який супроводжується активацією певних генів, синтезом білків, що приводить до швидкого видаленню клітини із тканини.
Ініціаторами апоптоза можуть виступати хімічні речовини, вірусна інфекція, радіація тощо. Радіаційний апоптоз характерний як для клітин, що швидко оновлюються (епітелій кишечника, дихальних шляхів, червоний кістковий мозок), так і клітин, що знаходяться у стані спокою (тимоцити, лімфоцити периферійної крові).
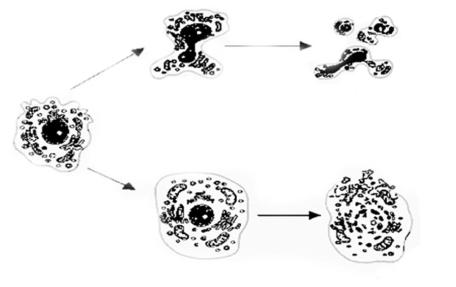
Схематично морфологічні прояви некрозу та апоптозу представлено на рис.3.3. Для клітини, що піддалась апоптозу характерно: зменшення об'єму клітини (цитоплазма ущільнюється, органели розміщуються більш компактно), конденсація хроматину (рис. 3.4), фрагментація клітин на везикули (апоптозні тільця) (рис.3.5) та фагоцитоз апоптозних тілець макрофагами чи сусідніми здоровими клітинами.
Апоптоз
2 |
3 |
1
Некроз
4 |
5 |
Рис.3.3. Форми клітинної загибелі - некроз та апоптоз: 1 – інтактна клітина; 2 – ущільнення клітинних органел, конденсація хроматину; 3 – фрагментація клітини, утворення апоптозних тілець; 4 – набухання клітинних органел; 5 – розрив клітинної мембрани.
89
Механізм конденсації хроматина достатньо добре досліджено. Це пов’язано із розщепленням ядерної ДНК ендонуклеазами та утворенням фрагментів, розмір яких кратний довжині одної нуклеосоми (180 - 200 пар нуклеотидів). На електрофореграмі ДНК апоптозні клітин вони мають вигляд так званої „драбини”. В подальшому, апоптозні тільця фагоцитуються макрофагами та клітинами сусідами. Апоптоз ніколи не супроводжується запальною реакцією, тобто він зачіпає окремі клітини.
1 |
|
2 |
|
|
|
3 |
|
4 |
|
|
|
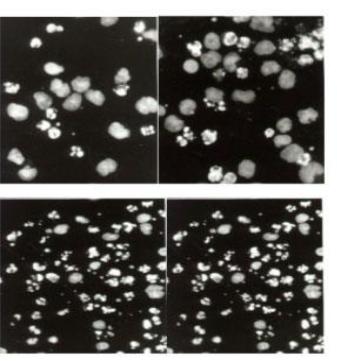
Рис. 3.4. Конденсація хроматина: 1- втрата звязку із каріолемою; 2 - агрегація хроматина; 3 - розчинення хроматина; 4 - апоптозні тільця (отримано за допомогою проточної цитофлуориметрії).
Для виявлення клітин, які знаходяться на ранніх етапах апоптозу використовують спеціальні імуногістохімічні методи, наприклад, визначення активованих каспаз або TUNEL-метод, який дозволяє виявити розірвану ендонуклеазами ДНК.
Апоптоз – багатоетапний процес, який складається із:
-прийняття сигналу у вигляді інформації, що надходить до клітини зовні чи виникає всередині клітини;
-отриманий сигнал послідовно передається молекулами-посередниками різного порядку;
-сигнал досягає ядра, де і відбувається включення програми клітинного самогубства шляхом активацією летальних та/або репресії антилетальних генів.
90
Водночас, існування програмованої клітинної загибелі в безядерних системах (цитопластах – клітинах, у яких відсутні ядра) свідчить, що присутність ядра не є обов'язковим для реалізації процесу апоптозу.
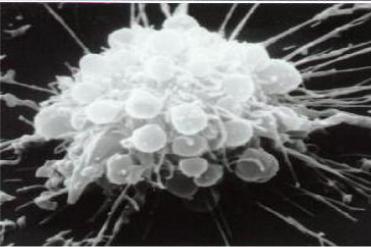
Рис. 3.5. Апоптозні тільця кардіоміоцита (отримано за допомогою скануючої електронної мікроскопії).
Існує декілька шляхів реалізації апоптозу в клітині.
1.Активація рецепторів апоптозу – рецепторів смерті”, яких на даний час нараховується п’ять і головними серед них виступають Fas та TNF-R1. Активація рецепторів апоптозу каспази-8, що запускає каскад реакцій які ведуть до апоптозу.
2.Генотоксичні ефекти ДНК пошкоджуючих агентів реалізуються за рахунок їх безпосереднього впливу на ядро клітини. Центральною ланкою клітинних механізмів, що активуються у відповідь на пошкодження ДНК, являється фактор транскрипції p53. Цей ядерний білок р53 регулює багато клітинних функцій, у тому числі - мітотичний цикл, репарацію пошкодженої ДНК, диференциювання клітин та їх загибель шляхом апоптозу. Білок p53 постійно синтезується клітинами, але швидко розщеплюється (період напіврозпаду складає 20 хв); тому концентрація p53 в нормальних клітинах дуже низька. Коли в клітині під дією іонізуючої радіації, ультрафіолетового випромінювання тощо пошкоджується ДНК, вміст білка р53 різко зростає. Активований p53, по-перше, індукує транскрипцію генів WAF1, GADD45 та 14-3-3s, білкові продукти яких приймають участь у зупинці клітинного циклу, що дозволяє клітині забезпечити репарацію пошкодженої ДНК. По-друге, у випадку значних пошкоджень ДНК білок p53 активує експресію проапоптотичних генів, у
тому числі bах, Fas, DR5, PIG1-14 (p53-induced genes), IGF-BP3 (IGF-binding protein 3), p85 та PAG608. Крім цього він здатен подавляти експресію антиапоптичних генів (наприклад, bcl-2 та рецептора IGF-I). По-третє, відмічено існування механізмів ініціації білком p53 апоптозу, які не пов’зані із його транскрипційною активністю, однак ці механізми достатньо не вивчені.
3.Каспазо-залежний шлях. Стосовно клітин тварин та людини апоптоз у більшості випадків пов’заний із протеолітичною активністю каскаду каспаз (caspase) –
