
Радіобіологія фул вершин (передмовалесс, вступлесс етс. едишн)
.pdf
|
|
|
|
|
1 |
ЗМІСТ |
|
|
|
|
|
ПЕРЕДМОВА..................................................................................... |
|
|
|
|
|
ВСТУП............................................................................................... |
|
|
|
|
|
|
|
ЧАСТИНА I |
|
|
|
|
ЗАГАЛЬНА РАДІОБІОЛОГІЯ |
|
|
||
РОЗДІЛ 1. ОСНОВНІ ПОНЯТТЯ В РАДІОБІОЛОГІЇ ТА |
|
|
|||
ВЛАСТИВОСТІ ІОНІЗУЮЧИХ ВИПРОМІНЮВАНЬ…………............... |
|
|
|||
1.1.Загальні |
питання, |
які |
пов'язані |
з |
явищем |
радіоактивності....................................................................... |
|
|
|
|
|
1.2.Природна та штучна радіоактивність…………………………. |
|
|
|||
1.3.Типи іонізуючих випромінювань |
|
|
|
||
1.4.Закон радіоактивного розпаду та одиниці виміру радіоактивності |
|||||
1.5.Взаємодія іонізуючих випромінювань з речовиною |
|
|
|||
1.6.Основні одиниці в радіобіології ………… |
|
|
|
||
РОЗДІЛ 2. ДЖЕРЕЛА ІОНІЗУЮЧОГО ВИПРОМІНЮВАННЯ |
|
|
|||
2.1.Природні джерела іонізуючої радіації.
2.2.Штучні джерела іонізуючої радіації
2.3.Застосування іонізуючих випромінювань у медицині
2.4.Застосування іонізуючих випромінювань
в сільському господарстві 2. 5. Застосування іонізуючих випромінювань в
деяких прикладних галузях науки РОЗДІЛ 3. БІОЛОГІЧНА ДІЯ ІОНІЗУЮЧИХ ВИПРОМІНЮВАНЬ
3.1.Радіаційно-хімічні перетворення речовин
3.2.Основні уявлення про механізми біологічної дії іонізуючої радіації
3.3.Дія іонізуючих випромінювань на біомолекули
3.4.Дія іонізуючих випромінювань на клітини
3.5. Реакція клітин на дію іонізуючих випромінювань 3.6. Дія іонізуючої радіації на системи та тканини живого організму 3. 7 . Дія іонізуючої радіації на рівні організму
3.8.Особливості біологічної дії малих доз іонізуючої радіації
3.9.Генетичні наслідки дії іонізуючих випромінювань РОЗДІЛ 4. РАДІОБІОЛОГІЯ ЛЮДИНИ
4.1.Радіаційне ушкодження людини
4.2.Основні види радіаційних ушкоджень людини
4.3.Особливості надходження та виведення із організму радіоізотопів
4.4.Репродуктивна функція за дії іонізуючої радіації
4.5.Радіопротектори. Класифікація та оцінка ефективності радіозахисної дії
РОЗДІЛ 5. РАДІАЦІЙНО-ГІГІЄНІЧНІ НОРМАТИВИ 5.1. Норми радіаційної безпеки
2
5.2 Допустимі рівні вмісту радіоізотопів
137Cs i 90Sr у продуктах харчування та питній воді
РОЗДІЛ 6. МЕТОДИ РЕЄСТРАЦІЇ ІОНІЗУЮЧИХ ВИПРОМІНЮВАНЬ 6.1 Фізико-хімічні методи реєстрації іонізуючих випромінювань 6.2. Біологічна дозиметрія
РОЗДІЛ 7. МОДЕЛІ РАДІАЦІЙНОГО УРАЖЕННЯ БІОЛОГІЧНИХ ОБ"ЄКТІВ
7.1.Одноударна "модель радіаційного ураження клітини
7.2.Застосувуання номограмм Е.Д. Лі у радіобіології 7.3.Модель багатьох попадань 7.4.Модель багатьох мішеней 7.5.Модель Нормана-Етвуда
7.6.Радіопротекторний та радіосенсибілізаційний ефекти у радіобіології
7.7Моделі відновлення у радіобіології
7.8Модель Новіка -Сцилларда 7.9.Модель відновлення у тварин (Модель Блера-Девідсона)
7.10.Модель відновлення за Циммером
7.11.Післярадіаційне відновлення клітин та визначення параметрів моделі зменшення ефективної дози у процесі відновлення
7.12.Принцип зменшення ефективної дози у радіобіології
РОЗДІЛ 8. ОСНОВИ ТЕОРІЇ НАДІЙНОСТІ БІОСИСТЕМ ТА ІЇ ЗАСТОСУВАННЯ В РАДІОБІОЛОГІЇ
8.1. Принципи аналізу та основні поняття надійності біологічних систем 8.2.Іерархічні системи в біології 8.3. Концепція надійності в радіобіології багатоклітинних систем
8.4.Моделі радіаційного ураження багатоклітинного організму (на прикладі рослини)
8.5.Проблеми кількісної радіобіології багатоклітинних організмів
8.6.Математична модель ростової реакції кореня рослини при опроміненні за участю репопуляційного відновлення
РОЗДІЛ 9. НЕІОНІЗУЮЧІ ВИПРОМІНЮВАННЯ 9.1. Одиниці виміру напруженості електричного
та магнітного полів, індукції магнітного поля, щільності потоку енергії 9.2. Електромагнітні поля природного походження
9.3. Штучні джерела електромагнітних полів
9.4. Розповсюдження в атмосфері ЕМВ
9.5. Особисті електромагнітні поля організмів 9.6. Біологічна дія неіонізуючих ЕМВ 9.7. Дозиметрія неіонізуючих ЕМВ
3
9.8.Нормування неіонізуючих ЕМВ
9.9.Захист від впливу неонізуючих електромагнітних випромінювань
9.10.Інфрачервоне випромінювання
9.11.Видиме світло
9.12.Неіонізуюче ультрафіолетове випромінювання
9.13.Звукові коливання
ЧАСТИНА II РАДІОЕКОЛОГІЯ
РОЗДІЛ 10. ОСНОВИ РАДІОЕКОЛОГІЇ 10.1. Основні поняття та параметри у радіоекології
10.2. Дозиметричні одиниці в радіоекології
10.3. Моделі оцінки поглинених доз опромінення від різних джерел 10.4. Індивідуальна еквівалентна доза
іонізуючого випромінювання 10.5. Колективна еквівалентна доза іонізуючого випромінювання
10.6. Концепція прийнятного ризику та аналіз співвідношення користь-шкода при впливах іонізуючого опромінення 10.7. Проблеми дозиметрії на забруднених радіонуклідами територіях
РОЗДІЛ 11 . КАМЕРНІ МОДЕЛІ В РАДІОЕКОЛОГІЇ 11.1.Блок схеми та шляхи надходження радіонуклідів в екосистеми
11.2. Коефіцієнти накопичення і переходу радіонуклідів у екосистемах 11.3.Метод камерних моделей у радіоекології
11.4.Приклади камерних моделей у радіоекології
11.5.Критичний аналіз основних параметрів у радіоекології РОЗДІЛ 12. ОСНОВИ КОНТИНЕТАЛЬНОЇ РАДІОЕКОЛОГІЇ ТА РАДІОЄМНОСТІ ЕКОСИСТЕМ
12.1. Закономірности осадження радіонуклідів з атмосфери на поверхню Землі.
12.2. Інші шляхи наджодження радіонуклідів в екосистему.
12.3. Коефіцієнти накопичення і переходу радіонуклідів у екосистемах.
12.4. Особливості надходження радіонуклідів та радіоємність агроекосистеми
12.5.Радіоекологія та радіоємність лісової екосистеми.
12.6.Міграція радіонуклідів у наземних екосистемах.
12.7.Водні екосистеми –міграція радіонуклідів
та їх радіо ємність
4
12.8. Особливості міграції радіонуклідів у прісноводних екосистемах.
12.9. Радіоекологія та радіоємність морської екосистеми 12.10. Радіоекологія міст
РОЗДІЛ 13. ЕКОЛОГІЧНЕ НОРМУВАННЯ РАДІАЦІЙНОГО ЧИННИКА 13.1.Зонування дозовового впливу на екосистеми 13.2.Екологічне нормування в озерній екосистемі 13.3.Екологічне нормування для схилової екосистеми 13.4. Екологічне нормування в ландшафті методами аналітичноі ГІС технології 13.5. Контрзаходи в радіоекології
Рекомендована література Термінологічний словник Предметний покажчик
5
ЧАСТИНА I
ЗАГАЛЬНА РАДІОБІОЛОГІЯ
РОЗДІЛ 1. ОСНОВНІ ПОНЯТТЯ РАДІОБІОЛОГІЇ ТА ВЛАСТИВОСТІ ІОНІЗУЮЧИХ ВИПРОМІНЮВАНЬ
1.1Загальні питання, які пов'язані з явищем радіоактивності
На сучасному рівні розвитку науки про будову всесвіту відомі два види матерії – речовина і поле. Вони нерозривно пов’язані між собою і утворюють єдиний матеріальний всесвіт.
Речовина – це форма матерії, яка складається з елементарних частинок (електронів, протонів, нейтронів та ін.), що утворюють атоми та молекули тіла довкілля. Їй характерна наявність маси спокою (маси, коли швидкість частинок дорівнює нулю).
До поля відноситься форма матерії, за допомогою якої відбувається взаємодія між частинками речовини. Йому характерне неперервність в просторі та відсутність маси спокою
Один вид матерії може перетворюється в інший і навпаки. Так, в реакції анігіляції (лат. anhilatio – знищення, перетворювання в ніщо) електрон і позитрон перетворюються в два кванти електромагнітного поля. В той же час, в реакції утворення пар з кванта електромагнітного поля високої енергії (більше 1,022 МеВ), при взаємодії з електричним полем ядра атома, утворюються електрон і позитрон.
Тіла довкілля складаються з простих і складних речовин. До простих речовин відносяться хімічні елементи, а до складних – хімічні сполуки. Найдрібніша частинка хімічних елементів – називається атом (гр. atomos – неподільний) є носієм їх хімічних властивостей. Атоми одного й того ж або різних хімічних елементів утворюють складні комплекси – молекули (лат. moles – маса і cula –суфікс зменшення).
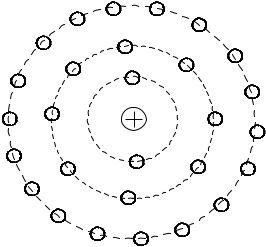
В1911р. Е. Резерфорд розробив модель планетарної будови атому, яка в 1913р. була поглиблена Н. Бором. Згідно з цією моделлю, в середині атома міститься позитивно заряджене ядро навколо якого обертаються негативно заряджені електрони, що складають електронну оболонку атому (рис.1.1).
Лінійні розміри атома визначаються розмірами його електронної оболонки і становлять, приблизно, 10-8см.
Основними складовими частинами ядра є протони та нейтрони (за виключенням атома Гідрогену, ядро якого складається тільки з одного протону). Протони та нейтрони мають загальну назву – нуклони (гр. nucleus – ядро). Нуклон, який електрично нейтральний, називається нейтроном, а електрично заряджений – протоном. В ядрі вони здатні перетворюватися один в одного.
Вядрі між нуклонами діють специфічні ядерні сили зчеплення. Вони виникають в процесі неперервного обміну між нуклонами і частинками, які називаються π- мезонами або піонами (квантами ядерного поля). Ядерні сили – короткодіючі. Вони діють на відстані 10-13см (1фермі).
Протон ( 11 р) – стабільна елементарна частинка з масою 1,00758 атомних одиниць маси (1 а.о.м. дорівнює 1,6724 10-24 г, 1/12 маси ізотопу 12С), і електричним зарядом
6
+1 (позитивної 4,8 10-10 абсолютної електростатичної одиниці). Кожний атом хімічного елементу містить в ядрі певне постійне число протонів, яке визначає фізичні та хімічні властивості елементів. Кількість протонів у ядрі називається
атомним порядковим номером або зарядовим числом (Z). Воно відповідає порядковому номеру хімічного елементу в періодичній системі Д.Менделєєва.
Рис.1.1. Схематична будова атому та його електронних оболонок
Нейтрон (
1 0
n) – електронейтральна елементарна частинка з масою 1,00898
атомних одиниць маси. Нейтрони у вільному стані - нестабільні частинки. Вони розпадаються на протон, електрон та електронне антинейтрино, з періодом напіврозпаду 14,78 хв. В ядрах стабільних легких елементів кількість протонів і нейтронів однакова. Однак, починаючи зі 21 елементу (Скандію), згідно періодичної системи Д.Менделєєва, кількість протонів менша ніж нейтронів. В різних ядрах одного і того ж хімічного елементу може бути неоднакова кількість нейтронів.
Сума протонів і нейтронів в ядрі називається масовим числом (А). Число нейтронів
(N) в ядрі дорівнює різниці між масовим числом і атомним номером хімічного елементу: N=A–Z.
Атоми хімічних елементів прийнято позначати символами цього елементу і вказувати зліва зверху масове число, а зліва знизу – атомний номер у формі індексів:
AZX , де Х – символ елементу. Наприклад, ядро атома Карбона 126 С містить 12
нуклонів, з яких 6 протонів і 6 нейтронів. Атомний номер, як правило, не приводять, тому, що символ елементу вже визначає його положення в періодичній системі Д.Менделєєва.
Електрону оболонку формують електрони (е-) – стійкі елементарні частинки з масою спокою 1/1836 частки маси протона (0,000548 атомної одиниці маси, 9,1 10- 28 г) та електричним зарядом -1. В залежності від енергії, яка утримує електрони навколо ядра, вони групуються на певних електронних орбітах (рівнях, шарах), що і складає електронну оболонку. Електронні орбіти позначають цифрами або буквами
7
латинського алфавіту. Найбільша кількість орбіт – це сім: K, L, M, N, O, P і Q. Найближча до ядра орбіта К (містить не більше двох електронів), далі L (до 8-ми електронів), М (до 18-ти електронів) і т.д. (рис.1.1). Число електронів на орбітах, за звичайних умов, відповідає кількості протонів у ядрі, а тому атом загалом електронейтральний.
На електрон, що рухається навколо позитивно зарядженого ядра діє електростатична (кулонівська) сила, яка притягує його до ядра, а також рівна їй відцентрова сила інерції, що намагається відірвати електрон від ядра. Крім того, орбітальні електрони мають власний момент кількості руху (спін), який призводить до обертання навколо власної осі. Окрім цього, існує сила відштовхування електронів між собою. Чим далі електронна орбіта від ядра тим слабше енергетичний зв’язок цих електронів з ядром.
При отриманні орбітальними електронами додаткової енергії вони здатні переходити з одного енергетичного рівня (орбіти) на інший або навіть залишати межі атому. Якщо кількість наданої орбітальним електронам енергії менша, за енергію їх зв’язку з ядром, то електрони перейдуть на один з більш енергетичних рівнів. У цьому випадку атоми називаються збудженими, а перехід електронів з одного енергетичного рівня на інший, який більш віддалений від ядра – процесом збудження.
Як відомо, у природі будь-яка система прагне зайняти положення, за якого її енергія буде найменшою, тому атоми, які знаходяться у збудженому стані намагаються перейти у стабільний. Повернення атомів у стабільний стан супроводжується виділенням надлишкової енергії. Якщо надана орбітальним електронам енергія більша за енергію їх зв’язку з ядром, то ці електрони залишають межі атому, тобто спостерігається явище іонізації – утворення іону. Атом, який втрачає електрони, перетворюється на позитивно заряджений іон, а який їх приєднує
– від’ємно заряджений.
За звичайних умов іони існують короткий час, оскільки вільне місце на орбіті позитивного іону заповнюється вільним електроном, і атом знову стає електронейтральним. Цей процес називається рекомбінацією іонів (деіонізацією) і супроводжується виділенням надлишкової енергії. Від’ємно заряджені іони теж здатні випромінювати надлишкові електрони. Таким чином, положення електронів на орбітах електронної оболонки визначає здатність атомів до збудження, іонізації та випромінювання енергії.
Атоми, які мають однакову кількість протонів в ядрі (однаковий атомний номер) але розрізняються за числом нейтронів (масовому числу), називаються ізотопами (гр. isos – однаковий і topos – місце). Таким чином ізотопи - це атоми з однаковими атомними номерами, але різними масовими числами. Так, наприклад, карбон має 8 ізотопів – 9С, 10С, 11С, 12С, 13С, 14С, 15С, 16С. Всі хімічні елементи мають ізотопи. Для ізотопів одного хімічного елементу притаманні однакові хімічні властивості, оскільки їх електронні оболонки побудовані однотипово. В той же час вони відрізняються за фізичними властивостями, зокрема стабільністю (стійкістю), а також розповсюдженням.
Атоми хімічного елементу з однаковим масовим числом і атомним номером, ядра яких знаходяться у різних енергетичних станах, називаються ізомерами (гр. isos – однаковий і meros – частка). Для нестабільних ядер, які здатні до розпаду, ізомерами є ті, що мають різні періоди напіврозпаду, вид та енергію випромінювання. Ізомери з

8
надлишком енергії ядра знаходяться в метастабільному стані, який позначають латинською літерою “m”, що ставиться поряд з масовим числом. Так, наприклад, у хімічного елементу 60Со період напіврозпаду 5,3 роки, а 60mСо – 10,7 хв. Ядро метастабільного ізомеру переходить в основний стан у результаті віддачі надлишку енергії.
Існують у природі хімічні елементи, з однаковими масовими числами, але з різними атомами номерами. Їх називають ізобарами (гр. isos – однаковий і baros – важкість, вага). Вони мають різну кількість електронів в оболонці, оскільки у них неоднакове число протонів, та займають різні місця у періодичній системі елементів. Ізобари характеризуються відмінностями хімічних та фізичних властивостей, наприклад, ізотопи 40As, 40K, 40Ca.
Хімічні елементи з рівним числом нейтронів в ядрі, але різним протонів, називаються ізотонами (гр. isos – однаковий і tonos – напруга). Такими є, наприклад, ізотопи 13С (ядро містить 6 протонів та 7 нейтронів) та 14N (ядро містить 7 протонів та 7 нейтронів). Ізотони мають відмінні хімічні властивості, оскільки містять різну кількість протонів і відповідно їм число електронів в оболонці, але фізичні властивості, які визначаються однаковою кількістю нейтронів, можуть бути подібними.
1.2.Природна та штучна радіоактивність
Нестабільні ізотопи, перетворення ядер яких супроводжується радіоактивним випромінюванням, називаються радіонуклідами або радіоізотопами. На даний момент відомо приблизно 1700 ізотопів, серед яких близько 270 є стабільними, а решта – радіоактивними.
Анрі
Беккерель |
Вільгельм Конрад Рентген |
Речовини, яким притаманне явище радіоактивності, називають радіоактивними. Явище радіоактивності (радіоактивного розпаду ядер хімічних елементів) було відкрито А. Беккерелем в 1896р. при дослідженні солей урану. Через два роки М.Складовська-Кюрі та П.Кюрі виділили із уранової смоли елементи (їм дали назву радій та полоній) яким також властиве явище радіоактивності.
Радіоактивне випромінювання невидиме. Воно реєструється на основі протікання різних процесів, які виникають в результаті дії на речовину (іонізація, свічення люмінофорів, почорніння фотоемульсій після прояву та ін.).

9
Марія Складовська-Кюрі |
Пьєр Кюрі |
Розрізняють природну та штучну радіоактивність. Початком дослідження природної радіоактивності слугувало відкриття випромінювання урану та торію. Виявлення Ірєн та Фредерік Жоліо-Кюрі (у 1934 р.), при дослідженні ядерної реакції нового, не існуючого у природі радіонукліда (фосфору 30Р) – слугувало початком дослідження штучної радіоактивності У цьому розділі розглянемо тільки загальні уявлення радіоактивності. Більш детальний опис наведено у розділі 2.
Природна радіоактивність притаманна радіонуклідам природного походження. Вони містяться у малих кількостях у породах земної кори, грунті, воді, повітрі, а також живих організмах.
Сучасну природну радіоактивність Землі визначають радіонукліди, які утворилися з моменту їх виникнення. Насамперед, це радіонукліди, які входять до родин урану (238U), актинію (235U або 235Ac), торію (232Th). Родоначальником родини актинію є 235U, який раніше називали актиноураном (АсU). Оскільки серед членів цієї родини є радіоізотоп актинію (227Ас), то ця родина і отримала назву родини актинію або актинію-урану. 238U зазнає 14 послідовних перетворень, 235U – 11, а 232Th – 10. Кінцевими продуктами розпаду цих радіоізотопів є стабільні ізотопи свинцю.
Іншу групу утворюють радіоактивні елементи, які не входять до складу цих радіоактивних родин. Серед них у формуванні природної радіоактивності суттєве місце належить 40К. У природній суміші трьох ізотопів калію міститься і 0,0119% цього радіонукліду. Природна радіоактивність Землі визначається також радіонуклідами рубідію (82Rb), індію (115In), лантану (138La), самарію (159Sm), лютецію (176Lu) та ренію (186Re), які мають великий період напіврозпаду.
Космічне випромінювання поділяють на первинне і вторинне. Первинне сонячне космічне випромінювання становить, в основному, рентгенівське випромінювання. Проте при інтенсивних спалахах на Сонці випромінюється також значна кількість заряджених частинок, здебільшого протонів і -частинок, а також нейтронів та “швидких” ядер легких елементів.
Під час взаємодії первинного космічного випромінювання з ядрами атомів атмосфери, виникає вторинне випромінювання, яке називають вторинним космічним випромінюванням. За рахунок високоенергетичного первинного космічного випромінювання утворюється нейтрони, протони і мезони. Більшість

10
частинок вторинного космічного випромінювання має енергію, якої досить, щоб у подальшому спричинити ряд взаємодій з ядрами Гідрогену, Нітрогену, Оксигену, Карбону, Берилію, Натрію тощо, які є в атмосфері. Наслідком цього утворення радіоізотопів 3Н, 7Ве, 10Ве, 22N, 24Na, 14C та ін.
Крім космогенних радіоізотопів, в атмосферному повітрі є невелика кількість земних радіоізотопів у вигляді газів і аерозолей. Насамперед це родон (222Rn), джерелом якого є 226Ra, що міститься в гірських породах і грунті. Іншим радіоізотопом, що формує радіаційний фон атмосферного повітря є торій (230Th). Радій є продуктом розпаду наступних радіонуклідів: 238U - 226Ra, 235U - 223Ra і 232Th – 224Ra. Середня концентрація радію в гірських породах складає 10-13 кг/кг породи.
Штучна радіоактивність – це радіоактивність ізотопів, які виникають внаслідок ядерних реакцій. Сутність ядерних реакцій полягає в тому, що ядра-мішені стабільних атомів бомбардують елементарними частинками (протонами, нейтронами, α-частинки та ін.), які ними захоплюються. Наслідком цього є утворення збудженого ядра за рахунок надлишку кінетичної енергії частинок, яким бомбардували ядрамішені. Перехід ядра зі збудженого стану в стабільний супроводжується випромінюванням надлишків енергії у такому ж вигляді, як і при радіоактивному розпаді.
Бомбардування ядер-мішеней усіма можливими частинками супроводжується перетворенням одного хімічного елементу в інший. За такого перетворення хімічних елементів внаслідок ядерних реакцій, можуть утворюватися елементи не притаманні Землі. Такі хімічні елементи отримали назву штучних елементів. На даний момент у ядерних реакціях синтезовано 14 штучних хімічних елементів, які є радіоактивними.
Ірєн Жоліо-Кюрі |
Фредерік Жоліо-Кюрі |
Виділяють наступні типи радіоактивного розпаду, які супроводжують перетворення ядер хімічних елементів: альфа-розпад, бета-розпад (електронний або
позитронний), гамма-розпад, внутрішня конверсія, електронне захоплення, спонтанний поділ ядер. У процесі термоядерних реакцій з ядер легких хімічних лементів, утворюються ядра більш важких, що супроводжується випромінюванням протонів. Термоядерні реакції на Землі є штучними.
Альфа-розпад ( -розпад) – тип спонтанного радіоактивного перетворення, який притаманний, в основному, природним ядрам важких хімічних елементів (з атомним
