
Основные расчетные формулы молярных масс эквивалентов сложных веществ
Молярная масса эквивалентов элемента в соединении АаВв:
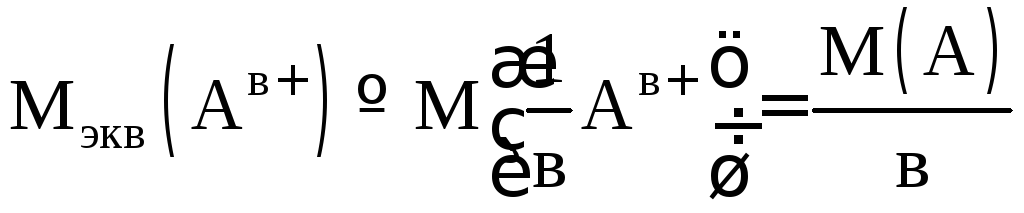 ,
,
где в – эквивалентное число.
Молярная масса эквивалентов оксида А2Ов:
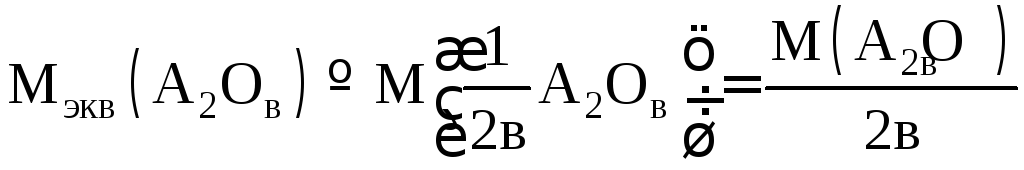 .
.
Молярная масса эквивалентов кислоты НаВ:
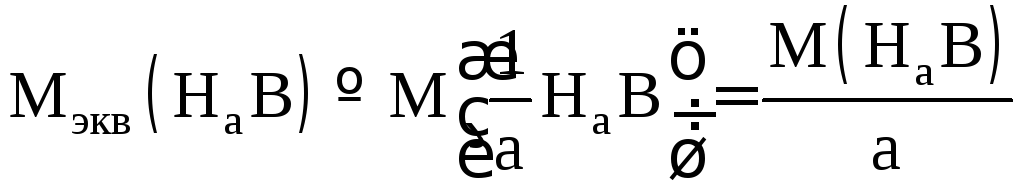 ,
,
где а – основность кислоты.
Молярная масса эквивалентов основания А(ОН)в:
 ,
,
где в – кислотность основания.
Молярная масса эквивалентов соли АаВв:
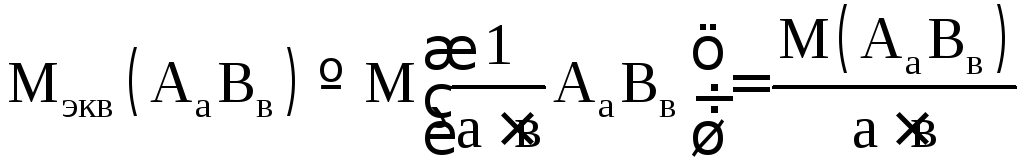 .
.
Моль любого газа при нормальных условиях занимает объем Vm= 22,4 л. Соответственно, для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов в одном моле газа. Например, в реакции окисления водорода
![]()
Э![]() ,
поэтому
,
поэтому![]() ,
значит один моль эквивалентов водорода
занимает при нормальных условиях объем
,
значит один моль эквивалентов водорода
занимает при нормальных условиях объем
![]() л.
л.
Объем одного моля эквивалентов кислорода в реакции восстановления
![]()
равен 22,4 : 4 = 5,6 л, т.к. Э![]() ,
,![]() .
Объем эквивалентов вещества определяется
формулой:
.
Объем эквивалентов вещества определяется
формулой:
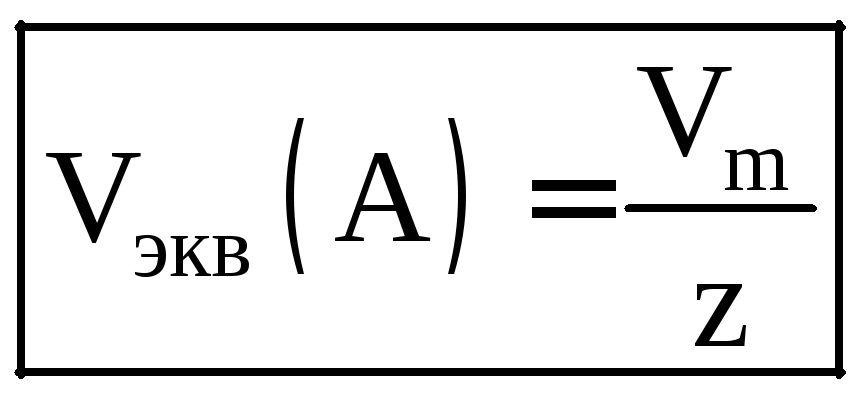
(для водорода – 11,2 л/моль, для кислорода – 5,6 л/моль).
-
Закон эквивалентов:вещества реагируют друг с другом в эквивалентных соотношениях, т.е. моль эквивалентов одного вещества реагирует с молем эквивалентов другого вещества.
Например, в реакции:
![]()
![]() ;
;![]()
![]() ;
;![]() ,
,
т.е. один моль эквивалентов цинка (![]() мольZn) реагирует с одним
молем эквивалентов кислоты (1 мольHCl)
с образованием одного моля эквивалентов
хлорида цинка (
мольZn) реагирует с одним
молем эквивалентов кислоты (1 мольHCl)
с образованием одного моля эквивалентов
хлорида цинка (![]() мольZnCl2). В соответствии
с законом эквивалентов количество
веществ эквивалентов реагирующих
соединений равны:
мольZnCl2). В соответствии
с законом эквивалентов количество
веществ эквивалентов реагирующих
соединений равны:
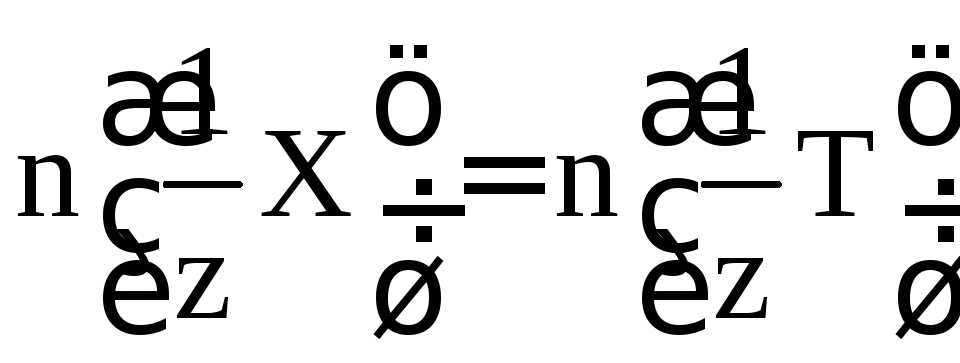 ,
,
где Т – вещество, вступающее в реакцию с анализируемым соединением.
Раствор, содержащий один моль эквивалентов вещества в литре, называется «нормальным». Нормальная концентрация раствора выражается в кмоль/м3или моль/л и обозначается «Н» или «N». Закон эквивалентов для реакции:
mA+nB=AmBn,
протекающей в растворе, можно записать следующим образом:
![]() ,
,
где VAиVB– объемы реагирующих растворов; NАиNВ– их нормальные концентрации.
Закон эквивалентных отношений можно выразить формулой:
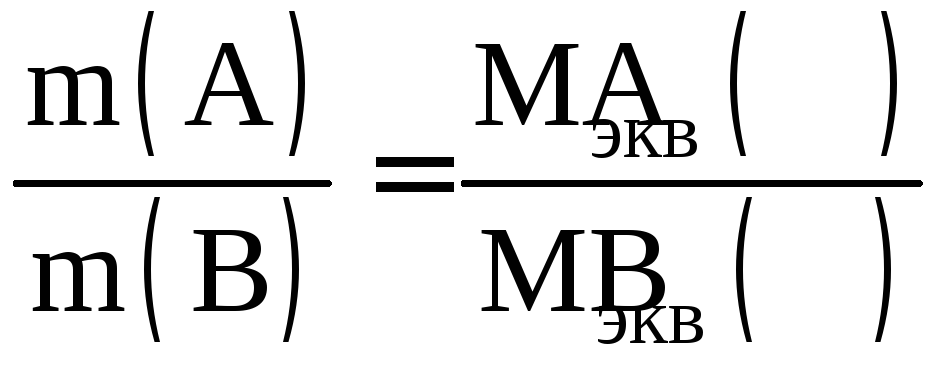 .
.
Определение количества вещества эквивалентов А
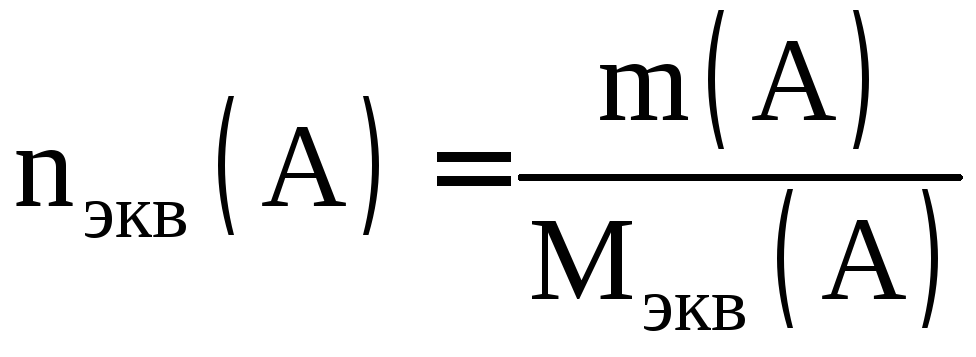 .
.
Для удобства расчетов в аналитике
используют вспомогательный способ
выражения состава раствора – молярную
концентрацию эквивалента
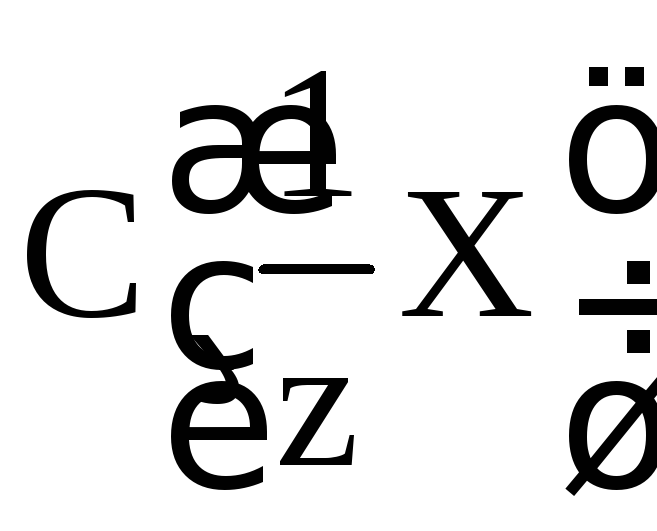 :
:
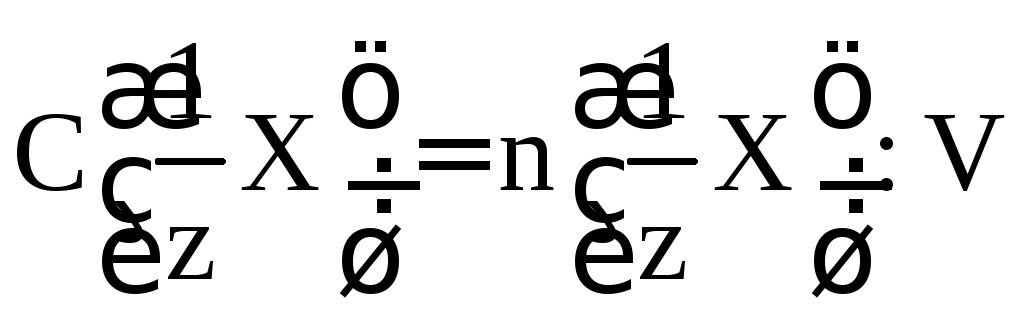 .
.
2.2 Экспериментальная часть
Метод определения молярной массы эквивалента (Al,Mg,Zn) основан на измерении объема водорода, который выделяется из кислоты при действии на нее активного металла.
П рименяемый
для этой цели прибор (рис.2.1) состоит из
бюретки 1 для измерения объема водорода,
уравнительного сосуда 2 и реакционной
пробирки 3, укрепленных на штативе 4
и соединенных резиновым шлангом 5. В
такой сообщающийся сосуд наливают воду
приблизительно до половины бюретки.
рименяемый
для этой цели прибор (рис.2.1) состоит из
бюретки 1 для измерения объема водорода,
уравнительного сосуда 2 и реакционной
пробирки 3, укрепленных на штативе 4
и соединенных резиновым шлангом 5. В
такой сообщающийся сосуд наливают воду
приблизительно до половины бюретки.
Объем выделившегося водорода определяют по разности уровней воды в бюретке до и после опыта при давлении в закрытой бюретке, равном атмосферному. Давление газа в закрытой бюретке равно атмосферному, если вода в бюретке и уравнительном сосуде находится на одном уровне.
Пар над поверхностью воды обладает
определенным давлением
![]() при данной температуре (Т). Это следует
учитывать при вычислении объема водорода,
собранного в бюретке над водой. Поэтому
для определения парциального давления
водорода
при данной температуре (Т). Это следует
учитывать при вычислении объема водорода,
собранного в бюретке над водой. Поэтому
для определения парциального давления
водорода![]() необходимо от общего атмосферного
давления вычесть давление насыщенного
водяного пара
необходимо от общего атмосферного
давления вычесть давление насыщенного
водяного пара![]() (см. приложение 1):
(см. приложение 1):
![]() .
(2.1)
.
(2.1)
Для приведения объема выделившегося водорода к нормальным условиям используют уравнение газового состояния:
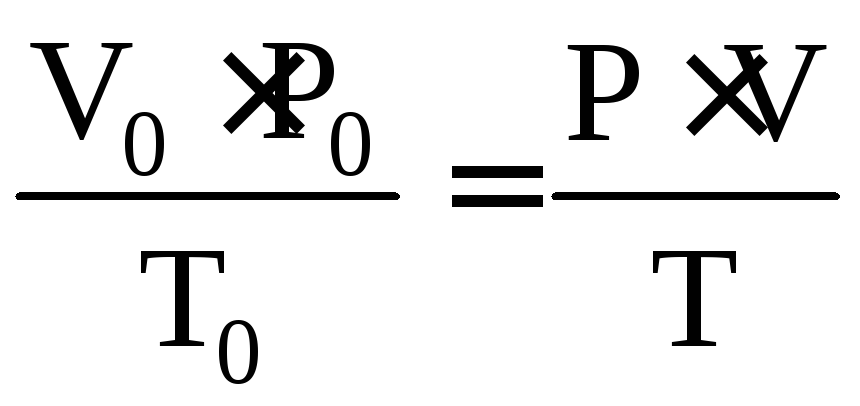 ,
(2.2)
,
(2.2)
где V0– объем
водорода при н.у., мл; Р0– парциальное
давление водорода при н.у., равное 760 мм
рт. ст. (101,3 кПа); Т0– температура,
273 К;V– объем водорода
при данных условиях, мл; Р – парциальное
давление водорода при условиях опыта,
равное![]() ,
мм рт. ст. (кПа); Т – температура опыта,
К.
,
мм рт. ст. (кПа); Т – температура опыта,
К.
Определив объем водорода при н.у., вычисляют массу одного моля эквивалента металла: mГметалла вытесняютV0мл водорода, МЭметалла вытесняют 11200 мл Н2.
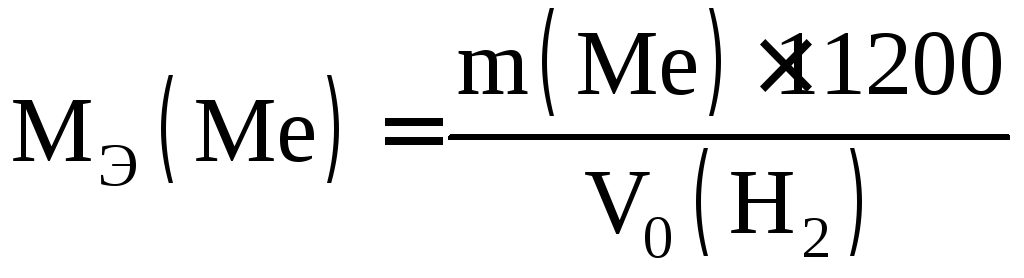 . (2.3)
. (2.3)
Можно не приводить объем вытесненного водорода к н.у., а использовать уравнение Менделеева-Клапейрона
![]() . (2.4)
. (2.4)
С помощью этого уравнения можно объем
водорода
![]() пересчитать на массу водорода
пересчитать на массу водорода![]() .
.
Расчет МЭ(Ме) производится на основании закона эквивалентов
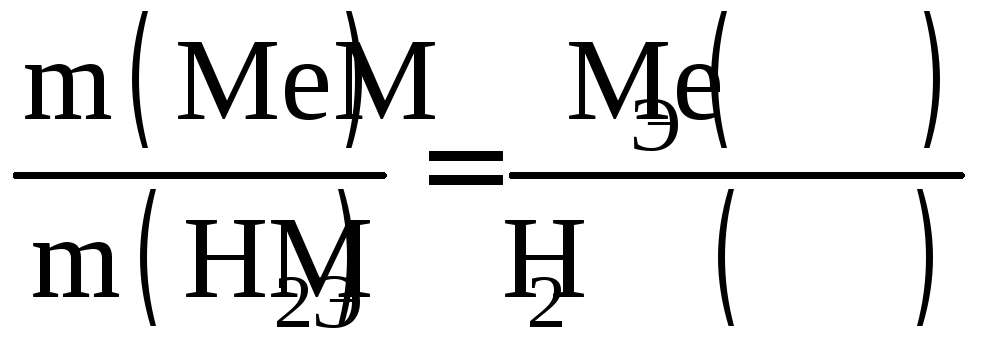 .
(2.5)
.
(2.5)
Работа выполняется в следующей последовательности:
– Ознакомьтесь с прибором для определения молярной массы эквивалента металла.
– Зарисуйте схему прибора (рис.2.1), обозначьте основные его части.
– Получите у лаборанта навеску металла, взвешенную на аналитических весах с точностью до 0,0001 г (m, г).
– Налейте в реакционную пробирку разбавленную серную кислоту (около 1/3 пробирки). Стенки пробирки должны быть сухими (капли кислоты убрать с помощью фильтровальной бумаги).
– Поддерживая пробирку в наклонном положении, поместите навеску металла (не опуская в кислоту) на стенку у отверстия пробирки и осторожно присоедините реакционную пробирку к бюретке так, чтобы металл не упал в кислоту.
– Проверьте герметичность прибора. Для этого, не трогая бюретку с пробиркой переместите воронку вместе с кольцом штатива на 5-10 см выше, чем уровень воды в бюретке. Если разница в уровнях не изменяется, прибор герметичен.
– Приведите воду в бюретке и воронке к одинаковому уровню и отметьте уровень воды в бюретке (h1, мл). Отсчет производите по нижней точке мениска воды с точностью до 0,1 мл.
– Опустите реакционную пробирку и стряхните металл в кислоту. Наблюдайте выделение водорода и вытеснение воды из бюретки.
– По окончании реакции приведите воду в бюретке и воронке к одинаковому уровню. Запишите новый уровень воды в бюретке (h2, мл).
– По разности уровней воды до и после
реакции рассчитайте объем выделившегося
водорода
![]() .
.
По данным опыта определите молярную массу эквивалента металла. Сравнивая ее с теоретическим значением молярной массы эквивалента металла (Al,Mg,Zn), определите какой металл был взят для реакции.
Запишите в журнал: навеску металла, г; уровень воды в бюретке до и после реакции, мл; температуру, К; атмосферное давление, мм рт. ст.; давление водяного пара, мм рт. ст.; давление водорода, мм рт. ст.
По полученным данным рассчитайте:
1) объем выделившегося водорода;
2) объем водорода при н.у.;
3) массу водорода;
4) теоретическую молярную массу эквивалента Al,Mg,Zn;
5) экспериментальную молярную массу эквивалента металла;
6) относительную ошибку опыта
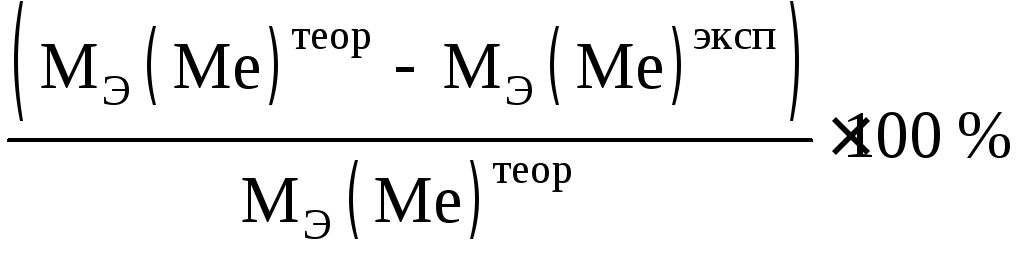 . (2.6)
. (2.6)
Исходные данные и результаты работы запишите в форме таблицы 2.1.
Таблица 2.1
|
Экспериментальные данные |
Расчетные данные | |||||||||||
|
Навеска металла m (г) |
Т, К |
Ратм, мм рт.ст. |
мм рт.ст. |
мм рт.ст. |
h1, мл |
h2, мл |
|
|
|
МЭ(Ме), експ. |
МЭ(Ме), теор.. |
Ошибка, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Все расчеты подробно приведите в журнале. Запишите уравнение реакции взаимодействия металла с серной кислотой, зарисуйте прибор, сделайте вывод.
