
Определение молярной массы эквивалента металла (Mg, Al или Zn) методом вытеснения водорода
Цель работы:ознакомление с понятием эквивалента вещества и методикой расчета, связанной с законом эквивалентов.
2.1 Теоретическая часть
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим образом эквивалентна (равноценна) одному иону водорода (Н+) в кислотно-основных или ионно-обменных реакциях или одному электрону (е–) в окислительно – восстановительных реакциях. Так же, как молекула, атом или ион, эквивалент безразмерен. И так же, как в случае молекул, атомов или ионов, состав эквивалента выражают с помощью химических знаков и формул.
Для того, чтобы определить состав эквивалента вещества и правильно записать его химическую формулу, надо исходить из конкретной реакции, в которой участвует данное вещество.
Рассмотрим несколько примеров определения формулы эквивалента.
![]() . (а)
. (а)
С одним ионом водорода реагирует один
ион гидроксила, поэтому Э![]() .
.
![]() . (б)
. (б)
В реакции (б) один ион водорода эквивалентен
1/2 иона кальция, одному иону
![]() и одному иону
и одному иону![]() .
Следовательно Э
.
Следовательно Э![]() ;
Э
;
Э![]() ;
Э
;
Э![]() .
.
Запишем уравнение этой реакции в молекулярной форме:
![]() .
.
Одному иону Н+эквивалентна 1/2
молекулы Са(ОН)2, следовательно,
Э![]() .
В реакции
.
В реакции
![]() (в)
(в)
эквиваленты AlCl3иAlNO3 можно определить косвенным путем, введя вспомогательные реакции:
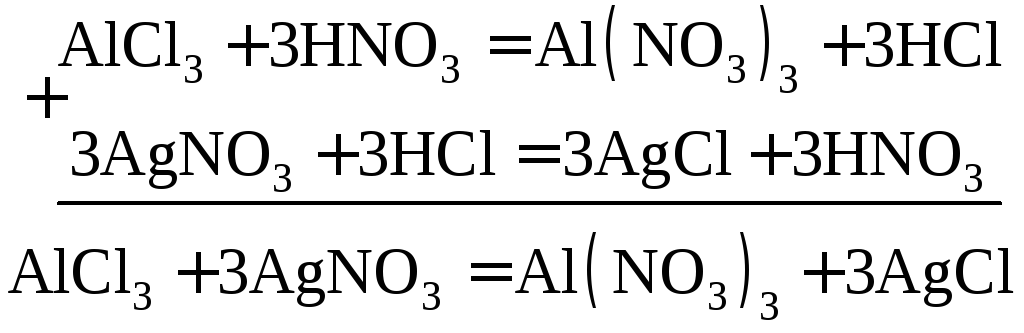
Одному иону водорода (Н+) эквивалентна
1/3 молекулыAlCl3и
молекулаAgNO3,
следовательно Э![]() ;
и Э
;
и Э![]() .
.
![]() . (г)
. (г)
В этой окислительно-восстановительной
реакции с одним ионом цинка взаимодействуют
два электрона. Поэтому эквивалент
![]() Э
Э![]()
![]() . (д)
. (д)
В этом случае один ион
![]() реагирует с тремя электронами и,
следовательно, Э
реагирует с тремя электронами и,
следовательно, Э![]()
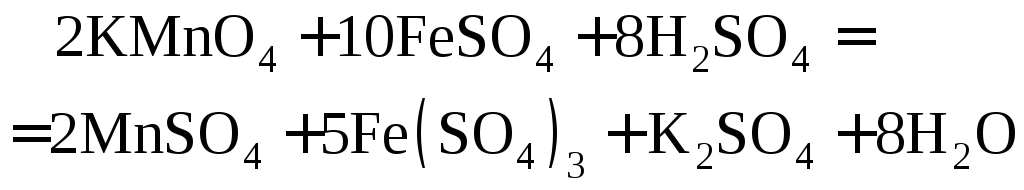 (е)
(е)
В данной окислительно-восстановительной
реакции атом марганца
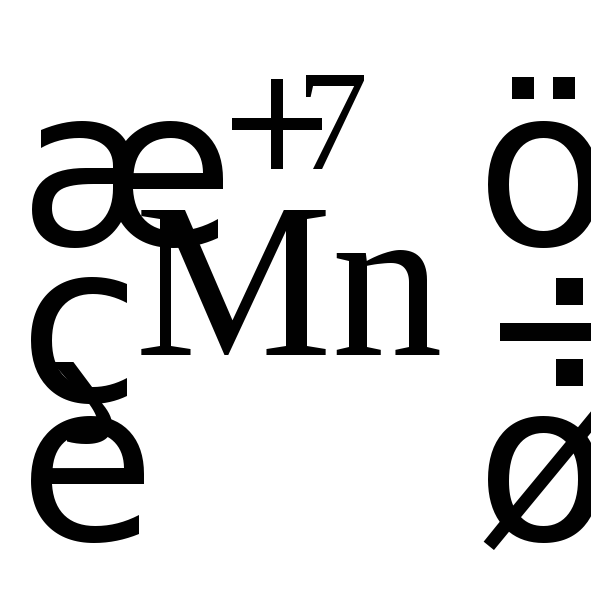 в молекулеKMnO4принимает пять электронов и превращается
в марганец со ст. ок. +2
в молекулеKMnO4принимает пять электронов и превращается
в марганец со ст. ок. +2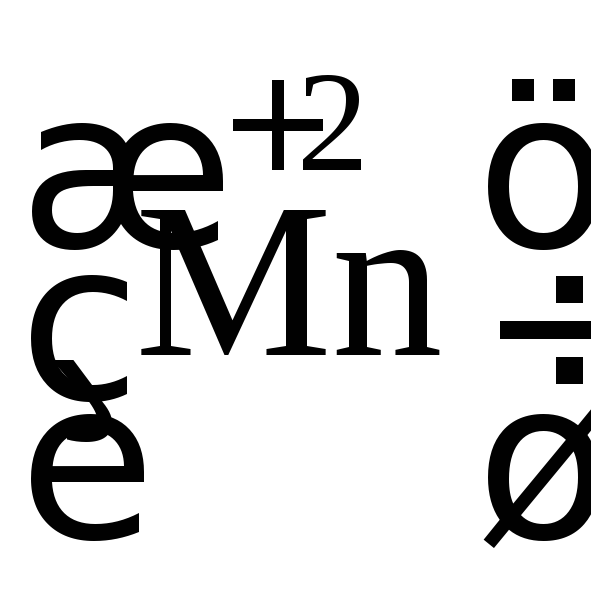
![]() .
.
В молекуле FeSO4атом
железа![]() отдает один электрон и превращается в
железо со ст. ок. +3
отдает один электрон и превращается в
железо со ст. ок. +3
![]() .
.
Поэтому Э![]() ;
;
Э![]() .
.
Величина, показывающая какая доля
реальной частицы соответствует
эквиваленту, получила название фактора
эквивалентности
![]() ,z– всегда целое положительное
число и называется эквивалентное число.
,z– всегда целое положительное
число и называется эквивалентное число.
В обменных реакциях величина zравна суммарному заряду обменивающихся ионов, т.е.z = число ионов заряд иона. В реакции
![]() (ж)
(ж)
 .
.
В реакции (б)
![]() ;
в реакции (д)
;
в реакции (д)![]() .
.
Количество вещества измеряют в молях.
Один моль эквивалентов содержит столько
же эквивалентов, сколько атомов углерода
содержится в 0,012 кг углерода – 12, т.е.
6,02 ∙ 1023атомов. Количество вещества
эквивалентов определяется формулой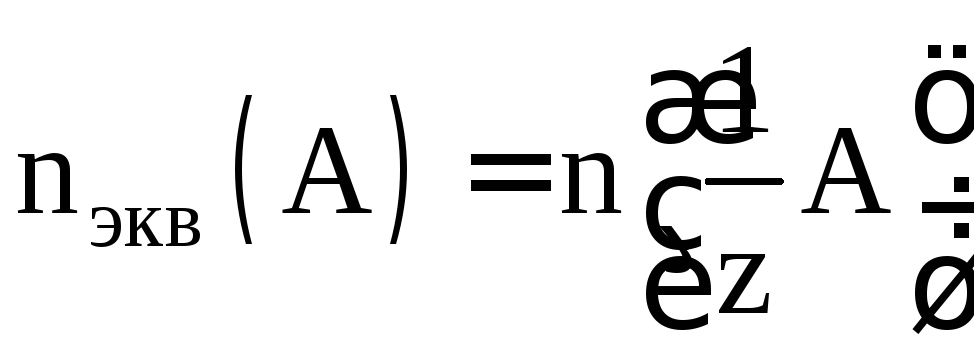 .
Масса моля эквивалентов называется
молярной массой эквивалента Мэ.
.
Масса моля эквивалентов называется
молярной массой эквивалента Мэ.
Например, молярные массы эквивалентов в рассматриваемых ранее реакциях равны:
![]() г/моль;
г/моль;
![]() г/моль и т.д.
г/моль и т.д.
Молярная масса эквивалентов вещества определяется формулой:

(для водорода – 1 г/моль; для кислорода – 8 г/моль).
Состав эквивалента вещества зависит от реакции, поэтому молярная масса эквивалента одного и того же вещества может быть разной. Например, молярная масса эквивалента FeSO4в реакции
FeSO4+ 2HCl=FeCl2+H2SO4
равна 75,925 г/моль, т.к. Э![]() ,
т.е.
,
т.е.
![]() г/моль = 75,925 г/моль,
г/моль = 75,925 г/моль,
а в реакции
![]() ;
;
![]()
Э(FeSO4) =FeSO4; МЭ(FeSO4) = М(FeSO4) = 151,85 г/моль.
