
МУ КР Источники энергии
.pdf2. МЕТОДИКА РАСЧЕТА КПД КОТЛОАГРЕГАТА
Для определения КПД котельного агрегата применяются два метода – прямой и обратный.
2.1 Прямой метод определения КПД
Прямой метод определения КПД базируется на измерениях количества подведенного и полезно использованного в установке тепла.
Тепловые потери при прямом определении КПД, помимо своего основного назначения – характеристики работы котлового агрегата, являются средством оценки точности определения КПД.
При определении КПД прямым методом:
|
0,96 D (i" |
i |
п.в. |
) |
|
(1.1) |
|
п.п |
|
|
100%, |
||
Qнр B |
|
|
|
|||
|
|
|
|
|
|
где η- КПД агрегата;
iп".п,iп.в. – теплосодержание перегретого пара и питательной воды
соответственно, кДж/кг;
Qнр - низшая рабочая теплотворная способность топлива, кДж/м3,
(кДж/кг);
В – расход топлива, м3/c, (кг/c);
D – произведенное количество пара, кг/с;
0,96 – коэффициент, учитывающий затраты тепла на собственные нужды
котельной;
Точность определения КПД прямым методом:
|
|
1 |
D 1 iп".п iп.в. 1 iп".п iп.в. |
, |
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
Qр 1 Qр B 1 B |
|
|
|
|||||||
|
|
|
|
|
|
|
|
н |
н |
|
|
|
|
|
||||
1 |
1 D 1 iп".п |
iп.в. |
(1.2 ) |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
1 Qнр B 1 B |
|
|
|
|
|
||||||||
|
|
; |
i" |
,i |
|
|
iп".п,iп.в. |
; D |
D |
; Qр |
Qнр |
, |
|
|
||||
|
|
|
п.п |
|
п.в. |
|
|
iп".п ,iп.в. |
|
D |
н |
Qнр |
|
|
|
|||
где iп".п ,iп.в. , Qнр , В, |
η, |
D – абсолютные ошибки при определении |
||||||||||||||||
соответствующих величин;
iп".п ,iп.в. , Qнр , В, η, D – относительные ошибки тех же величин.
21
2.2 Обратный метод определения КПД
Обратный метод определения КПД котлового агрегата основывается на измерениях потерь тепла, которые в этом случае являются не только характеристикой работы агрегата, а также основными величинами, определяющими величину КПД.
Разницамежду100%исуммойтепловыхпотерь,выраженныхвпроцентах,будет КПД:
обр 100 q2 |
q3 |
q4 |
q5 |
100 q , |
(2.1) |
где qх -определенныйвидтеплопотерь,расчеткоторыхбудетрассматриватьсяниже,%;
Отклонение от истинной суммы тепловых потерь составит:
q обр 
 q42 q32 q22 q52
q42 q32 q22 q52
|
|
|
q |
|
|
q4 |
|
q4 |
2 |
|
|
|
|
|
|
|
|||
q |
|
|
ОБР |
|
q4 |
|
q |
|
|
|
q |
|
|
|
|
||||
|
q |
3 |
|
q |
3 |
2 |
|
q |
2 |
|
q |
2 |
2 |
|
q |
5 |
|
q |
5 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
q |
|
|
|
q |
|
|
|
q |
|||||||||
|
q3 |
|
|
|
|
q2 |
|
|
|
|
q5 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
a42 q42 a32 q32 a22 q22 a52 q52 |
(2.2) |
a4 |
q4 |
…. и т.д. – долевое участие потери в сумме потерь тепла; |
||
q |
||||
q4 q4 … и т.д. – величина ошибки относительно истинного значения потери. q4
Таблица 2.1
|
Значения потерь |
Значения коэффициента |
Относительная |
|||
Наимеование потерь тепла |
долевого участия потери |
величина |
||||
|
|
|||||
|
qmin ,% |
qmax ,% |
amin q |
amax q |
q,% |
|
С уходящими газамиq2 |
8 |
10 |
0,70 |
0,51 |
±15,0 |
|
Отхимическогонедожегa q3 |
1,5 |
1,5 |
0,12 |
0,06 |
±50 |
|
Отмеханическогонедожегa q4 |
1,0 |
10,0 |
0,09 |
0,38 |
±25 |
|
В окружающую среду q5 |
1,0 |
1,0 |
0,09 |
0,04 |
±50 |
|
Сумма потерь q |
11,5 |
25,5 |
1,0 |
1,0 |
±12,6 |
|
Абсолютная ошибка в определении суммы потерь, или, что |
то же самое, |
|
абсолютная ошибка в определении КПД методом обратного баланса, составит: |
||
q OBP q q 0,126 q |
(2.3) |
|
При истинных значениях КПД котлоагрегата 80% и выше обратный метод точнее прямого, что наглядно представлено наРис2.1.
Рис2.1.Вероятнаяабсолютная погрешностьвопределенииКПД котлоагрегата
1–присведениибалансапрямымметодом;
2–присведениибалансаобратнымметодом.
3,6 |
|
|
1 |
|
|
|
|
3,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,8 |
|
|
|
|
|
|
|
Δη, %2,4 |
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,6 |
|
|
|
|
|
|
|
1,2 |
|
|
|
|
|
|
|
76 |
78 |
80 |
82 |
84 |
86 |
88 η, % 90 |
|
24 |
|
20 |
|
16 |
|
∑q, % |
10 |
22
Для определения КПДметодом обратного баланса необходимо:
1)определить низшую теплотусгорания топлива;
2)расчет воздуха по химическомусоставу;
3)расчет продуктовгорения;
4)определить и рассчитать теплопотери.
2.2.1Расчетный метод определения низшей теплоты сгорания
Газообразное топливо
Q Р |
127 ,7 CO |
|
108 H |
|
358 |
CH |
|
|
590 C |
|
H |
|
|
636 C |
|
H |
|
|
(2.4) |
|
Н |
|
2 |
|
2 |
|
|
4 |
|
|
|
2 |
|
4 |
|
|
2 |
|
6 |
|
|
913C3 H 8 1185 |
C4 H10 |
1465 |
C5 H12 234 |
H 2 S, кДж/м 3 |
|
|
|
|
|
|||||||||||
QНР 30,5 CO 2 |
25,8 H 2 85,5 CH 4 |
141 C2 H 4 |
152 |
C2 H 6 |
|
|||||||||||||||
|
218 C3 H 8 283 C4 H10 |
350 |
C5 H12 |
56 |
H 2 S, ккал/м 3 |
|
|
|
|
|
||||||||||
где 127,7; 30,5 – тепло, выделяемое при сгорании 1% (по объему) СО, кДж, ( ккал);
108, 358, 590…; 25,8, 85,5, 141… - аналогичныевеличины для H2 ,CH4 ,C2H4 …и
т.д.;
H2 ,CH4 ,C2H4 … - содержание горючих составляющих топлива, % (по объему).
Для перевода на рабочий состав каждый горючий элемент топлива умножается на коэффициент:
|
Кс-в = |
100 |
, |
(2.5) |
|
|
|||
|
100 WПР |
|
||
где Wпр [м3/м3]= Wпр [г/м3]·0,1242 – влажность топлива. |
||||
|
Твердое и жидкое топливо |
|
||
|
Формула Менделеева Д.И. (пригодна для всех типов топлива): |
|||
|
QHP 340CP 1260H P 109(OP SP ) 25 W P , кДж/кг, |
|||
или |
|
|
|
(2.6) |
|
QHP 81CP 300H P 26(OP SP ) 6 W P , ккал/кг. |
|||
где |
CP , H P , OP ,SP - содержание элементов рабочего топлива, % по массе; |
|||
|
W - содержание влаги в топливе. |
|
||
|
Из других формул для расчета теплоты сгорания следует отметить формулы |
|||
Гуталя и Коновалова. |
|
|||
|
Формула Гуталя дает возможность рассчитать приближенно теплоту сгорания |
|||
каменного угля по данным технического анализа: |
|
|||
|
QHP 82 CKГ a V Г |
ккал/кг, |
||
где 82 – теплота сгорания 1% по массе С, принятая Гуталем;
CKГ -выходсухого беззольного коксаотгорючей массы топлива, по массе;
V Г -выходлетучих, отнесенных кгорючеймассетоплива,% по массе;
а–коэффициент, зависящийот содержания летучих; определяется экспериментально
–(по сути –1% теплоты сгорания горючеймассылетучих топлива, кДж [ккал]).
23
Формула Коноваловаимеет вид:
|
QP |
A M |
, |
|
H |
|
O2 |
где |
MO - теоретический расход массы кислорода на 1 кг топлива, определяемый в |
||
2
результате расчета или опыта, кг/кг;
A - значениетеплотысгорания,отнесенный к1кг кислородаприполномсжигании топлива(длякаменного угляинефтипринимаютравным12,77МДж/кг (3050 ккал/кг),
дляторфа13,2МДж/кг(3150ккал/кг)и для дров13,6МДж/кг (3250 ккал/кг)).
2.2.2 Расчет необходимого для горения воздуха по химическому составу.
Табл. 2.1 – Теоретический расход кислорода и атмосферного воздуха на единицу топлива
Название горючих |
|
Реакция |
|
Расход кислорода |
Расход воздуха |
|||||
Состав |
|
|
|
|
|
|
|
|
||
ω0 |
|
|
Vтеор |
|
L0в |
|||||
топлив |
горения |
|
|
|
||||||
|
|
|
|
О2 |
|
|
|
|||
|
|
|
кг/кг |
|
м3/кг |
|
м3/м3 |
м3/кг |
|
м3/м3 |
|
|
|
|
|
|
|
|
|
|
|
Углерод................... |
С |
С+О2=СО2 |
2,667 |
|
1,867 |
|
- |
8,89 |
|
- |
Окись углерода….. |
СО |
СО+0,5О2=СО2 |
0,572 |
|
0,40 |
|
0,5 |
1,90 |
|
2,38 |
Водород………….. |
Н2 |
Н2+0,5О2= Н2О |
8 |
|
5,60 |
|
0,5 |
26,74 |
|
2,38 |
Сера………………. |
S |
S+ О2= SО2 |
1 |
|
0,7 |
|
- |
3,33 |
|
- |
Метан…………….. |
СН4 |
СН4+2 О2= |
4 |
|
2,80 |
|
2 |
13,31 |
|
9,52 |
|
|
= СО2+2Н2О |
|
|
|
|
|
|
|
|
Этан…………….... |
С2Н6 |
С2Н6+3,5О2= |
3,74 |
|
2,60 |
|
3,5 |
12,43 |
|
16,66 |
|
|
= 2СО2+3Н2О |
|
|
|
|
|
|
|
|
Пропан………….... |
С3Н8 |
С3Н8+5О2= |
3,61 |
|
2,54 |
|
5 |
12,10 |
|
23,80 |
|
|
= 3СО2+4Н2О |
|
|
|
|
|
|
|
|
Бутан……………... |
С4Н10 |
С4Н10+6,5О2= |
3,58 |
|
2,50 |
|
6,5 |
11,90 |
|
30,94 |
|
|
= 4СО2+5Н2О |
|
|
|
|
|
|
|
|
Пентан………….... |
С5Н12 |
С5Н12+8О2= |
3,56 |
|
2,49 |
|
8 |
11,85 |
|
38,08 |
|
|
= 5СО2+6Н2О |
|
|
|
|
|
|
|
|
Циклогексан……... |
С6Н12 |
С6Н12+9О2= |
3,43 |
|
2,40 |
|
9 |
11,42 |
|
42,71 |
|
|
= 6СО2+6Н2О |
|
|
|
|
|
|
|
|
Этилен…………… |
С2Н4 |
С2Н4+3О2= |
3,43 |
|
2,40 |
|
3 |
11,42 |
|
14,28 |
|
|
= 2СО2+2Н2О |
|
|
|
|
|
|
|
|
Ацетилен………… |
С2Н2 |
С2Н2+1,5О2= |
3,04 |
|
2,13 |
|
1,5 |
10,26 |
|
11,90 |
|
|
= 2СО2+Н2О |
|
|
|
|
|
|
|
|
Бензол……………. |
С6Н6 |
С6Н6+7,5О2= |
3,0 |
|
2,10 |
|
7,5 |
12,40 |
|
35,70 |
|
|
= 6СО2+3Н2О |
|
|
|
|
|
|
|
|
Сероводород…….. |
Н2S |
Н2S+1,5О2= |
1,41 |
|
0,98 |
|
1,5 |
4,73 |
|
7,14 |
|
|
= Н2О+О2 |
|
|
|
|
|
|
|
|
При наличии многих горючих составляющих в топливе стехиометрическое число |
|
|||||||
|
|
|
0 |
0,01 хсхт , кг/кг, |
(2.7) |
|||
где |
х |
– стехиометрическое число соответствующего горючего, кг/кг; |
|
|||||
|
схт |
– концентрация горючего элемента в топливе, % по массе; |
|
|||||
|
0 |
– для твердого и жидкого топлива подсчитывается по формуле |
|
|||||
|
|
0,01 |
Ср |
Н р |
S p Op кг / кг. |
(2.8) |
||
|
|
0 |
с |
|
н |
s |
|
|
24
После подстановки значений с , Н и S из табл. 2.1 получаем следующую формулу:
|
0,01 2,667Ср 8Н р S p Op кг /кг. |
(2.8а) |
0 |
|
Теоретический объемный расход О2
Vтеор
Теоретический объемный расход О2 ( О2 ), необходимый для полного сгорания 1 кг топлива, определяется из выражения
|
|
|
|
|
V теор |
|
0 |
, м3 |
/кг. |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
О2 |
|
|
О2 |
|
|
|
|
|
|
(2.9) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где |
О2 =1,43 кг/м3 – плотность кислорода. |
|
|
|
|
|
|
||||||||||||
|
Например для углерода |
|
|
|
|
2,66 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
V теор |
1,867м3 /кг. |
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
О2 |
|
1,43 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Значение |
Vтеор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О2 |
для горючих составляющих сведены в табл. 2.1. |
|
||||||||||||||||
|
После подстановки в формулу (1-12) значения ω0 из формулы (2.8), получим |
||||||||||||||||||
|
|
|
V теор |
0,01 |
Ср |
Н р |
|
Sp |
Op |
|
|
||||||||
|
|
|
|
|
с |
|
|
|
|
н |
|
s |
|
|
м3 / |
кг, |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
О2 |
|
|
|
|
|
|
|
О2 |
|
|
|
|
|
(2.9a) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Или после подстановки с , Н из таблицы 2-1 |
|
|
|
|
|
|||||||||||||
|
VОтеор2 |
0,01 1,867 С р 5,6Н р 0,7(S p |
O p ) м3 |
/ кг, |
(2.9б) |
||||||||||||||
где 0,7Ор–объем кислорода в 1 кг топлива, м3/кг. |
|
|
|
|
|
||||||||||||||
|
В случае расчета |
V теор |
в м |
3 |
на 1 кг газообразного топлива соответствующие |
||||||||||||||
|
О2 |
|
|||||||||||||||||
коэффициенты для горючих составляющих следует брать из табл. 2.1.
При расчете теоретического расхода кислорода, необходимого для полного сгорания 1
м |
3 |
газообразного топлива, нужно |
V теор, м3 /кг , |
подсчитанное по формуле (2.9а) |
|
||||
|
|
О2 |
|
||||||
умножить на плотность топлива Т ,кг/м3: |
|
|
|
|
|
||||
|
|
V теор 0,01 0СХ |
|
|
Т, |
м3 / м3. |
|
||
|
|
О2 |
|
О2 |
|
|
|
(2.10) |
|
|
|
|
|
|
|
|
|
||
Формула (2.10) путем простых преобразований может быть приведена к виду |
|
||||||||
|
|
VОтеор2 |
0,01 V02CХ |
м3 / м3, |
(2.11) |
||||
|
|
|
|
|
|
|
|
|
|
где V02 – теоретический объемный расход О2 необходимый для полного сгорания 1м3 соответствующего горючего;
CХ – содержание горючего компонента в топливе, %(объемн.).
25
Стехиометрические объемные соотношения в реакции горения равны отношению молей. Так, для сгорания 1м3 СО по реакции горения требуетсяV0=0,5 м3 О2 , а для сгорания СН4 – 2м3 (см. табл. 2.1).
Пользуясь этими данными и зная состав газообразного топлива в объемных
процентах, определяем VОтеор2 в м3 / м3 |
топлива: |
|
|
|
|
|
|
|
||
V теор 0,01 0,5СО 0,5Н |
2 |
2СН |
4 |
... 1,5Н |
2 |
S О |
2 |
м3 / м3, |
(2.12) |
|
О2 |
|
|
|
|
|
|||||
где О2 –содержание кислорода в топливе ,%(объемн.).
Если обозначить углеводороды через СmHn, то количество кислорода, рекомендуемое для полного сгорания всех углеводородов может быть представлено общей формулой:
|
|
|
теор |
|
|
n |
|
|
|
|
|
3 |
|
3 |
|
|
|
|
|
|
|
|
||
|
|
V |
|
0,01 m |
|
|
C |
H |
|
, м |
|
|
/ м |
. |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
О2 |
|
4 |
m |
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Например, для горения 1м3 этана С2Н6, когда m=2 и n=6: |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
теор |
|
6 |
|
|
|
|
|
|
3 |
3 |
|
|
|
|
|
|
|
|||||
|
|
VО2 |
0,01 2 |
|
|
100 3,5м |
|
|
/ м |
|
. |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Тогда в общем виде формула (2.12) примет вид: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
теор |
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
3 |
|
3 |
|
||
VО 2 |
0,01 |
0,5СО 0,5Н |
2 1,5Н 2 S |
m |
|
|
Cm H n |
|
О |
2 |
м |
|
/ м |
|
. |
|||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
(2.12а) |
||
Расход воздуха для горения топлива. Коэффициент расхода воздуха.
Количество воздуха, необходимого ля горения топлива. Можно определять по объему (м3) или по массе (кг). Расход воздуха, отвечающий стехиометрическому. Также обозначают L0 (м3/кг,м3/м3), а расход по массе G0 (кг/кг). Для расчета расхода воздуха на горение существуют три метода: аналитический, приближенный, по графикам.
Аналитический метод расчета. Теоретический расход воздуха определяется по теоретическому расходу кислорода (формулы 2.10–2.12) и объемной доле кислорода в воздухе kО2:
Lв |
V теор |
, м3 /кг, м3 / м3. |
|
|
02 |
||
|
|||
0 |
|
02 |
(2.13) |
V теор
Подставив О2 из формулы (2.9а), получим теоретический объемный расход сухого воздуха для сжигания 1 кг твердого и жидкого топлива:
с.в |
|
0,011,867Ср 5,6Н |
р 0,7(Sp Op ) |
3 |
|
|
|
|
L |
|
|
|
, м |
|
/ |
кг, |
|
|
|
|
|
|||||
0 |
|
02 |
|
|
|
|
|
(2.14) |
|
|
|
|
|
|
|
||
Для атмосферного воздуха kО2 = 0,21, и формула (2.14) принимает вид: |
|
|||||||
Lс0.в |
0.0889Ср 0.267Н р |
0.0333(S p Op ),м3 |
/кг, |
(2.14а) |
||||
26
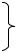
Объемный теоретический расход сухого воздуха на 1 м3 газообразного топлива определяется по формуле (2.15):
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
0,01 0,5СО 0,5Н2 |
2СН4 |
m |
|
CmHn |
1,5H |
2S О2 |
|
|
|
|
|
|
4 |
|
|
|
|
||||||
с.в |
|
|
|
|
|
|
|
|
3 |
3 |
|
|
L |
|
|
|
|
|
|
|
|
, м |
|
/ м |
. |
|
|
|
|
|
|
|
|
|||||
0 |
|
|
|
02 |
|
|
|
|
|
|
|
(2.15) |
|
|
|
|
|
|
|
|
|
|
|
||
Для атмосферного воздуха kО2 = 0,21, и формула (2.15) принимает вид:
Lс0.в 0,01 2,38СО 2,38Н2 9,52СН 4 ... 7,14H2S 4,76О2 , м3 / м3. (2.15a)
Коэффициенты, показывающие теоретический расход сухого атмосферного воздуха (м3) на 1 м3 соответствующего горючего, приведены в табл. (2.1).
Если для горения используют влажный воздух, в котором на 1 м3 сухой части
содержится ƒ, г, влаги или |
|
22,4ѓ |
0,00124ѓ, м3,водяного пара, то расход влажного |
|
|
|
|||
18 1000 |
|
|||
воздуха составит: |
1 0,00124ѓ Lс0.в , м3 /ед.топл. |
|
||
Lв0 |
(2.16) |
|||
Чтобы обеспечить более быстрое и полное сгорание топлива, вводят |
||||
избыточный воздух в некотором количестве сверх теоретического Lизбв |
, зависящее от |
|||
вида топлива и организации процесса его сжигания. Отношение объема избыточного
воздуха Lизбв к теоретическому объемному расходу воздуха Lв0 , необходимому для сжигания единицы топлива, носит название коэффициента избытка воздуха, обозначают его буквой α и выражают в долях от единицы или объемных процентах:
|
изб |
|
изб |
|
|
|
|
Lв |
, или |
Lв |
100%. |
(2.17) |
|
|
||||||
в |
||||||
в |
||||||
|
L0 |
|
L0 |
|
|
Так как избыточный воздух переходит в продукты сгорания, увеличивая их объем, и тем самым повышает унос тепла с уходящими газами, то стремятся осуществить сжигание топлива при минимальном избытке воздуха, обеспечивающем полноту сгорания в данном конкретном случае. Чем лучше организация сжигания топлива, тем меньше избытка воздуха требуется. Ориентировочные нормы коэффициента избытка воздуха, которые могут изменяться в зависимости от организации процесса сжигания топлива (от конструкции горелок и форсунок, колеблются на практике в следующих пределах: для газообразных топлив α=0,03÷0,15, для жидких топлив α= 0,15÷0,20).
Воздух в количестве, которое практически вводят для полного сгорания
Lв
единицы топлива, называют действительным расходом воздуха( п ). Отношение действительного расхода воздуха к теоретически необходимому носит название коэффициент расхода воздуха. Этот коэффициент обозначают буквой п и выражают так же, как и α. На практике часто α называют коэффициентом избытка воздуха, а подразумевают под ним коэффициент расхода п, вследствие чего могут возникать недоразумения. Если
Lвп : Lв0 =п и Lизбв ٠Lв0 =α,
(2.18)
то п=1+α,
27

Lв Lв
следовательно, п =п 0 . (2.19)
Приближенный метод расчета. Нужно отметить следующую закономерность:
чем больше теплота сгорания топлива(Qнр ) , тем больше воздуха необходимо для сгорания единицы топлива. На использовании этой прямой пропорциональной зависимости между теплотой сгорания и расходом воздуха построены приближенные (инженерные) формулы для расчета расхода атмосферного воздуха:
Lв0 |
|
Qнр |
м3 /кг, м3 / м3 |
|
|
(2.20) |
|||
|
1000 |
, |
||
где k – поправочный коэффициент , зависящий от рода топлива, значение которого приведено в табл. (2.2) (значение его близко к единице; для углерода его значение максимально k=1,10. для окиси углерода – минимально k= 0,788, для водорода k= 0,93).
Таблица. 2.2 – Значение коэффициента k в формуле (2.20)
Вид топлива
Коэффициент k
Водород |
Углерод |
Антрацит |
Угли |
Жидкое топливо |
Природный газ |
Метан |
Торф |
Дрова |
Коксовый газ |
Окись углерода |
Доменный газ |
Генераторны й газ |
0,93 |
1,10 |
1,10 |
1,10 |
1,10 |
1,11 |
1,11 |
1,10 |
1,06 |
1,02 |
0,788 |
0,81 |
0,87 |
|
В формуле (2.20) Qнр |
выражено в ккал. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
Для быстрого и ориентировочного определения расхода воздуха можно |
|
|
|
|
|
|
||||||||||||||||||||||||||||
исходить из положения, что на 100 ккал теплоты сгорания топлива требуется |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
приблизительно 1 м3 воздуха. Лучшее приближение получается по формулам, |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
приведенным в табл. 2.3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица. 2.3 – Эмпирические формулы для определения Lв0 иV0Д (м3/кг, м3/ м3) |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
Топливо |
Теоретически необходимое |
|
Количество продуктов |
|||||||||||||||||||||||||||||||
|
|
количество воздуха |
|
|
сгорания (при п =1) |
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Qнр |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
Qр |
|
|
|
|
|
|||||||
|
Дрова……………………… |
|
4,66 1- |
|
|
|
|
|
, м |
|
/ кг |
|
|
|
|
|
|
|
|
|
|
|
н |
м |
3 |
/кг |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
5,3 4,055 |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|||||||||||||
|
|
1,01 |
|
|
Qр |
0,5м3 /кг |
0,89 |
|
Qр |
1,65м3 /кг |
|||||||||||||||||||||||||
|
Уголь……………………… |
|
|
|
н |
|
|
|
|
|
н |
||||||||||||||||||||||||
|
|
1000 |
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Жидкое топливо………….. |
0,85 |
|
Qр |
|
2м3 /кг |
1,11 |
Qр |
|
м3 /кг |
|
|
|||||||||||||||||||||||
|
|
|
н |
|
|
|
|
н |
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
||||||||||
|
Газообразное топливо |
0,875 |
|
|
Qнр |
м |
3 |
/ м |
3 |
|
|
0,725 |
|
|
Qнр |
|
1м |
3 |
/ м |
3 |
|||||||||||||||
|
(Qнр <3000 ккал/м3)………. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
1000 |
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
Газообразное топливо |
1,09 |
Qнр |
|
0,25м3 / м3 |
1,14 |
|
Qнр |
|
|
0,25м3 / м3 |
||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
(Qнр >3000 ккал/м3)………. |
1000 |
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
Qр |
|
|
|
|
|
|
|
|
|
|
|
|
|
Q |
р |
|
|
|
|
|
|
|
|
|
||||||||
|
Коксодоменная смесь……. |
|
|
н |
0,2м3 / м3 |
|
|
0,945 |
|
|
|
н |
|
0,765м3 / м3 |
|||||||||||||||||||||
|
1000 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
28
2.2.3 Состав продуктов горения.
1. Объем углекислого газа
V |
0,01 1,867 С р , м3 /кг |
(2.21) |
|
СО2 |
|
где 1,867 – объем углекислого газа, полученный при полном сгорании 1 кг углерода.
2. Объем водяных паров складывается:
а) из объема водяных паров, образовавшихся от сгорания 1 кмоль водорода топлива в количестве 22,4:2=41,2 м3/кмоль ;
б) из объема водяных паров, полученных в результате испарения влаги топлива
– 1,242 Wр, где 1,242 – удельный объем водяного пара (м3/кг);
в) при сжигании жидкого топлива его предварительно распыляют воздухом или паром; если обозначить через Wф количество пара (в килограммах), расходуемое в форсунках для распыления 100 кг топлива, то количество пара в продуктах сгорания увеличится на 1,242Wф (м3/кг);
г) из объема водяных паров, перешедших из воздуха: 0,00124ѓLвп ,(м3 /кг)
(см.формулу 1-19).
Общее количество водяных паров в продуктах сгорания
VH2O |
0,0111,2 Hр 1,242 Wр Wф |
0,001242fLвп |
,м3 /кг. |
(2.22) |
|
|
|
|
3. При наличии серы в продуктах сгорания будет присутствовать сернистый газ. Из 1 кг S получится 22,4:32=0,7 м3 SO2. Следовательно:
|
|
V |
0,01 0,7S р, |
|
|
(2.22а) |
||
|
|
СО2 |
|
|
|
|
|
|
VСО2 VSO2 |
VRO2 0,01 1,867C p 0,7S р 0.01 1,867 C p 0,375S p ,м3 / кг. (2.23) |
|||||||
4. Содержание азота в продуктах сгорания складывается из азота топлива 0,8Nр, |
||||||||
где 0,8 – удельный объем азота(22,4:28=0,8 м3/кг), а также азота |
||||||||
воздухаVД |
1 kО |
Lвп ,где k – объемная доля кислорода в воздухе (см. формулу 2.13). |
||||||
N2 |
|
2 |
|
|
|
|
|
|
Следовательно, объем азота в продуктах сгорания |
|
|
|
|||||
|
|
V Д 0,01 0,8N |
p 1 kО |
|
Lвп |
, |
||
|
|
N 2 |
|
|
|
2 |
|
(2.24) |
|
|
|
|
|
|
|
||
5. Объем избыточного кислорода воздуха |
|
|
|
|||||
|
|
Vизб |
k |
О2 |
п 1 Lв , м3 |
/ кг. |
(2.25) |
|
|
|
О2 |
|
0 |
|
|
||
|
|
|
|
|
|
|
|
|
Общий объем продуктов сгорания (VД)при сжигании твердого и жидкого топлива:
VД 0,01 1,867Cp 0,7Sр 0,0111,2 Hр |
1,242 Wр Wф |
|
||||||||
0,001242fLв |
0,01 0,8N p 1 k |
О |
|
Lв |
k |
О |
|
п 1 Lв |
, |
(2.26) |
п |
|
2 |
п |
|
2 |
0 |
|
|||
|
|
|
|
|
|
|
|
|
||
При сжигании газообразного топлива объем продуктов сгорания определяют по следующим формулам:
29
1. Объем углекислого газа:
|
VСО2 0,01СО2Т СОТ СН4Т m |
(Cm Hn )Т , м3 / м3 |
где СО2Т ,СОТ |
|
(2.27) |
и т.д. – составляющие топлива, % (объемн.). |
||
Из 1 м3 СО получается 1 м3 СО2, поэтому при окиси углерода стоит коэффициент |
||
1. При горении углеводородов СmHn количество молей СО2 |
в реакции получается |
|
равным количеству атомов углерода.
Общая формула для подсчета объема углекислого газа, полученного при полном сгорании углеводородов СmHn :
VСОСm2Hn m (СmHn ).
Аналогично подсчитывают объем водяного пара, полученного при полном сгорании углеводородов СmHn:
|
|
|
|
|
|
|
|
|
VНС2mОHn |
п |
СmHn . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Объем водяного пара |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
Д |
|
|
|
|
Т |
|
Т |
|
п |
|
|
|
Т |
|
|
|
Т |
|
|
|
|
|
|
|
в в |
|
|
|
3 |
|
|
3 |
|
||
|
VН2 |
О 0,01 Н2 |
2СН4 |
|
Сm Hn |
|
0,0124 f |
|
0,00124f |
Lп |
, м |
|
/ м |
|
, (2.28) |
|||||||||||||||||||||
|
2 |
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
f Т – влажность топлива, отнесенная к 1 м3 сухого газа, г/м3; |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
f |
в– влажность воздуха, отнесенная к 1 м3 сухого воздуха, г/м3. |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
3. |
Объем SO2: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
V |
Д |
0,01H |
2 |
ST . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.29) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
SO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
4. Объем азота: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Д |
0,01N |
T |
|
|
|
|
|
в |
, м |
3 |
|
/ м |
3 |
. |
|
|
|
|
|
|
|
|
|
(2.30) |
||||
|
|
|
|
|
|
|
|
VN2 |
2 |
(1 kO2 )Lп |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
5. Объем избыточного кислорода: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
V изб |
k |
0,01(п 1)Lв , м 3 / м 3 . |
|
|
|
|
|
|
|
|
|
|
(2.31) |
|||||||||||||||
|
|
|
|
|
|
|
|
О2 |
|
|
|
O2 |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общий объем продуктов горения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
Д |
|
|
Т |
Т |
Т |
|
|
|
|
Т |
|
|
Т |
|
Т |
|
|
|
п |
|
|
Т |
|
|
|
T |
|
|
|
T |
|
||
|
V |
|
0,01СО2 |
СО |
СН4 |
m (CmHn) |
Н2 2СН4 |
|
|
|
СmHn |
H2S |
|
N2 |
|
|
|
|||||||||||||||||||
|
|
2 |
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.32) |
||
|
(1 k |
)Lв |
0,0124fТ 0,00124f |
вLв |
k |
|
(п 1)Lв ,м3 |
/м3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
O |
п |
|
|
|
|
|
|
п |
O |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
30
