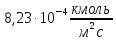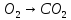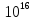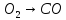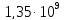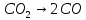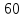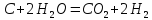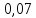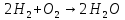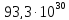1. Расчёт констант равновессия

Приняв за единицу измерения 1 кг и соответственно 1 килограмм-молекулу (моль), получим:
С +
 ;
;
12кг С + 32 кг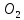 = 44кг
= 44кг ;
;

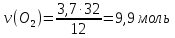
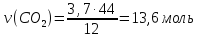
V(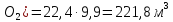
V(C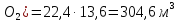
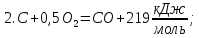
12кг С + 16 кг = 28 кг СО
= 28 кг СО

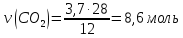
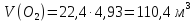
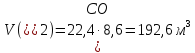

12кг С + 44 кг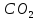 = 56 кг СО;
= 56 кг СО;

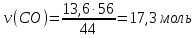


12кг С + 18 кг
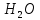 = 28 кг СО + 2 кг
= 28 кг СО + 2 кг ;
;

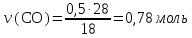

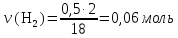


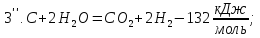
12кг С + 36 кг
 = 44 кг С
= 44 кг С + 4 кг
+ 4 кг ;
;




V(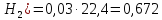
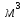

12кг С + 4кг
 = 16
= 16
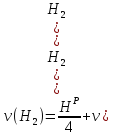

V(

Следующие реакции протекают в газовом объёме и являются гомогенными, считаем по объёму.

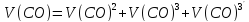

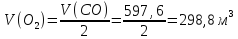
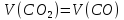

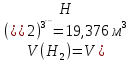
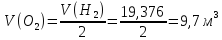

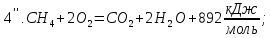
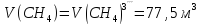


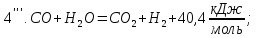

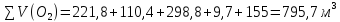
При использовании для горения
кислорода воздуха необходимо учесть,
что воздух представляет смесь, состоящую
по объёму приблизительно из 21% кислорода
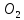 и 79% азота
и 79% азота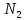 ,
то есть в воздухе содержится на 1 объём
кислорода 79:21 = 3,76 объёма азота, или на
1 моль
,
то есть в воздухе содержится на 1 объём
кислорода 79:21 = 3,76 объёма азота, или на
1 моль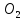 приходится
3,76 моля
приходится
3,76 моля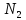 .
Азот без изменения попадает в продукты
горения. Поэтому баланс продуктов
горения углерода в воздухе можно условно
написать так:
.
Азот без изменения попадает в продукты
горения. Поэтому баланс продуктов
горения углерода в воздухе можно условно
написать так:
С +
 + 3,76
+ 3,76 =
= + 3,76
+ 3,76 ;
;
1 моль С + 1 моль
 + 3,76 моль
+ 3,76 моль = 1 моль
= 1 моль + 3,76 моль
+ 3,76 моль .
.

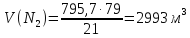
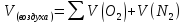 ;
;

1.1 Расчёт констант равновесия по стехеометрическим формулам:

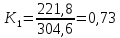


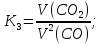
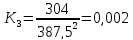



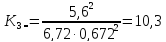

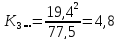
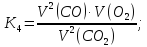





1.2 Расчёт по методу Владимирова:
В общем случае для химической реакции bB+dD=gG+rR
 и
и
 определяются по формулам:
определяются по формулам:
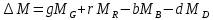 ;
;
 ;
;


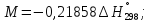
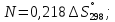

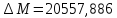
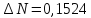 ;
;


 ;
;
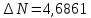 ;
;
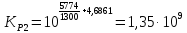

 ;
;
 ;
;
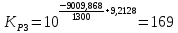

 ;
;
 ;
;

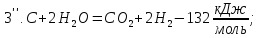
 ;
;


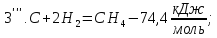
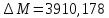 ;
;
 ;
;
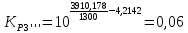
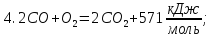

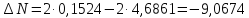 ;
;


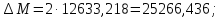
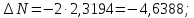

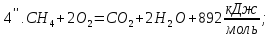




 ;
;


Составим сравнительную таблицу для констант равновесия, рассчитанных по стехиометрическим формулам и по методу Владимирова:
Таблица 1. Константы равновесия
|
Реакции |
По стехиометрическим формулам |
По методу Владимирова |
|
C+ |
0,73 |
|
|
C+0,5 |
0,05 |
|
|
C
+
|
0,002 |
169 |
|
|
0,48 |
|
|
|
10,3 |
|
|
|
4,8 |
|
|
2CO
+
|
298,8 |
|
|
|
4,85 |
|
|
|
1 |
|
|
|
1 |
|
Константа равновесия показывает
во сколько раз скорость прямой реакции
больше скорости обратной реакции при
данной температуре и концентрациях
веществ, которые вступают в реакцию. Из
анализа данных, можно сделать вывод,
что скорость прямой реакции c
 намного
больше скорости обратной. В реакциях
намного
больше скорости обратной. В реакциях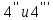 константы равновесия равны единице,
это значит, что скорости прямой и обратной
реакции равны.
константы равновесия равны единице,
это значит, что скорости прямой и обратной
реакции равны.
2. Определение времени выгорания частицы
2.1 Определение k1
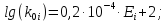
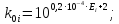
 ;
;



2.2 Определение k2
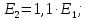
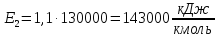 ;
;
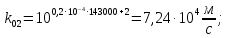

2.3 Определение k3
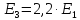 ;
;
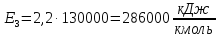 ;
;
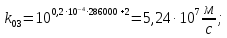

2.4 Определение
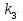
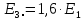 ;
;
 ;
;
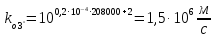 ;
;

2.5 Определение k4
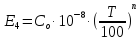 ,
n = 3,5,
,
n = 3,5,
где
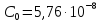 - постоянная Стефана – Больцмана
- постоянная Стефана – Больцмана
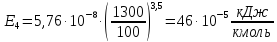 ;
;

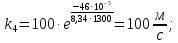
2.6 Определение времени выгорания частицы по формуле:
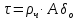 ,
где
,
где
 ;
;
 ;
;

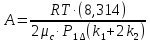

 ;
;
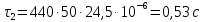
Дальнейший расчёт будем вести
для
 , так как вторая частица ушла в механический
унос.
, так как вторая частица ушла в механический
унос.
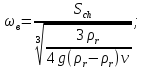
3. Расчёт скорости витания частицы
Определим плотность газового потока:
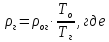
 плотность воздуха при н.у.
плотность воздуха при н.у.
 ;
;
Находим критерий Кирпичева:
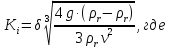
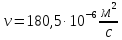 - кинематическая вязкость;
- кинематическая вязкость;
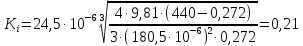 ;
;
Определим критерий Шиллера:
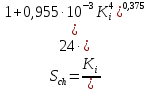
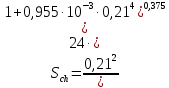

Определение области движения частицы по формуле:


Re = 0,003
 –
область Стокса, т.е. чисто вязкого течения
–
область Стокса, т.е. чисто вязкого течения

С =
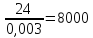
4. Определение области горения частицы
Рассчитываем коэффициент диффузии по зависимостям:

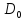 –коэффициент взаимной
диффузии при н.у.,
–коэффициент взаимной
диффузии при н.у.,
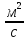
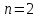 - показатель степени;
- показатель степени;
 ;
;
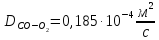 ;
;
 ;
;
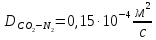 ;
;
Определим коэффициент диффузии в многокомпонентной смеси:

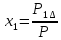 ,
,
 ,
, -молярные доли компонентов
в смеси
-молярные доли компонентов
в смеси
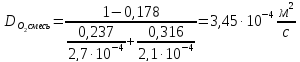
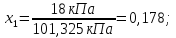
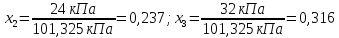
Найдем коэффициент массоотдачи по формуле:

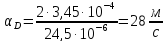
Определим диффузионно-химический критерий:

 –константа скорости i-ой
реакции,
–константа скорости i-ой
реакции,


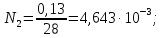
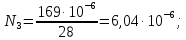

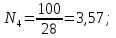
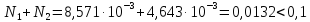 –является кинематической
областью горения.
–является кинематической
областью горения.
Оцениваем влияние реакции
 :
:

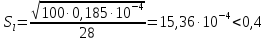 –негорящий пограничный слой.
–негорящий пограничный слой.
Для скорости выгорания углерода в этих условиях:

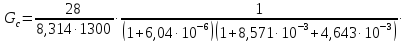
 =
=