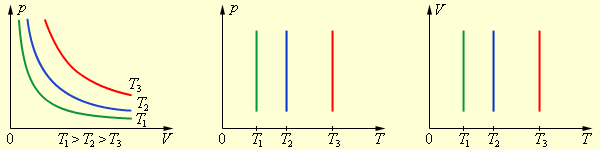- •В простейшем случае одномерных малых упругих деформаций формула для силы упругости имеет вид (Закон Гука):
- •20 ВопросНапряжённость гравитационного поля
- •Гравитационный потенциал и уравнения движения
- •Гравитационный потенциал и принцип эквивалентности
- •Гравитационный потенциал точечной частицы и произвольного тела
- •21 Вопрос
- •Второй закон Кеплера (закон площадей)
- •Третий закон Кеплера (гармонический закон)
- •Физический смысл
- •23 Вопрос
- •По физической природе
- •По характеру взаимодействия с окружающей средой
- •Скорость и ускорение при гармонических колебаниях.
- •Энергия гармонических колебаний
- •28 Вопрос
- •Затухающие колебания пружинного маятника
- •Решения
- •Математическое выражение для кривой Лиссажу
- •Вопрос 32
- •35 Вопрос
- •Моль вещества
- •Постоянная Авогадро
- •Связь с другими законами состояния идеального газа
- •38 Вопрос
- •39 Вопрос
- •45 Вопрос
- •47 Вопрос Тема 2. Теплоёмкость газов
- •2.1.Массовая, объёмная и мольная удельные теплоёмкости
- •48 Вопрос
- •Физический смысл адиабатического процесса
- •Работа газа
- •49 Вопрос
- •50 Вопрос
- •Описание цикла Карно
- •Кпд тепловой машины Карно
- •Связь между обратимостью цикла и кпд
- •51 Вопрос
- •Ограничения
- •Второе начало термодинамики и «тепловая смерть Вселенной»
- •52 Вопрос
- •53 Вопрос
- •Критическое состояние вещества
- •54 Вопрос Внутренняя энергия реального газа
- •Изменение энергии
- •Изменение температуры
- •55 Вопрос
- •56 Вопрос Смачивание и несмачивание. Капиллярные явления
- •Введение
- •57 Вопрос
Постоянная Авогадро
Количество веществаν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества. ν = N / NAгде N – количество молекул в данном теле, NA– количество молекул в 1 моле вещества, из которого состоит тело. NA– это постоянная Авогадро. Количество вещества измеряется в молях.Постоянная Авогадро– это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физикаАмедео Авогадро(1776 – 1856). В 1 моле любого вещества содержится одинаковое количество частиц. NA= 6,02 * 1023моль-1Молярная масса– это масса вещества, взятого в количестве одного моля: μ = m0* NAгде m0– масса молекулы. Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1). Молярная масса связана с относительной молекулярной массой соотношением: μ = 10-3* Mr[кг*моль-1] Масса любого количества вещества m равна произведению массы одной молекулы m0на количество молекул: m = m0N = m0NAν = μν Количество вещества равно отношению массы вещества к его молярной массе: ν = m / μ Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро: m0= m / N = m / νNA= μ / NA
36 вопрос
Идеальный газ—математическая модельгаза, в которой предполагается, чтопотенциальной энергиейвзаимодействиямолекулможно пренебречь по сравнению с ихкинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосудаабсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют также форму в виде упругихсферилиэллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц и др.[1
Уравнение состояния термодинамической
системы представляет собой аналитическую
формулу, связывающую параметры состояния
системы. Если состояние системы может
быть полностью описано с помощью трех
параметров: давления![]() ,
объема
,
объема![]() и
температуры
и
температуры![]() ,
тоуравнение
состоянияв самом общем виде
будет иметь форму:
,
тоуравнение
состоянияв самом общем виде
будет иметь форму:
|
|
(2.1) |
Конкретный вид этой формулы зависит от физических свойств рассматриваемой термодинамической системы.
Обобщение многочисленных экспериментальных данных показывает, что большинство газов при комнатной температуре и давлении порядка одной атмосферы (при нормальных условиях) с достаточно высокой точностью могут быть описаны уравнением состояния, называемымуравнением Клапейрона-Менделеева:
|
|
(2.2) |
где:![]() -
давление газа,
-
давление газа,![]() -
занимаемый им объем,
-
занимаемый им объем,![]() -
количество молей газа,
-
количество молей газа,![]() -
универсальная газовая постоянная,
-
универсальная газовая постоянная,![]() -
абсолютная температура. Уравнение(2.2)названо в честь французского физикаБенуа
Поля Эмиля Клапейрона(1799 - 1864)
и русского химикаДмитрия
Ивановича Менделеева(1834 - 1907).
-
абсолютная температура. Уравнение(2.2)названо в честь французского физикаБенуа
Поля Эмиля Клапейрона(1799 - 1864)
и русского химикаДмитрия
Ивановича Менделеева(1834 - 1907).
В рамках термодинамического
подхода газ, уравнение состояния
которого, связывающие параметры![]() ,
,![]() ,
и
,
и![]() ,
является уравнением Клапейрона-Менделеева(2.2),
называетсяидеальным
газом. При нормальных условиях
наиболее близкими по своим свойствам
к идеальному газу являются водород и
гелий.
,
является уравнением Клапейрона-Менделеева(2.2),
называетсяидеальным
газом. При нормальных условиях
наиболее близкими по своим свойствам
к идеальному газу являются водород и
гелий.
|
Законы идеального газа |
|
|
|
Давление p, объем V и температура T идеального газа связаны между собой уравнением Менделеева–Клапейрона:
|
|
Здесь ν – количество вещества, R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Если температура газа остается постоянной, то выполняется закон Бойля–Мариотта:
|
pV = const. |
|
|
|
Рис. 1. Изотермический процесс |
Если постоянным остается давление, то выполняется закон Гей-Люссака:
|
|
|
|
|
Рис. 2. Изобарный процесс |
Наконец, если постоянен объем, то справедлив закон Шарля:
|
|
|
|
37 вопрос
Уравнение состояния идеального газа(иногдауравнение Клапейронаилиуравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость междудавлением,молярным объёмомиабсолютной температуройидеального газа. Уравнение имеет вид:
![]() ,
,
где
 —давление,
—давление,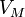 —молярный
объём,
—молярный
объём, —универсальная
газовая постоянная
—универсальная
газовая постоянная —абсолютная
температура,К.
—абсолютная
температура,К.
Так
как
![]() ,
где
,
где![]() —количество
вещества, а
—количество
вещества, а![]() ,
где
,
где![]() —
масса,
—
масса,![]() —молярная
масса, уравнение состояния
можно записать:
—молярная
масса, уравнение состояния
можно записать:
![]()
Эта
форма записи носит имя уравнения (закона)
Менделеева — Клапейрона.Уравнение,
выведенное Клапейроном содержало некую
неуниверсальную газовую постоянную
![]() ,
значение которой необходимо было
измерять для каждого газа:
,
значение которой необходимо было
измерять для каждого газа:
![]()
Менделеев
же обнаружил, что
![]() прямо
пропорциональна
прямо
пропорциональна![]() ,
коэффициент пропорциональности
,
коэффициент пропорциональности![]() он
назвал универсальной газовой постоянной.
он
назвал универсальной газовой постоянной.