
- •В простейшем случае одномерных малых упругих деформаций формула для силы упругости имеет вид (Закон Гука):
- •20 ВопросНапряжённость гравитационного поля
- •Гравитационный потенциал и уравнения движения
- •Гравитационный потенциал и принцип эквивалентности
- •Гравитационный потенциал точечной частицы и произвольного тела
- •21 Вопрос
- •Второй закон Кеплера (закон площадей)
- •Третий закон Кеплера (гармонический закон)
- •Физический смысл
- •23 Вопрос
- •По физической природе
- •По характеру взаимодействия с окружающей средой
- •Скорость и ускорение при гармонических колебаниях.
- •Энергия гармонических колебаний
- •28 Вопрос
- •Затухающие колебания пружинного маятника
- •Решения
- •Математическое выражение для кривой Лиссажу
- •Вопрос 32
- •35 Вопрос
- •Моль вещества
- •Постоянная Авогадро
- •Связь с другими законами состояния идеального газа
- •38 Вопрос
- •39 Вопрос
- •45 Вопрос
- •47 Вопрос Тема 2. Теплоёмкость газов
- •2.1.Массовая, объёмная и мольная удельные теплоёмкости
- •48 Вопрос
- •Физический смысл адиабатического процесса
- •Работа газа
- •49 Вопрос
- •50 Вопрос
- •Описание цикла Карно
- •Кпд тепловой машины Карно
- •Связь между обратимостью цикла и кпд
- •51 Вопрос
- •Ограничения
- •Второе начало термодинамики и «тепловая смерть Вселенной»
- •52 Вопрос
- •53 Вопрос
- •Критическое состояние вещества
- •54 Вопрос Внутренняя энергия реального газа
- •Изменение энергии
- •Изменение температуры
- •55 Вопрос
- •56 Вопрос Смачивание и несмачивание. Капиллярные явления
- •Введение
- •57 Вопрос
53 Вопрос
Реальные газы отличаются от идеальных тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой сложными силами взаимодействия. При высоких давлениях и достаточно низких температурах реальные газы конденсируются, т. е. переходят в жидкое состояние, чего принципиально не может быть с идеальными газами.

На
участке ВС не только давление, но и
температура постоянны. Крайним точкам
отрезка ВС соответствуют однофазные
состояния вещества: точке С (объем
![]() )
– жидкое, а точке В (объем
)
– жидкое, а точке В (объем![]() )
– газообразное. В промежуточном
двухфазном состоянии с объемом V часть
вещества с количеством молей
)
– газообразное. В промежуточном
двухфазном состоянии с объемом V часть
вещества с количеством молей![]() находится
в жидком, а часть с количеством молей
находится
в жидком, а часть с количеством молей![]() –
в газообразном состоянии. Определим
отношение количества молей жидкой и
газообразной фаз в объеме V .
–
в газообразном состоянии. Определим
отношение количества молей жидкой и
газообразной фаз в объеме V .
Объем одного моля жидкой и газообразной фаз вещества соответственно равны:
|
|
|
(5.1.1) |
Объем
V содержит
![]() молей
жидкой фазы и
молей
жидкой фазы и![]() молей
газообразной фазы, поэтому этот объем
можно представить в виде суммы объемов
жидкой и газообразной фаз следующим
образом:
молей
газообразной фазы, поэтому этот объем
можно представить в виде суммы объемов
жидкой и газообразной фаз следующим
образом:
|
|
|
(5.1.2) |
После простых преобразований из выражения (5.1.2) находим искомое отношение
|
|
|
(5.1.3) |
Умножая числитель и знаменатель левой части выражения (5.1.3) на молярную массу вещества, получим аналогичное отношение для масс жидкой и газообразной фаз:
|
|
|
(5.1.4) |
На
рис. 1 представлены изотермы газа при
различных температурах
![]() Из
рисунка видно, что с ростом температуры
горизонтальный участок, соответствующий
двухфазному состоянию вещества,
уменьшается и при некоторой температуре
Из
рисунка видно, что с ростом температуры
горизонтальный участок, соответствующий
двухфазному состоянию вещества,
уменьшается и при некоторой температуре![]() ,
называемой критической, стягивается в
точку K . Изотерма, соответствующая
температуре
,
называемой критической, стягивается в
точку K . Изотерма, соответствующая
температуре![]() ,
называется критической изотермой, точка
K которой является точкой перегиба.
,
называется критической изотермой, точка
K которой является точкой перегиба.

![]()
Изотермыреального газа(схематично) Синие — изотермы при температуре ниже критической. Зелёные участки на них —метастабильные состояния. Участок левее точки F — нормальная жидкость. Точка F —точка кипения. Прямая FG — равновесие жидкой и газообразной фазы. Участок FA —перегретая жидкость. Участок F′A —растянутая жидкость(p<0). Участок AC —аналитическое продолжениеизотермы, физически невозможен. Участок CG —переохлаждённый пар. Точка G —точка росы. Участок правее точки G — нормальный газ. Площади фигуры FAB и GCB равны. Красная —критическая изотерма. K —критическая точка. Голубые — сверхкритические изотермы
Критическое состояние вещества
Сходство свойств ненасыщенных паров и газов натолкнуло М. Фарадея на предположение: не являются ли газы ненасыщенными парами соответствующих жидкостей? Если предположение верно, то можно попытаться сделать их насыщенными и сконденсировать. Действительно, сжатием удалось сделать насыщенными многие газы, кроме шести, которые М. Фарадей назвал "постоянными": это азот, водород, воздух, гелий, кислород, оксид углерода CO.
Чтобы понять, в чем здесь дело, изучим подробнее изотермический процесс сжатия (расширения) пара. Мы видели, что изотерма реального газа отличается от изотермы идеального газа наличием горизонтального участка, соответствующего области существования двухфазной системы: насыщенного пара и жидкости.
Если проводить опыты при более высоких температурах (T1<T2<T3<Tk<T4), то можно обнаружить закономерность, общую для всех веществ (рис. 1).
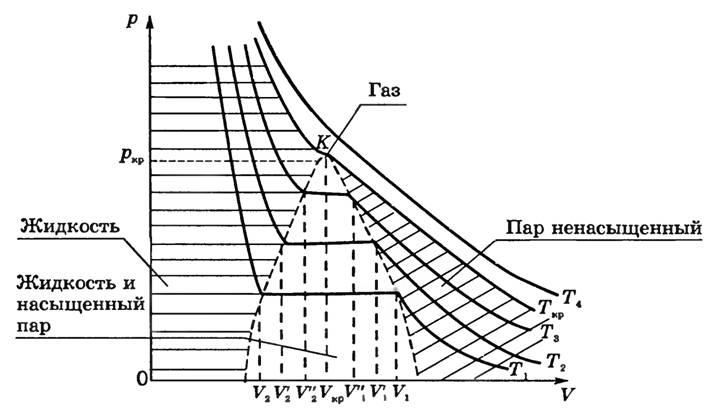
Рис. 1
Во-первых, чем выше температура, тем меньше объем, при котором начинается конденсация газа: V1>V’1>V’’1, еслиT1<T2<T3.
Во-вторых, чем выше температура, тем больше объем, занимаемый жидкостью после того, как весь пар конденсируется:
V2<V’2<V’’2.
Следовательно, длина прямолинейного участка изотермы с ростом температуры уменьшается.
Это легко объяснить: с ростом Τдавление насыщенного пара быстро нарастает, и для того, чтобы давление ненасыщенного пара сравнялось с давлением насыщенного, необходимо уменьшение объема. Причина увеличения объемаV2— в тепловом расширении жидкости при нагревании. Так как объемV1уменьшается, то плотность паров при увеличении температуры увеличивается; увеличение объемаV2свидетельствует об уменьшении плотности жидкости. Это значит, что различие между жидкостью и ее насыщенным паром в процессе такого нагревания сглаживается и при достаточно высокой температуре должно исчезнуть совсем.
Д. Менделеев установил, что для каждой жидкости должна существовать такая температура, которая экспериментально впервые была установлена для многих веществ Т. Эндрюсом и носит название критической температуры.
Критическая температураTкр— это такая температура, при которой плотность жидкости и плотность ее насыщенного пара становятся одинаковыми (рис. 2).

Рис. 2
На изотермах при Т=Tкргоризонтальный участок превращается в точку перегибаК.
Давление насыщенного пара какого-либо вещества при его критической температуре называется критическим давлениемpкр. Оно является наибольшим возможным давлением насыщенных паров вещества.
Объем, который занимает вещество при pкриtкр, называетсякритическим объемомVкр. Это наибольший объем, который может занимать имеющаяся масса вещества в жидком состоянии.
При критической температуре различие между газом и жидкостью исчезает, и поэтому удельная теплота парообразования становится равной нулю.
Совокупность точек, соответствующих краям горизонтального участка изотерм (см. рис. 1), выделяет в плоскости p-Vобласти существования двухфазной системы и отделяет ее от областей однофазных состояний вещества. Пограничная кривая области двухфазных состояний со стороны больших значений объема описывает состояние насыщенного пара и одновременно представляет собойкривую конденсации(начинается конденсация пара при изотермическом сжатии). Пограничная кривая со стороны меньших объемов представляет собой кривую, на которой заканчивается конденсация при сжатии насыщенного пара и начинается испарение жидкости при изотермическом расширении. Ее называюткривой испарения.
Существование критической температуры вещества объясняет, почему при обычных температурах одни вещества могут быть как жидкими, так и газообразными, а другие остаются газами.
Выше критической температуры жидкость не образуется даже при очень высоких давлениях.
Причина заключается в том, что здесь интенсивность теплового движения молекул оказывается настолько большой, что даже при относительно плотной их упаковке, вызванной большим давлением, молекулярные силы не могут обеспечить создание даже ближнего, а тем более дальнего порядка.
Таким образом, видно, что принципиальной разницы между газом и паром нет. Обычно газом называют вещество в газообразном состоянии, когда его температура выше критической. Паром называют также вещество в газообразном состоянии, но когда его температура ниже критической. Пар можно перевести в жидкость одним только увеличением давления, а газ нельзя.
В настоящее время все газы переведены в жидкое состояние при очень низких температурах. Последним в 1908 г. переведен гелий (tкр= -269 °С).



