
- •Теоретические основы
- •Гальванический элемент
- •Виды электродов
- •Обратимые электроды
- •Ионоселективные мембранные электроды
- •Характеристики гальванических элементов
- •Классификация гальванических элементов
- •Применение
- •Электролиз
- •Первый закон Фарадея
- •Второй закон Фарадея
- •Изменение электролизом веществ
Электрохимический ряд активности
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активностиметаллов в реакциях с водными растворами солей и кислот и для оценкикатодныхианодныхпроцессов приэлектролизе:
Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu2+/Eu[источник не указан 773 дня] до +1,691 В у пары Au+/Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au+.
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Уравнение Нернста
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциалсистемы сактивностямивеществ, входящих вэлектрохимическое уравнение, истандартными электродными потенциаламиокислительно-восстановительных пар.
Вывод уравнения Нернста
Нернст
изучал поведение электролитов при
пропускании электрического тока и
открыл закон. Закон устанавливает
зависимость между электродвижущей
силой ( разностью потенциалов ) и ионной
концентрацией. Уравнение Нернста
позволяет предсказать максимальный
рабочий потенциал, который может быть
получен в результате электрохимического
взаимодействия, когда известны давление
и температура. Таким образом, этот закон
связывает термодинамику с электрохимической
теорией в области решения проблем,
касающихся сильно разбавленных растворов,
где
![]()
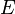 —электродный
потенциал,
—электродный
потенциал,
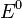 —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;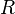 —универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
—универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);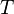 —абсолютная
температура;
—абсолютная
температура;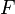 —постоянная
Фарадея,
равная 96485,35 Кл·моль−1;
—постоянная
Фарадея,
равная 96485,35 Кл·моль−1;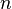 —число молей
электронов,
участвующих в процессе;
—число молей
электронов,
участвующих в процессе;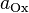 и
и
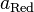 —активности
соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
—активности
соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Гальванический элемент
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани.
Виды электродов
В состав гальванического элемента входят электроды. Электроды бывают:
Обратимые электроды
Электроды 1-го рода — электроды, состоящие из металла, погруженного в раствор его соли;
Электроды 2-го рода — электрод, состоящий из металла, погруженного в раствор его нерастворимой соли, который содержит общий анион с нерастворимой солью (хлорсеребряный электрод,каломельный электрод, металл-оксидные электроды);
Электроды 3-го рода — электроды, состоящие из двух нерастворимых осадков электролитов, в менее растворимом есть катион, который образуется из металла электрода, а в более растворимом есть общий анион с первым осадком;
Газовые электроды — электроды, состоящие из неактивного металла в растворе и газа (кислородный электрод,водородный электрод);
Амальгамныеэлектроды — электроды, состоящие из раствора металла в ртути;
Окислительно-восстановительные электроды — электроды, состоящие из неактивного металла (ферри-ферро-электрод, хингидронный электрод).
