
5.Ионная связь
Ионная связь — это тип химической связи, энергия которой в основном определяется электростатическими силами притяжения противоположно заряженных ионов. Такую связь можно рассматривать как предельный случай ковалентной полярной связи, образованной атомами с сильно различающимися электроотрицательностями:
Ионная связь, как правило, возникает между атомами элементов групп IA и ПА, с одной стороны, и элементов группы VIIA —с другой. Но даже в соединениях, образованных этими элементами, не происходит полного разделения зарядов (т. е. полного перехода электрона от одного атома к другому) и электронная плотность между ионами не равна нулю. Поэтому более правильно говорить о степени ионности связи. Условно принято считать, что при А%>1,9 (эффективные заряды становятся больше ±0,5 заряда электрона) степень ионности больше 50%, и поэтому атомы рассматриваются как ионы с целочисленными зарядами.
6.Металлическая связь
При обычных условиях металлы (за исключением ртути) существуют в виде кристаллов. Характерная особенность этих кристаллов — высокие значения координационных чисел.
Взаимодействие, удерживающее атомы металлов в едином кристалле, называется металлической связью.
Природа металлической связи подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металлов количество таких электронов значительно меньше количества вакантных орбиталей, поэтому они могут переходить из одной орбитали в другую. Невысокие энергии ионизации металлов обусловливают легкость отрыва валентных электронов от атомов и перемещение по всему объему кристалла. Благодаря свободному перемещению электронов металлы обладают высокой электрической проводимостью и теплопроводностью.
Таким образом, относительно небольшое количество электронов обеспечивает связывание всех атомов в кристалле металла. Связь такого типа, в отличие от ковалентной, является не локализованной и ненаправленной. Именно этим объясняется пластичность металлов — способность необратимо менять свою форму под действием механических сил.
Упрощенно металл можно рассматривать как гигантскую молекулу, построенную из катионов, связанных между собой относительно свободными валентными электронами (электронным газом).
7. Межмолекулярные связи
Молекулы способны к взаимодействию между собой. Наличие такого взаимодействия обусловливает переход вещества из газообразного в конденсированное (жидкое или твердое) состояние и, следовательно, определяет многие физические свойства веществ: температуры кипения и плавления, электрическую проводимость, теплопроводность, твердость, плотность и др.
Силы межмолекулярного взаимодействия (их часто называют ван-дер-ваальсовыми силами), как и химическая связь, имеют электрическую природу, но, в отличие от последних, очень слабые, проявляются на значительно больших расстояниях и характеризуются отсутствием насыщаемости.
Различают три типа межмолекулярного взаимодействия, обусловленного электростатическим притяжением молекул
Ориентационное (или диполь-дипольное) взаимодействие осуществляется в результате взаимной ориентации соответствующих полюсов полярных молекул при их сближении друг с другом. Энергия ориентационного взаимодействия определяется прежде всего электрическим моментом диполя молекул (т. е. их полярностью): чем выше ЭМД молекул и меньше расстояние между ними, тем больше энергия такого взаимодействия.
Индукционное взаимодействие — это электростатическое взаимодействие полярной и неполярной молекульк В неполярной молекуле под действием поля полярной возникает наведенный (или индуцированный) диполь, который притягивается к постоянному диполю полярной
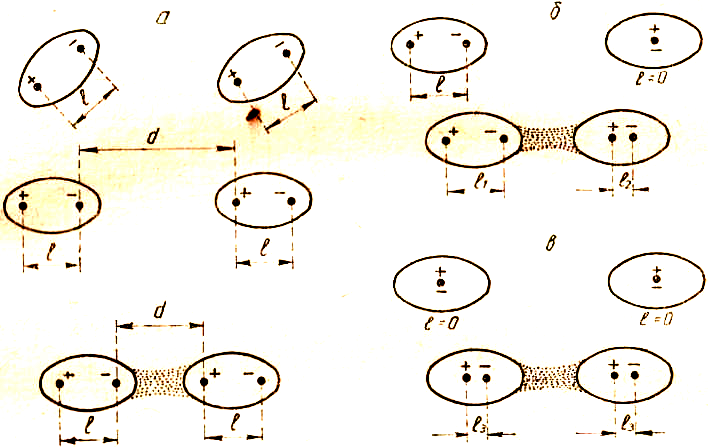
Рис. 5.15. Типы межмолекулярного взаимодействия:
а-ориентационное; б-индукционное; e-днсперснонное. /-длина диполя; d- межмолекулярное расстояние
молекулы. Подобное явление может наблюдаться и для полярных частиц, в результате чего увеличивается диполь-дипольное взаимодействие. Энергия индукционного взаимодействия определяется электрическим моментом диполя полярной молекулы и поляризуемостью неполярной молекулы.
Дисперсионное взаимодействие возникает в результате взаимного притяжения так называемых мгновенных диполей. Диполи такого типа возникают в неполярных молекулах в любой момент времени вследствие несовпадения электрических центров тяжести электронного облака и ядер, вызванного их независимыми колебаниями. Согласно квантовомеханическим представлениям, мгновенные диполи в системе взаимодействующих частиц возникают синхронно, взаимосогласованно.
Дисперсионное взаимодействие — наиболее универсальное и проявляется между любыми молекулами. Благодаря ему возможен перевод в жидкое или твердое состояние веществ, состоящих из неполярных молекул,
Водородная связь - это химическая связь, образованная положительно поляризованным водородом, химически связанным в одной молекуле, и отрицательно поляризованным атомом фтора, кислорода и азота (реже хлора, серы и др.), принадлежащих другой молекуле. Водородная связь может быть внутримолекулярной, если она образуется между двумя группами одной и той же молекулы, и межмолекулярной, если она образуется между разными молекулами (А-Н + В-К = А-Н...В-К).
