
n1
.pdfГЛАВА 9. МЕТАБОЛІЗМ БІЛКІВ
Обмін білків є центральною ланкою усіх біохімічних процесів, що лежать в основі життя. Через це вивчення молекулярних механі- змів перетворення білків дозволяє зрозуміти головні закономірності обміну речовин, а також формування структури і функцій організму.
Фундаментальне значення білків для життя полягає в їхній пла- стичній і біокаталітичній функціях, без яких неможливе саме існу- вання організмів.
Особливістю білкового обміну в організмі вищих тварин і лю- дини є відсутність значних резервів готових білків, які можуть бути мобілізовані у разі потреби.
Участь у синтезі білків є головним призначенням амінокислот. Здатність клітин здійснювати ці синтетичні процеси залежить від наявності фонду вільних амінокислот (амінокислотний пул), збалан- сованого стосовно потреб клітин в кожній із 20 амінокислот. Кліти- ни ж не мають запасних форм амінокислот, подібно глікогену для цукрів і триацилгліцеринів для жирних кислот.
Усе це зумовлює необхідність систематичного надходження біл- ків в організм із їжею. Харчові речовини є незамінними факторами зовнішнього середовища, які на відміну від інших зовнішніх факторів стають власними елементами організму, беручи участь в обміні ре- човин та енергії.
«Живлення» в загальнобіологічному смислі характеризує всю суму біохімічних процесів, пов’язаних з надходженням та перетво- ренням харчових речовин в організмі для забезпечення його енергі- єю і структурними речовинами.
Загальна добова потреба у білках дорослої людини становить 80–100 г, з них половина має бути тваринного походження.
Біологічна цінність білкового харчування залежить не тільки від кількості білків у їжі, а й від їх якісного складу.
Білки тварин містять повний набір амінокислот, у тому числі й ті, які не синтезуються в організмі людини, або синтезуються в не- достатніх кількостях і не забезпечують потреб організму – незамінні і напівзамінні амінокислоти.
Білки різних харчових продуктів нерівноцінні за своїм біологіч- ним значенням, що залежить, головним чином, від вмісту в них не- замінних амінокислот.
Дефіцит надходження з їжею хоча б однієї незамінної амінокис- лоти протягом тривалого часу супроводжується негативним азотис- тим балансом організму.
Для нормального розвитку організму і побудови тіла незамінні амінокислоти в їжі повинні бути збалансованими, тобто знаходитись у певних співвідношеннях, у яких вони використовуються для біоло- гічного синтезу білків тканин.Чим ближчі білки їжі за своїм аміноки- слотним набором до складу білків тканин людини, тим вища їх хар- чова цінність. Білки, котрі містять усі незамінні для людини аміно- кислоти, характеризуються як повноцінні, а білки, в яких представле- ні не всі незамінні амінокислоти – як неповноцінні.
321
Процес обміну білків включає перетворення в шлунково- кишковому тракті – ентеральний обмін, внутрішньоклітинний, або проміжний, так званий інтермедіарний обмін, і утворення кінцевих продуктів білкового обміну.
Біологічне значення процесу перетравлювання білків у шлунко- во-кишковому тракті дуже велике. Під впливом комплексу гідролі- тичних ферментів молекули білків їжі розщепляються до амінокис- лот, втрачаючи таким чином свою видову і тканинну специфічність, і стають доступними для клітини. Більша частина амінокислот всмо- ктується через мембрани клітин тонкої кишки і надходить у кров.
Складні білки (нуклеопротеїни, хромопротеїни та ін.) спочатку розщеплюються на простий білок і простетичні групи (нуклеїнові ки- слоти, гем та ін.).
Прості білки розщеплюються до амінокислот, а простетичні групи, в свою чергу, під впливом відповідних ферментів розклада- ються на простіші сполуки.
У ротовій порожнині білки їжі піддаються тільки механічній об- робці, тому що слина не містить протеолітичних ферментів. Процес хімічного перетворення білків починається в шлунку.
Перетравлювання білків у шлунку
Усі ферменти травлення білків належать до класу гідролаз. Во- ни синтезуються і секретуються у формі неактивних проферментів або зимогенів, тому не пошкоджують секреторних клітин, в яких відбувається їх синтез. Активація ферментів відбувається в порож-
нині шлунка і просвіті кишечника.
За умов активації відбувається специфічний протеоліз у ділянці N-кінцевої частини зимогену, що призводить до утворення актив- ного ферменту.
У шлунку прості і складні білки зазнають фізико-хімічних і фер- ментативних перетворень. Обгорточні клітини слизової оболонки шлунка виробляють соляну кислоту, а головні клітини виробляють і секретують пепсиноген – попередник активного пепсину. Таким чи- ном, шлунковий сік містить соляну кислоту і протеолітичні фермен- ти, які розщеплюють білки. Завдяки наявності соляної кислоти шлу- нковий сік має кислу реакцію. Загальна кількість шлункового соку, що виділяється за добу становить у середньому 2,5 л.
Точна природа механізму утворення соляної кислоти поки що за- лишається невідомою, але встановлено, що джерелом іона С1− є плаз- ма. Секреція обгорточних клітин стимулюється гістаміном і групою го- рмонів – гастринів, які виробляються слизовою пілоричної і фундальної ділянок шлунка. Соляна кислота виконує в процесі травлення ряд важ- ливих функцій. Вона денатурує білки тих харчових продуктів, які не за- знали термічної обробки в процесі приготування їжі, а денатуровані бі- лки швидше розщеплюються ферментами, ніж нативні; соляна кислота сприяє їх набуханню, збільшуючи поверхню, а отже, площу контакту з ферментами. Це особливо характерно для білків шкіри, сухожиль спо- лучної тканини (колагену, еластину, кератину) й інших білків, які важко перетравлюються. Під впливом соляної кислоти пепсиноген
322
(М.м. 40000) перетворюється в активний пепсин (М.м. 32700) внаслідок відщеплення N-кінцевого пептиду. Кисла реакція шлункового соку є оп- тимальною для виявлення каталітичної дії пепсину, оскільки в фермен- ті домінуючими є аніонні групи. І нарешті, соляна кислота має бактери- цидні властивості, атакож сприяє евакуаціїїжі зі шлунка.
Субстратами пепсину у шлунку є або нативні білки їжі, або білки, денатуровані при варінні харчових продуктів. Пепсин є ендопептида- зою і швидко гідролізує в білках пептидні зв’язки, утворені карбок- сильними групами ароматичних амінокислот (фенілаланіну, тирози- ну), а також триптофану. Дещо повільніше пепсин гідролізує пепти- дні зв’язки, утворені іншими амінокислотами, наприклад, лейцином
ідикарбоновими амінокислотами.
Зогляду на те, що їжа у шлунку перебуває обмежений час, вважа-
ють, що in vivo пепсин гідролізує білки їжі в основному до суміші полі- пептидів різного ступеня складності, які отримали назву пептонів.
Зі слизової шлунка людини, поряд із пепсином, був виділений ще один протеолітичний фермент – гастриксин або пепсин С.
Пепсин і гастриксин виявляють максимальну каталітичну акти- вність при різних значеннях рН: пепсин – при рН = 1,5–2,0, а гастри-
ксин – при рН = 3,0–5,0.
Співвідношення між гастриксином і пепсином у шлунковому со- ку здорової людини складає приблизно 1:5,5, але може змінюватися при патологічних станах. Так, при гіперацидному гастриті воно складає 1:3, а при виразковій хворобі шлунка – 1:4.
Якщо ж секреція HCl не забезпечує підтримання кислотності шлункового вмісту на рівні значень рН = 2–3, перетравлювання біл- ків у шлунку може виявитись дуже незначним, наприклад, при перні- ціозній анемії. При шлунковій ахілії перетравлювання білків у шлун- ку взагалі не відбувається через відсутність як пепсину, так і кислоти.
У разі тривалого вживання рослинної їжі, небагатої на білки, виді- ляється відносно менше HCl, підвищується значення рН у шлунковому соку, що створює сприятливіші умови для дії гастриксину, ніж пепсину. Інавпаки, за умов багатої на білки їжі (м’ясні, рибні продукти, а також бобові) утворюється шлунковий сік із великим вмістом соляної кислоти і, отже, з нижчимзначенням рН, що сприяє прояву дії пепсину.
Пепсин, подібно до багатьох рослинних і тваринних протеаз, ви- кликає згортання молока, тобто забезпечує першу стадію його пере- травлювання. У жуйних тварин згортання молока відбувається в ре- зультаті дії специфічного ферменту хімозину, який знаходиться в си- чузі (четвертому шлуночку) молочних телят. Хімозин, або сичужний фермент, є досить активним у дітей. Він каталізує відщеплення пеп- тиду від білка молока казеїногену, перетворюючи його в казеїн. Останній, взаємодіючи з солями кальцію, котрі завжди присутні у молоці, утворює слабкорозчинний казеїнат кальцію (сир). Сир до- сить довгий час затримується у шлунку, що сприяє його більш пов- ному розщепленню пепсином.
У дорослих людей, які звичайно вживають змішану їжу, хімозин, як правило, малоактивний або зовсім відсутній, і перетворення ка- зеїногену в казеїн відбувається під впливом пепсину.
323
Внаслідок дослідження структури гастриксину, хімозину і пепси- ну одержані дані, які доводять походження усіх трьох ферментів від загального попередника.
Перетравлювання білків у тонкому кишечнику
Вміст шлунка надходить у дванадцятипалу кишку та інші відділи тонкого кишечника, де на нього діє комплекс протеолітичних ферме- нтів, які синтезуються у підшлунковій залозі і слизовій оболонці тон- кого кишечника. Підшлункова залоза синтезує і секретує лужну рідину, що містить неактивні попередники протеаз, а саме трипсиноген, три
хімотрипсиногена, прокарбоксипептидази А і В і проеластазу. Під впли-
вом ферменту кишечника ентеропептидази трипсиноген специфічно і швидко перетворюється в активний трипсин. Швидкість активації трипсиногену під впливом ентеропептидази у 2000 разів вища, ніж швидкість аутокаталітичного перетворення під впливом трипсину. Функція ентеропептидази є вирішальною, оскільки трипсин, утворе- ний з трипсиногену, є активатором інших неактивних проферментів (зимогенів), перетворюючи їх у відповідні активні форми.
Трипсиноген складається з одного поліпептидного ланцюга, який в процесі активації піддається обмеженому гідролізу, внаслідок якого відщеплюється N-кінцевий гексапептид вал-(асп)4-ліз зимоге- ну. Відщеплення цього пептиду супроводжується появою фермента- тивної активності.
Хімотрипсиногени внаслідок активації перетворюються в хімо- трипсини.
Лужний панкреатичний сік нейтралізує кислий вміст, що надхо- дить зі шлунка, і забезпечує слабколужне середовище, оптимальне для гідролітичної дії панкреатичних ферментів, кожен з яких має свою специфічність. Трипсин гідролізує пептидні зв’язки, утворені карбоксильними групами аргініну і лізину. Хімотрипсини найбільш активні стосовно пептидних зв’язків, утворених карбоксильними групами фенілаланіну, тирозину і триптофану. Таким чином, ці фе- рменти здійснюють більш глибокий гідроліз білків, у порівнянні з гі- дролізом у шлунку, до невеликих пептидів. Карбоксипептидаза А (цинковмісний фермент) швидко відщеплює С-кінцеві амінокислотні залишки з ароматичними або аліфатичними боковими ланцюгами.
Карбоксипептидаза В діє тільки на петиди, що мають на С-кінці залишки аргініну або лізину.
Слизова оболонка кишечника також містить ферменти, які гід- ролізують пептидні зв’язки. Хоча ці ферменти можуть секретуватися в кишковий сік, вони функціонують переважно внутрішньоклітинно.
Екстракти слизової кишечника містять групу ферментів – аміно- пептидаз. Ці ферменти під час дії на поліпептидні ланцюги почерго- во звільняють N-кінцеві амінокислоти. Лейцинамінопептидаза, Zn2+- вмісний фермент, має широку специфічність стосовно N-кінцевих за- лишків поліпептиду. Шляхом послідовного гідролізу N-кінцевих пеп- тидних зв’язків фермент розщеплює пептиди до вільних амінокислот.
Екстракти слизової кишечника містять також дипептидази, на- приклад активовану Co2+ або Mn2+ гліцилгліцин-дипептидазу, яка,
324
разом з тим, не впливає на трипептид гліцилгліцилгліцин; отже для дії цього ферменту необхідна наявність поруч із зв’язком, який гід- ролізується, вільних амінної і карбоксильної груп.
На завершальному етапі розщеплення білків важливу роль відігра- ютьмікроелементиZn, Mn, Mg, Co, підвищуючиактивністьпептидаз.
Перетравлювання білків, як і вуглеводів, відбувається не тільки в порожнині кишечника а й на поверхні клітин слизової оболонки – так зване контактне, або пристінкове, перетравлювання (між мікро- ворсинками). У порожнині шлунка і кишечника розщеплюються пе- реважно білкові молекули й великі пептиди, а об’єктом пристінково- го перетравлювання є олігопептиди і дипептиди.
Таким чином, послідовна дія протеолітичних ферментів у шлун- ку і тонкому кишечнику спричиняє гідроліз більшості харчових білків до амінокислот. Хоча трипсин і хімотрипсин діють швидше і ефек- тивніше у випадку попередньої дії на білок пепсину, за спільної дії цих панкреатичних ферментів ефективний гідроліз білка може здій- снюватися і без попередньої дії пепсину.
Тому хворі з резекованим шлунком зберігають достатню здат- ність використовувати харчові білки. У той же час, у разі пошко- дження тканини підшлункової залози або затримки току рідини по панкреатичній протоці, умови перетравлювання білків значно погі- ршуються; при цьому в товстий кишечник надходять неперетравлені харчові білки, і посилюється процес їх гниття під впливом ферментів бактерій. У таких умовах у фекаліях можлива поява значної кількості незасвоєного харчового білка.
У нормі весь процес перетравлювання білків у травному каналі триває в середньому 8–12 годин після вживання їжі. Цей час зале- жить від кулінарної обробки їжі, природи білка, динаміки секреції травних соків і, особливо, від активності ферментів. Краще перетра- влюються білки таких продуктів, як молоко, м’ясо, сир. Погано пе- ретравлюються і засвоюються такі білки м’яса, як кератин, колаген та деякі інші білки сполучної тканини.
Всмоктування амінокислот із кишечника
Всмоктування амінокислот відбувається, головним чином, у тон- кому кишечнику. Механізм всмоктування амінокислот являє собою складний біологічний процес, в якому поєднуються фільтрація, ос- мос, дифузія і активна всмоктувальна дія ворсинок. Однак головним є трансмембранний транспорт за допомогою спеціальних білків- переносників, котрий потребує витрат енергії. Це активний транс- порт, який здійснюється проти градієнта концентрації амінокислот. Для здійснення цього транспорту використовується енергія метабо- лічних процесів, переважно резервована в АТФ.
Встановлено наявність п’яти або більше специфічних транспор- тних систем, кожна з яких функціонує при транспорті певної групи близьких за будовою амінокислот: 1) нейтральних аліфатичних амі- нокислот; 2) циклічних амінокислот; 3) основних амінокислот; 4) ки- слих амінокислот і 5) проліну.
325
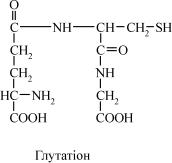
Вважають, що білки-переносники подібні до ферментів не тільки за своєю специфічністю, а й за наявністю центрів (контактних діля- нок), якими з’єднуються з відповідними амінокислотами, утворюючи з ними комплекси. Амінокислоти конкурують одна з одною за відпо- відні ділянки зв’язування. Так, всмоктування лейцину (якщо він прису- тній у відносно високих концентраціях) зменшує всмоктування ізолей- цину і валіну. Ця система транспорту амінокислот функціонує в кише- чнику, мозку, нирках. Наступний механізм одержав назву γ-глута- мільного циклу; у ньому беруть участь шість ферментів, один з яких є мембранозв’язаним, а інші знаходяться в цитозолі. В циклі бере участь трипептид глутатіон – γ-глутамінілцистеїлгліцин:
У функціонуванні γ-глутамільного циклу провідну роль відіграє мембранозв’язаний фермент γ-глутамілтрансфераза, який каталізує реакцію переносу глутамінільного залишку глутатіона на амінокис- лоту, яка транспортується. При цьому акцепторами γ-глутамінільної групи можуть бути всі амінокислоти, за винятком проліну:
амінокислота + глутатіон (γ-глутамінілцистеїлгліцин) → → γ-глутамініламінокислота + цистеїлгліцин
Після цього γ-глутамініламінокислота надходить у клітину разом з цистеїлгліцином. На наступній стадії γ-глутамініламінокислота розще- плюється внаслідок трьох послідовних реакцій. Таким чином, відбува- ється транспорт однієї молекули амінокислоти в клітину, при цьому ви- користовується енергія гідролізу пептидних зв’язків глутатіону. Для продовження процесу глутатіон регенерується в результаті трьох послі- довних реакцій, кожназ яких протікаєз витратою енергії АТФ.
Утворений глутатіон може брати участь у наступному циклі з іншою амінокислотою. Таким чином, для транспорту у клітину кожної моле- кулиамінокислотивикористовуютьсятрикінцевіфосфатнізв’язкиАТФ.
Ключовий фермент γ-глутамільного циклу виявлено у високих концентраціях, окрім епітелію ворсинок кишечника, у нирках, слин- них залозах, жовчній протоці, сім’яниках та інших тканинах.
З кишечника в незначній кількості можуть всмоктуватися неве-
ликі пептиди.
Проникність слизової оболонки кишечника у немовлят вища, ніж у дорослих, тому у кров малюків можуть надходити антитіла мо-
326
лозива. Цьому сприяє наявність у молозиві інгібітора трипсину. Че- рез це, а також через низьку концентрацію протеолітичних фермен- тів у кишечнику немовлят може відбуватися всмоктування деякої кі- лькості нативних білків, які зумовлюють сенсибілізацію організму. Це, можливо, є причиною ідіосинкразії до білків їжі у дітей.
Гниття білків у кишечнику
У процесі перетравлювання у шлунку і тонкому кишечнику осно- вна маса білків розщеплюється і всмоктується переважно у вигляді амінокислот. Проте частина білків сухожиль, апоневрозів шкіри, які важко перетравлюються, і деяка кількість вільних амінокислот над- ходять у товсту кишку.
При багатьох захворюваннях, особливо у разі кишкових інфек- цій, перетравлювання і всмоктуваня білків погіршується, тому біль- шість їх потрапляє у товстий кишечник. Залежно від кількості харчо- вих продуктів і стану апарату травлення кількість нерозщеплених бі- лків може складати від 2–3 до 5–10%, а іноді й більше.
Товстий кишечник населений мікроорганізмами, які використо- вують харчові амінокислоти для свого росту. Вони мають ферментні системи, що каталізують різноманітні перетворення харчових білків і вільних амінокислот (гідроліз, окислення, відновлення, дезамінуван- ня, декарбоксилювання, деметилювання). Через це в товстому кише- чнику створюються оптимальні умови для утворення отруйних проду- ктів розпаду амінокислот, зокрема фенолу, індолу, крезолу, скатолу, сірководню, метилмеркаптану, а також нетоксичних для організму сполук – спиртів, жирних кислот, кетокислот, гідроксикислот та ін. Усі ці перетворення амінокислот, які зумовлені діяльністю мікроорганіз- мів кишечника, одержали загальну назву: гниття білків у кишечнику.
У процесі поступового і глибокого розпаду сірковмісних аміно- кислот (цистину, цистеїну і метіоніну) в кишечнику утворюються сір- ководень (H2S) і метилмеркаптан (CH3SH).
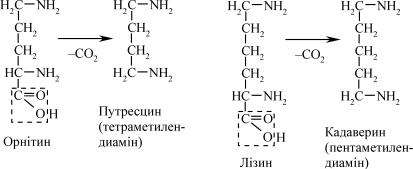
Диамінокислоти зазнають процесу декарбоксилювання з утво- ренням амінів. Два з них – путресцин і кадаверин – давно відомі через їх неприємний запах. Путресцин (putrificatio – гниття, лат.) – утворю- ється при декарбоксилюванні орнітину, а кадаверин (cadaver – труп, лат.) – при декарбоксилюванні лізину.
327

Путресцин може утворюватися й іншим шляхом, а саме: внаслі- док декарбоксилювання аргініну, з утворенням агматину. Останній перетворюється на путресцин у ході реакції, котра каталізується аг- матинуреагідролазою, яку також містить кишкова паличка.
Агматин є біологічно активним диаміном. Він здатний виклика- ти зниження вмісту цукру в крові.
Путресцин і кадаверин, ймовірніше за все, знешкоджуються в клі- тинах слизової оболонки кишечника під впливом специфічних диаміно- оксидаз, після чого легко всмоктуються в кров івиділяютьсяз сечею.
Із циклічних амінокислот тирозину і триптофану за послідов- ного руйнування їх бічного ланцюга в результаті реакції декарбок- силювання, дезамінування, а потім і деметилювання утворюють- ся токсичні продукти: крезол і фенол – із тирозину, скатол та ін- дол – із триптофану.
Після всмоктування ці продукти через ворітну вену надходять у печінку, де знешкоджуються шляхом утворення нетоксичних пар-
328
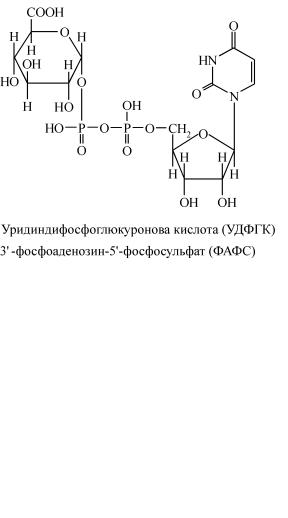
них сполук із сірчаною або глюкуроновою кислотами. Останні зда- тні до взаємодії із вищезгаданими токсичними продуктами, пере- буваючи в активній формі. Активна форма сірчаної кислоти являє собою 3′-фосфоаденозин-5′-фосфосульфат (ФАФС); активна форма глюкуронової кислоти знаходиться у вигляді уридиндифосфоглю- куронової кислоти (УДФГК).
Нижче подано хімічну будову ФАФС і УДФГК:
Джерелами ФАФС є проміжні продукти обміну пуринових ну- клеотидів і вуглеводів. Попередниками УДФГК в організмі є ме- таболіти глюкози й УТФ. У печінці містяться специфічні фермен-
ти – арилсульфотрансфераза і УДФ-глюкуронілтрансфераза, які ка-
329
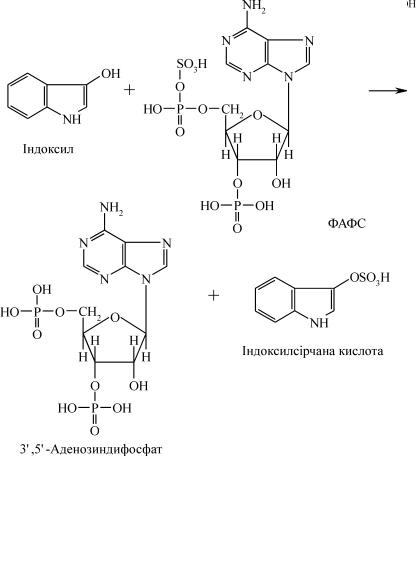
талізують, відповідно, перенесення залишку сірчаної кислоти з ФАФС і залишку глюкуронової кислоти з УДФГК на будь-який із названих вище продуктів. Правда, на відміну від крезолу і фенолу, які мають гідроксильну групу, скатол і індол попередньо окислю- ються у скатоксил та індоксил:
Як приклад нижче наведено механізм знешкодження індолу.
Таким чином, індол зв’язується у вигляді ефіру сірчаної кислоти, калієва або натрієва сіль якої отримала назву тваринного індикану. Останній виводиться із сечею:
330
