- •Мінітерство аграрної політики та продовольства україни
- •3.1 Правила охорони праці та техніки безпеки під час роботи в лабораторії
- •Лабораторна робота № 1
- •Правила роботи з мікроскопом
- • Питання для закріплення
- •Лабораторна робота № 2 тема: «Вивчення морфологічних ознак міцеліальних грибів. Вивчення морфологічних ознак дріжджів в препараті «розчавлена» і «висяча» крапля»
- •Контрольні питання
- • Питання для закріплення
- •Лабораторна робота № 3 тема: «Приготування поживних середовищ»
- •Контрольні питання
- •3. Прибирання робочих місць
- •4. Оформлення звітів
- •5. Захист звітів
- •2. Література та нормативна документація
- •Основні види поживних середовищ
- •Спеціальні поживні середовища
- •Способи стерилізації лабораторного посуду
- • Питання для закріплення
- •Лабораторна робота № 4 тема: «Органолептична оцінка якості і визначення підйомної сили пресованих дріжджів»
- •2. Інструктаж по виконанню роботи (роботу виконує кожний студент)
- •Правила відбору проб пресованих дріжджів
- •Визначення підйомної сили пресованих дріжджів.
- • Питання для закріплення
- •Лабораторна робота № 5 тема: «Органолептична оцінка якості і визначення підйомної сили сушених дріжджів»
- •2. Література та нормативна документація
- •Визначення форми, кольору, смаку і запаху сушених дріжджів
- •Визначення підйомної сили пресованих дріжджів
- • Питання для закріплення
- •Лабораторна робота № 6 тема: «Мікробіологічний контроль борошна на наявність картопляної хвороби»
- •2. Література та нормативна документація
- •Визначення загальної кількості мікроорганізмів в борошні
- •Визначення спороутворюючих мікроорганізмів у борошні
- • Питання для закріплення
- •Лабораторна робота № 7 тема: «Мікробіологічний контроль крему борошняних кондитерських виробів»
- •2. Інструктаж по виконанню роботи (роботу виконує кожний студент)
- •3. Прибирання робочих місць
- •4. Оформлення звітів
- •5. Захист звітів
- •2. Література та нормативна документація:
- • Питання для закріплення
- •Лабораторна робота № 8 тема: «Облік мікробіологічного контролю борошна та крему борошняних кондитерських виробів.
- •2.Інструктаж по виконанню роботи (роботу виконує кожний студент)
- • Питання для закріплення
- •Висновки
- •Література та нормативна документація
- •Додатки
Лабораторна робота № 2 тема: «Вивчення морфологічних ознак міцеліальних грибів. Вивчення морфологічних ознак дріжджів в препараті «розчавлена» і «висяча» крапля»
Мета: Оволодіння технікою приготування препаратів пліснявих грибів і вивчення їх морфологічних ознак. Набуття практичних навичок по вивченню морфологічних ознак і оволодіння методами досліджень рухомості дріжджів у препараті «розчавлена» і «висяча крапля».
Після проведення лабораторної роботи студент повинен:
знати: методику і техніку приготування препаратів пліснявих грибів і дріжджів, їх морфологічні ознаки, методику дослідження рухомості дріжджів у препараті «розчавлена» і «висяча крапля»;
вміти: готувати препарати пліснявих грибів і дріжджів, розпізнавати культуральні ознаки пліснявих грибів і дріжджів, досліджувати рухомість дріжджів у препараті «розчавлена» і «висяча крапля».
Контрольні питання
Назвіть особливості будови тіла грибів.
Які способи розмноження цвілевих грибів?
У чому полягає практичне значення цвілевих грибів?
Яку форму мають дріжджові клітини?
За якими ознаками можна розрізнити бактеріальну клітину від дріжджової?
На чому засноване практичне використання дріжджів?
Місце проведення: Лабораторія мікробіології
Хід роботи
Інструктаж з охорони праці
2. Інструктаж по виконанню роботи (роботу виконує кожний студент)
2.1 Вивчити морфологію пліснявих грибів на чашках Петрі візуально, за допомогою лупи і мікроскопу
Приготувати із міцелію грибів мікроскопічний препарат типу «розчавлена крапля»
Замалювати мікроскопічну картину і описати культуральні ознаки пліснявих грибів
Приготувати фарбований препарат «розчавлена» і «висяча» крапля з дріжджів
Вивчити морфологічні властивості і рухомість дріжджів у цих препаратах
3. Оформлення звітів
4. Прибирання робочих місць
4.1 Злити фарбу із кювета в спеціальний посуд
4.2 Вимити предметне скло з мазками, кювет, місток з миючим розчином
4.3 Закрити герметично спиртівку
4.4 Витерти об'єктив мікроскопу спиртом або бензином
4.5 Заховати мікроскоп, додаткове обладнання та матеріали до шафи
4.6 Здати робоче місце черговому
5. Захист звітів
Забезпечення роботи:
Обладнання і матеріали: культури пліснявих грибів на поживному середовищі Сабуро або Сусло-агарі, культури дріжджів, мікроскопи, предметні і покривні скельця, предметні скельця із заглибленням, спиртівки, бактеріологічні петлі, пастерівські піпетки, препарувальні голки, колби з водою, фільтрувальний папір, фарба метиленова синька, імерсійне масло.
Література та нормативна документація:
Мармузова Л.В. Основы микробиологии, санитарии и гигиены в пищевой промышленности / Л.В. Мармузова. – М. : ИРПО, 2000. – 136 с.
Веселовська Т.Э. Технічна мікробіологія / Т.Э. Веселовська // Навчально-методичний посібник. – НМЦ по підготовці молодших спеціалістів, 2005. – 82 с.
Вербина Н.Н. Микробиология пищевых производств / Н.Н. Вербина, Ю.В. Контерева – М. «Агропромиздат», 1988. – 256 с.
Теоретичні основи
Плісняві гриби – безхлорофільні рослинні організми, розповсюджені у природі. Вони розвиваються у вигляді ніжних нальотів різного кольору тільки при доступі кисню. Ця група мікроорганізмів під назвою Mycota включає до 100 тис. видів.
Частина Mycota розвиваються за рахунок органічних речовин відмерлих організмів, тому вони беруть участь у кругообігу речових у природі. Деякі з них розвиваються на живих організмах і викликають їх захворювання. Частина грибів викликає псування харчових продуктів і виділяє ядовиті сполуки – мікотоксини.
Клітини міцеліальних грибів мають витягнуту форму у вигляді ниток (гіфів), розміри яких досягають 5-30мкм у діаметрі.
Міцеліальні гриби розмножуються вегетативним і статевим способом, які пов’язані з утворенням спор.
Дріжджі об’єднують одноклітинні грибні організми, що не мають справжнього міцелію.
Дріжджі можуть мати овальну, яйцеподібну, круглу, лимоновидну, еліптичну та інші форми (рис. 2.1). Розміри дріжджів варіюються від 1,5 – 2 до 10 мкм в поперечному і до 20 – 5мкм довжини.
Класифікують дріжджі за способами вегетативного розмноження (брунькування, ділення), здатності до спороутворення, а також по фізіологічним ознакам.
Для харчової промисловості найбільше значення мають рід сахароміцес (Saccharomuces). В цей рід входять як природні види, так і види, отримані шляхом селекції. Їх називають расами дріжджів. Вони розрізняються здатністю зброджувати різні цукри, інтенсивністю бродіння, кількістю спирту, що утворюється, оптимальною температурою бродіння, утворенням спор та ін.
|
Рис.
2.1
– Форми
дріжджів
|
|
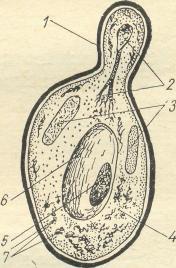
Рис. 2.2- Схема будови дріжджової клітини 1 – оболонка; 2 – ядро, що ділиться;
7 – мітохондрії. |
Найбільш широко використовується вид дріжджів сахароміцес церевізіа (Saccharomyces: Sacch. Cerevisiae). Вони мають круглу чи овальну форму клітини (рис.2.2). Їх використовують для отримання етилового спирту, а також в пивоварінні, квасоварінні, хлібопеченні. Кожне виробництво використовує свої специфічні раси дріжджів, що дають можливість отримати кінцевий продукт із заданими властивостями.
Методичні вказівки
Вивчення морфологічних ознак пліснявих грибів на чашках Петрі і в препараті «розчавлена крапля»
Морфологічні ознаки грибів вивчають у культурах, вирощених на агарі у чашках Петрі і в приготовлених з цих культур препаратах типу «розчавлена крапля». На предметне скло наносять воду у такій кількості, щоб вона заповнила простір між покривним і предметним скельцями; для приготування препарату обережно беруть препарувальними голками невелику кількість міцелію гриба, вносять його в краплю води; на краплю кладуть покривне скло і злегка розчавлюють краплю. Мікроскопують культури і препарати під об'єктивом 40.
а) Гриб мукор – беруть його чорнувато-сірий пухнастий повітряний міцелій. При мікроскопуванні виявляють одноклітинний міцелій і органи розмноження – споронгоносії (прості відростають одиночно). Спорангії на їх верхівках – великі шароподібні, з масою спор. В препараті багато вільних спор (одноклітинних, кулевидних, еліпсовидних, гладких, сіруватих).
б) Гриб оідіум – знімають голкою його білий міцелій. Встановлюють під мікроскопом багатоклітинність міцелію і відсутність спеціальних органів розмноження. Гриб розмножується оідіями, які утворюють на кінцях гіф, що роз'єднується у вигляді прямокутних безбарвних клітин, також є ланцюжки нероз'єднаних оідій.
в) Гриб альтернарія – беруть голкою з темної частини грибниці. Роздивляються багатоклітинний міцелій і великі багатоклітинні конідії загострено-витягнутої форми, темнозабарвлені гіфи, слаборозвинуті і мало відрізняються від вегетативних гіфів.
г) Гриб пеніциліум – беруть молоду зелену частину грибниці на кордоні з білим краєм, знаходять багатоклітинні гіфи і органи розмноження – конідіє-носії (багатоклітинні гіфи , розташованих на кінцях у вигляді кістей). На кінцях гілок є стеригми – ланцюжки конідій (одноклітинні, голубувато-зеленуватого кольору).
д) Гриб кладоспоріум – вивчають безпосередньо у чашках з об'єктивом 40, для цього знімають кришку чашки Петрі, роздивляються крайню частину колонії, де тільки починається її темна зона.
с) Гриб катенулярія – аналогічно кладоспоріум, тільки роздивляються краї колонії, де починається шоколадно-коричневе забарвлення.
Вивчення рухомості дріжджів в препараті «розчавлена крапля»
Для приготування «розчавленої краплі» на предметне скла наносять краплю фізіологічного розчину, в яку бакпетлею вносять мікробну культуру, яку вирощують на МПА, і розтирають у суспензію, після чого накривають її покривним склом так, щоб у рідині утворились бульбашки повітря. При дослідженні на рухомість дріжджів, вирощених у МПА, на предметне скло наносять краплю бульйонної культури пастерівською піпеткою. Краплина дослідного матеріалу повинна бути невеликою, щоб після її притискання покривним склом не було надлишку рідини, яка виступає з-під покривного скла.
Надлишок рідини видаляють фільтрувальним папірцем. Препарат розташовують на предметний столик мікроскопу, роздивляються під об'єктивом 8х. Тубус опускають на відстань 5 мм від покровного скла, встановлюють освітлення і досліджують під імерсійним об'єктивом.
По закінченні дослідження препарат знімають з предметного столика, обережно здвигають покривне скло, щоб край його висувався за предметне, і пінцетом скидають у сосуд з дезінфікуючою рідиною.
При спостеріганні під мікроскопом можна помітити активний рух дріжджів, які рухаються у різних напрямках з різною швидкістю.
Не слід змішувати самостійний рух дріжджів з броунівським рухом зважених у воді дрібних часток, а також з чисто механічним переміщенням, коли з потоком рідини усі частки рухають в одному напрямку з однаковою швидкістю.
Вивчення рухомості дріжджів у препараті «висяча крапля»
Для приготування «висячої краплі» дослідний матеріал наносять на середину знежиреного покривного скла. Потім беруть предметне скло з заглибленням, на його краї наносять тонкий шар вазеліну, і скло, повернувши заглибленням униз прикладають до покривного скла таким чином, щоб краплина знаходилась у центрі заглиблення.
Предметне і покривне скельце перевертають. Таким чином крапля знаходиться у герметично закритій вологій камері. Для того, щоб стінки камери не запітніли, предметне скло і заглиблення зволожують.
В якості матеріалу на дослідження рухомості використовують молоді (6...12...18 годинні, але не старше однодобових) бульйонні культури. Можна брати і молоді агарові культури.
Для цього попередньо готують суспензію на стерильному фізіологічному розчині або в стерильній воді.
Для дослідження під мікроскопом звужують діафрагму і заходять край краплі за сухою слабкою (8х) системою об'єктиву. Знайдену краплину пересувають у центр поля зору і роздивляються під імерсійним об'єктивом.
Для цього: на поверхню покривного скла наносять краплину кедрової олії, імерсійний об'єктив опускають під контролем ока збоку на препарат в краплю кедрової олії і злегка її розчавлюють (не допускають щоб об'єктив торкався покривного скла), а потім, спостерігаючи в окуляр, повільно піднімають тубус мікроскопу до отримання ясного зображення.
Приготування забарвлених препаратів
Приготувати мазки дріжджів різної форми і забарвити їх фарбою по Муромцеву. Промікроскопувати препарати і замалювати клітини різної форми, у тому числі і ті що брунькуються.
Необхідно уважно продивитись окремі клітини для виявлення диференційованого ядра, по-контрастності забарвлення виявити вакуолі і запасні речовини (жир, глікоген); замалювати клітини дріжджів різної форми і виявленні в них включення.
Забарвлення мазків по Муромцеву.
І-й розчин – фуксин основний 0,15 гр, спирт етиловий 96% 20 мл, карбонова кислота кристалічна 10 гр.
ІІ-й розчин – метиленова синька 25 гр, вода дистильована 200 мл:
Обидва розчини змішують і фільтрують крізь паперовий фільтр.
ФОРМА ЗВІТУ:
Замалювати мікроскопічну картину пліснявих грибів. Описати їх морфологічні ознаки.

___________________
____________________
____________________
____________________
____________________

_________________
__________________
__________________
__________________
__________________
Занотувати етапи приготування препарату «розчавлена» і «висяча» краплі
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________3. Замалювати мікроскопічну картинку препарату дріжджів
|
|
___________________ ____________________ ____________________ ____________________ ____________________ ____________________ |
|
_________________ __________________ __________________ __________________ __________________ __________________ |