
- •Общая физика Сборник контрольных заданий для студентов специалистов
- •Введение
- •Часть 1. Механика. Молекулярная и термодинамика
- •1.1. Основные формулы и законы механики
- •1.1.1. Кинематика
- •Динамика материальной точки и тела, движущегося поступательно
- •Механика твёрдого тела
- •1.1.4. Механические колебания
- •Волновые процессы
- •Контрольное задание №1 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •1.2. Основные формулы и законы молекулярной физики и термодинамики
- •1.2.1 Молекулярная физика
- •1.2.2. Физические основы термодинамики
- •Контрольное задание №2 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Часть 2. Электростатика и постоянный ток.
- •2.1.2. Постоянный ток
- •Контрольное задание №3 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •2.2. Основные формулы и законы электромагнетизма
- •2.2.1. Электромагнетизм
- •Контрольное задание №4 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Часть 3. Оптика. Атомная и ядерная физика
- •3.1. Основные формулы и законы оптики
- •3.1.1. Волновая оптика
- •3.1.2. Поляризация света
- •Контрольное задание №5 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •3.2. Основные формулы и законы теплового излучения, атомной и ядерной физики
- •3.2.1. Тепловое излучение
- •3.2.2. Атомная физика
- •3.2.3. Ядерная физика
- •Контрольное задание №6 Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •3. Некоторые внесистемные величины:
- •4. Основные физические постоянные:
- •7. Молярные массы (м 10-3кг/моль) газов:
- •8. Основные физические величины
- •Библиографический список
- •Общая физика Контрольные задания для студентов специалистов разных специальностей
- •660041, Г. Красноярск, пр. Свободный, 79
- •660041, Г. Красноярск, пр. Свободный, 82а
1.2. Основные формулы и законы молекулярной физики и термодинамики
1.2.1 Молекулярная физика
Количество
молей (вещества) газа:
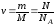 ,
,
где m – масса газа, M – молярная масса газа, N – количество молекул газа,
 –постоянная
Авогадро.
–постоянная
Авогадро.
Если система представляет собой смесь нескольких газов, то количество молей (вещества) этой системы:
 ,
,
где
 - количества молей,
- количества молей, -
количества молекул,
-
количества молекул, -
массы и
-
массы и -
молярные массы газов,
-
молярные массы газов, - число компонентов смеси.
- число компонентов смеси.
Уравнение Менделеева - Клапейрона (уравнение состояния идеального газа):
 ,
,
где
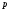 -
давление,
-
давление, -
объем,
-
объем, -
термодинамическая температура,
-
термодинамическая температура, -
масса и
-
масса и -
молярная масса газа,
-
молярная масса газа, -
универсальная газовая постоянная.
-
универсальная газовая постоянная.
Закон
Бойля-Мариотта (изотермический процесс:
 ,
, ,
, )
для двух состояний газа:
)
для двух состояний газа: .
.
Закон
Гей-Люссака (изобарный процесс:
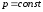 ,
, ,
, )
для двух состояний газа:
)
для двух состояний газа: .
.
Закон
Шарля (изохорный процесс:
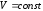 ,
, ,
, )
для двух состояний газа:
)
для двух состояний газа: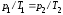 .
.
Объединенный
газовый закон ( ,
, )
для двух
)
для двух
состояний
газа:
 .
.
Закон Дальтона определяет давление смеси газов:
 ,
,
где
 - парциальные давления компонентов
смеси;
- парциальные давления компонентов
смеси; - число компонентов смеси.
- число компонентов смеси.
Молярная
масса смеси газов:
 ,
,
где
 - количества молей,
- количества молей, -
массы газов,
-
массы газов, - число компонентов смеси.
- число компонентов смеси.
Концентрация
молекул газа:
 ,
,
где
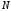 -
количество молекул,
-
количество молекул, -
объем,
-
объем, –
постоянная Авогадро,
–
постоянная Авогадро,
 -
молярная масса и
-
молярная масса и -
плотность газа.
-
плотность газа.
Средняя кинетическая энергия поступательного движения молекулы:
 ,
,
где
 -
постоянная Больцмана,
-
постоянная Больцмана, -
термодинамическая температура.
-
термодинамическая температура.
Основное уравнение молекулярно-кинетической теории идеальных газов:
 ,
,
где
 -
давление,
-
давление, -
концентрация молекул газа.
-
концентрация молекул газа.
Зависимость давления газа от концентрации молекул и термодинамической температуры:
 .
.
Из основного уравнения молекулярно-кинетической теории идеальных газов следует, что
 ,
,
где
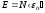 - суммарная кинетическая энергия
поступательного движения
- суммарная кинетическая энергия
поступательного движения молекул
газа.
молекул
газа.
Средняя
полная механическая энергия одной
молекулы:
 ,
,
где
 -
сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы:
-
сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы:
 .
.
Скорости молекул газа:
среднеквадратичная
- ;
;
среднеарифметическая
-
 ;
;
наиболее
вероятная - ,
,
где
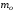 -
масса одной молекулы,
-
масса одной молекулы, -
молярная масса газа.
-
молярная масса газа.
Среднее число соударений, испытываемых одной молекулой газа в единицу времени:
 ,
,
где
 – эффективный диаметр молекулы;
– эффективный диаметр молекулы; – концентрация молекул;
– концентрация молекул;
 –среднеарифметическая
скорость молекул.
–среднеарифметическая
скорость молекул.
Средняя длина свободного пробега молекул газа:
 .
.
1.2.2. Физические основы термодинамики
Первое
начало термодинамики:
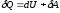 ,
,
где
 -
количество теплоты, переданное газу;
-
количество теплоты, переданное газу; -
изменение внутренней энергии газа и
-
изменение внутренней энергии газа и -
элементарная работа, совершаемая газом
против внешних сил.
-
элементарная работа, совершаемая газом
против внешних сил.
Элементарная работа, совершаемая газом против внешних сил:
 ,
,
где
 -
давление,
-
давление, -
изменение объема газа.
-
изменение объема газа.
Работа,
совершаемая газом при изменении его
объема от
 до
до :
:
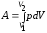 .
.
Работа, совершаемая газом в изобарном процессе:
 ,
,
где
 и
и - начальная и конечная термодинамические
температуры газа.
- начальная и конечная термодинамические
температуры газа.
Работа, совершаемая газом в изотермическом процессе:
 .
.
где
 и
и -
начальное и конечное давления газа.
-
начальное и конечное давления газа.
Связь
между молярной
 и
удельной
и
удельной теплоемкостями
вещества:
теплоемкостями
вещества:
 ,
где
,
где
 -
молярная масса вещества.
-
молярная масса вещества.
Молярные
теплоемкости газа при постоянном объеме
 и постоянном давлении
и постоянном давлении :
:
 и
и
 ,
,
где
 -
сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы.
-
сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы.
Уравнение
Майера:
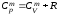 ,
,
где
 и
и
 - молярные теплоемкости газа при
постоянном давлении и постоянном объеме,
- молярные теплоемкости газа при
постоянном давлении и постоянном объеме, -
универсальная газовая постоянная.
-
универсальная газовая постоянная.
Внутренняя
энергия идеального газа:
 ,
,
где
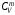 - молярная теплоемкость газа при
постоянном объеме.
- молярная теплоемкость газа при
постоянном объеме.
Уравнения Пуассона, связывающие термодинамические параметры идеального газа в адиабатном процессе:
 ;
;
 ;
; ,
,
где
 - показатель адиабаты.
- показатель адиабаты.
Работа, совершаемая газом в адиабатическом процессе:
 ,
,
где
 .
.
Коэффициент полезного действия (К.П.Д.) тепловой машины:
 ,
,
где
 -
полезная работа, совершаемая тепловой
машиной за один цикл;
-
полезная работа, совершаемая тепловой
машиной за один цикл;
 -
количество теплоты, полученное рабочим
телом от нагревателя, и
-
количество теплоты, полученное рабочим
телом от нагревателя, и
 -
количество теплоты, отданное рабочим
телом холодильнику за один цикл.
-
количество теплоты, отданное рабочим
телом холодильнику за один цикл.
Термический
К.П.Д. цикла Карно:
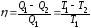 ,
,
где
 и
и - термодинамические температуры
нагревателя и холодильника.
- термодинамические температуры
нагревателя и холодильника.
Изменение энтропии системы:
 ,
,
где
 и
и – пределы интегрирования, соответствующие
начальному и конечному состояниям
системы. Так как процесс равновесный,
то интегрирование не зависит от формы
пути системы, совершающей переход из
одного состояния в другое.
– пределы интегрирования, соответствующие
начальному и конечному состояниям
системы. Так как процесс равновесный,
то интегрирование не зависит от формы
пути системы, совершающей переход из
одного состояния в другое.
Формула Больцмана:
 ,
,
где
 – энтропия системы;
– энтропия системы; – термодинамическая вероятность ее
состояния;
– термодинамическая вероятность ее
состояния; –постоянная Больцмана.
–постоянная Больцмана.
