
- •Тема 3. Техническое обслуживание кузовов автомобилей
- •1.1 Общее понятие коррозии
- •1.2.Классификация коррозионных процессов
- •1.3. Методы защиты от коррозии
- •1.3.1 Анодирование
- •1.3.2. Гальванические покрытия
- •1.3.3. Цинкование и кадмирование
- •1.3.4. Покрытия из олова и свинца
- •1.3.5. Никелевые покрытия
- •1.3.6. Хромирование
- •1.3.7. Металлизация напылением
- •1.3.8. Плакирование
- •1.4. Материалы для консервации автомобильного кузова
1.3.2. Гальванические покрытия
Одним из способов защиты от коррозии является нанесение поверхностных гальванических покрытий. Электроосаждение имеет ряд преимуществ перед другими методами защиты, т.к. оно позволяет:
• регулировать толщину слоя;
• экономно расходовать цветные металлы;
• наносить покрытия из металлов, имеющих высокую температуру плавления, как хром, никель, медь, серебро, платина.
Защитные электрохимические покрытия должны обладать:
• способностью изолировать изделие от агрессивной среды;
• собственной коррозионной стойкостью;
• заданными физико-механическими свойствами.
Вид покрытия, его толщина и назначение регулируются ГОСТ 9.303-84, и ГОСТ 9.306-85.
Защитные антикоррозионные покрытия могут быть анодными и катодными.
Металлические покрытия должны быть непроницаемыми для коррозионных агентов. Однако, если в металлическом покрытии есть дефекты в виде пор, царапин, вмятин, то характер коррозионного разрушения основного металла определяется электрохимическими характеристиками обоих металлов. По отношению к стали цинковое покрытие является анодным, а медное покрытие - катодным.
Поэтому первоначально начинает разрушаться цинк. При этом он защищает от разрушения железо или сталь тем дольше, чем больше толщина покрытия, т.е. является протектором (рис. 4, а). Медь является катодным покрытием по отношению к железу, т.к. имеет потенциал более положительный. Поэтому разрушению будет подвергаться железо и тем в большей степени, чем выше пористость медного покрытия (рис. 4, б).
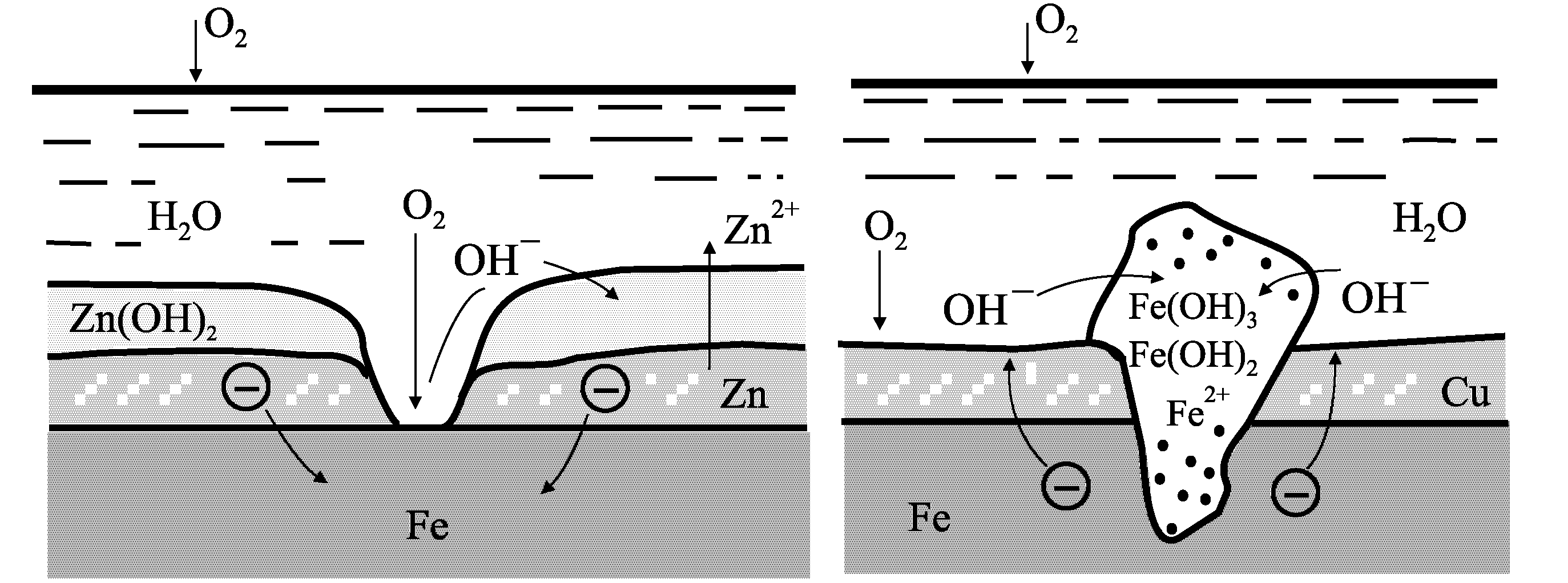
Рис.4. Схема, поясняющая действие анодных (а) и катодных (б) по отношению к основному металлу металлических покрытий
1.3.3. Цинкование и кадмирование
Цинковые покрытия применяются для защиты от коррозии деталей машин, трубопроводов, стальных листов. Цинк — дешевый и доступный металл. Он защищает основное изделие механическим и электрохимическим способом, так как при наличии пор или оголенных мест происходит разрушение цинка, а стальная основа не корродирует.
Покрытия из цинка занимают доминирующее положение. С помощью цинка защищают от коррозии примерно 20 % всех стальных деталей и около 50% производимого в мире цинка расходуется на гальванические покрытия.
Цинк нашел широкое применение в качестве защитного покрытия железных и стальных изделий. Цинк—легкоплавкий (Tпл= 419° С), мягкий и малопрочный металл. ПДК в воде — 0,01 мг/л. Стандартный электродный потенциал цинка Zn2++ 2е =Zn равен —0,76 В.
В 3 %-м растворе NaCl электродный потенциал цинка равен —0,83 В.

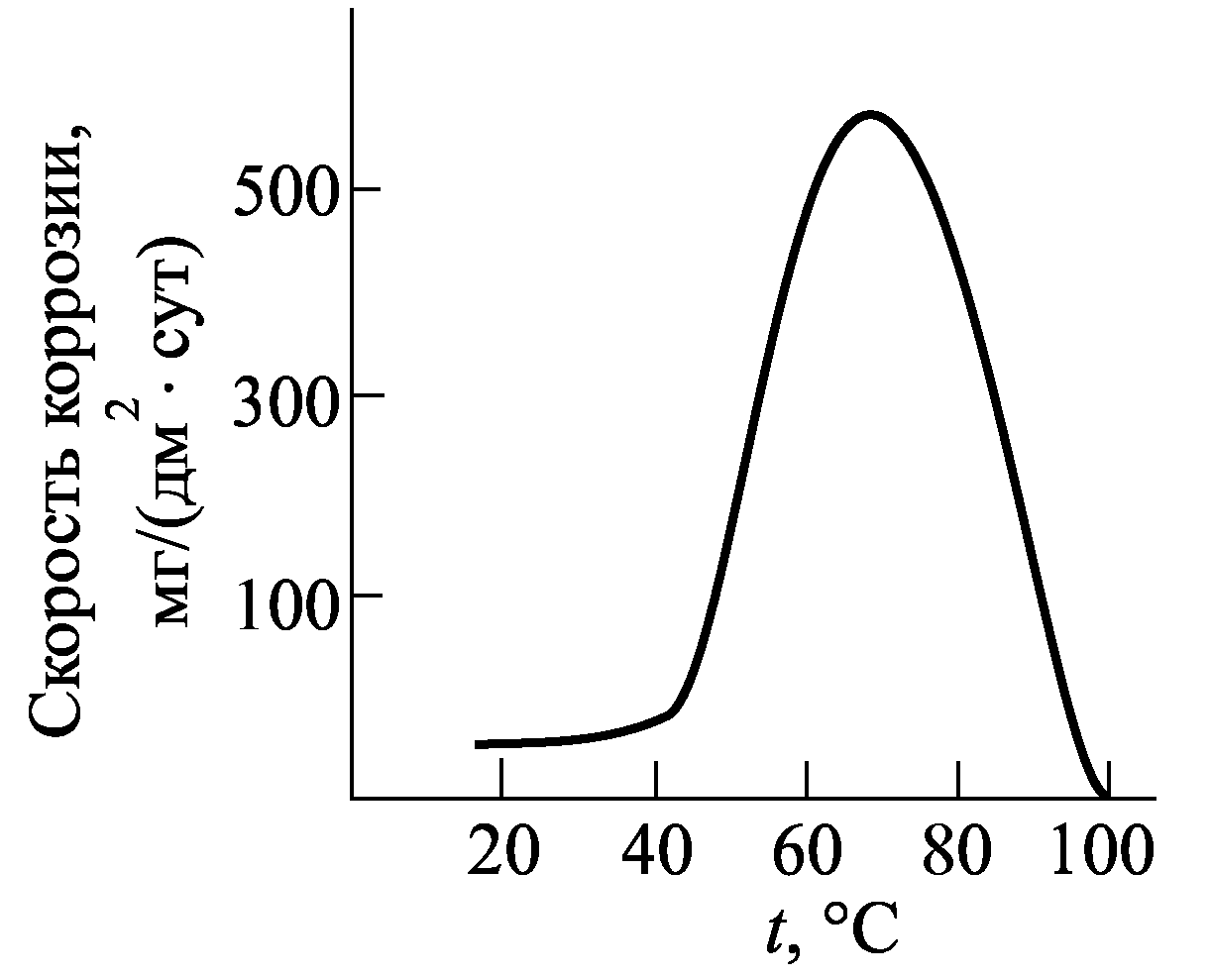
Рис.5 Влияние рН на кор- рис.6.
розию Zn. Влияние температуры
на скорость коррозии Zn в
дистилированной воде
Цинк обладает максимальной устойчивостью в интервале рН между 9 и 11 (рис. 5). Применение цинковых покрытий нерационально, если рН среды заметно меньше 7 или более 12 из-за усиления коррозии цинка.
В воде цинк устойчив до 55 ° С (рис. 6). Скорость коррозии резко повышается с увеличением температуры и достигает максимума при 70 °С, а затем снижается. Наблюдаемые закономерности связывают с тем, что при температурах до 50 °С и выше 95 °С, на цинке образуется плотная пленка с высокими защитными свойствами. В интервале температур (55-65) °С наблюдается образование рыхлых продуктов коррозии с низкими защитными свойствами. При 100° С продукты коррозии уплотняются, а также происходит уменьшение растворимости кислорода в коррозионной среде.
В чистой и морской атмосферах цинк стоек, так как покрывается слоем продуктов коррозии из гидроксидов и основных углекислых солей цинка. В загрязненных SO2, SO3, HC1 средах индустриальных районов устойчивость цинка и цинковых покрытий заметно снижается.
Цинк используется для защиты стали от атмосферной коррозии. Применяется для получения медных, никелевых, магниевых сплавов, в производстве аккумуляторов и как протектор при электрохимической защите железных сплавов.
Кадмий — серебристо-белый, мягкий металл. Плотность равна 8,65. Стандартный электродный потенциал кадмия Cd2++ 2е = Cd равен —0,40 В, а стационарный потенциал в 0,5н. растворе NaCl —0,52 В. ПДК в воде составляет 0,005 мг/л.
Кадмий — тягучий и ковкий металл, который легко прокатывается в листы и вытягивается в проволоку.
Способность к пассивации у кадмия невелика. Поэтому в контакте с железом, обладающим склонностью к пассивации, в большинстве случаев кадмий оказывается анодом. Кадмий употребляют в основном для нанесения анодных покрытий на сталь и на алюминиевые сплавы.
Кадмий сходен по коррозионному поведению с цинком. В нейтральных растворах кадмий корродирует с кислородной деполяри-зацией. В отличие от цинка скорость коррозии кадмия с увеличением рН понижается.
Вследствие менее отрицательного электродного потенциала кадмий имеет большую устойчивость в кислых и нейтральных растворах по сравнению с цинком. В щелочах он вполне устойчив. Кадмий устойчив к морской воде и морской атмосфере. Присутствие в газах SO2 и SO3 приводит к быстрому разрушению кадмия. Кадмий используется для получения сплавов с медью. Высокая токсичность кадмия ограничивает его применение в качестве защит-
ного покрытия.
Кадмий имеет более близкий потенциал к железу, чем цинк. Характер защиты кадмием зависит от коррозионной среды. Во влажной атмосфере и в присутствии хлор-ионов потенциал кадмия становится электроотрицательнее потенциала железа и кадмий электрохимически защищает металл от коррозии.
Для цинкования и кадмирования предложены электролиты, в которых металлы находятся в виде простых солей или в виде комплексных соединений. Наибольшее применение получили сульфатные электролиты. Их состав (г/л):

Катодная плотность тока для цинкования 100-400 А/м2, для кадмирования — 80-120 А/м2. Температура электролита для обоих процессов—15-30° С.
