
- •Міністерство освіти і науки України
- •Робоча програма
- •Приклади виконання задач
- •Швидкість реакції збільшилась у:
- •Варіант тесту до другого модуля
- •Приклади виконання задач
- •Варіант тесту до третього модуля
- •Приклади виконання задач
- •Список літератури
- •1 Основи загальної хімії / р.А. Яковлєва, л.С. Сухорукова, т.І. Курова та ін. – Харків: Консум, 2005. – 152 с.
Швидкість реакції збільшилась у:
![]() разів.
разів.
Відповідь. а.
Задача 9. У скільки разів збільшиться швидкість реакції з підвищенням температури на 400С, якщо температурний коефіцієнт реакції дорівнює 3?
Розв’язання. Для вирішення задачі користуємося правилом Вант-Гоффа:
![]() або
або
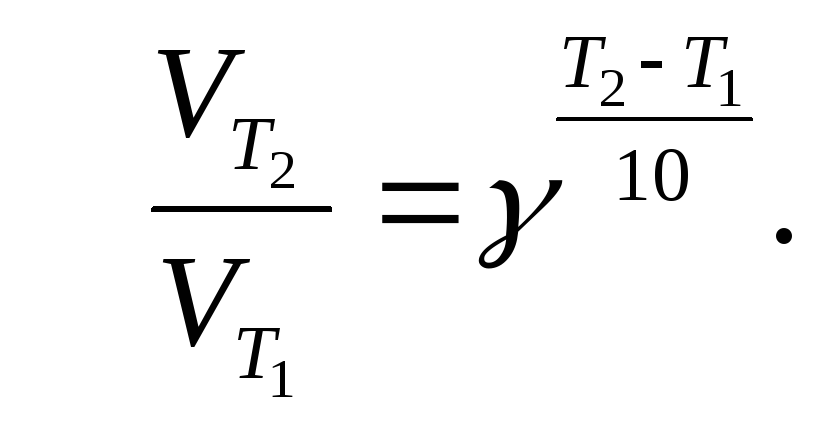
За умовою задачі температура
зросла на 400С,
тобто
![]() .
Отже
.
Отже
 .
.
Таким чином, швидкість реакції зросла у 81 раз.
Відповідь.б.
Задача
10. Визначити константу рівноваги
гомогенної системи![]() ,
якщо рівноважні концентрації реагуючих
речовин становлять:[N2]
= 0,4 моль/л; [Н2]
= 1 моль/л; [NH3]
= 1 моль/л.
,
якщо рівноважні концентрації реагуючих
речовин становлять:[N2]
= 0,4 моль/л; [Н2]
= 1 моль/л; [NH3]
= 1 моль/л.
Розв’язання. Константа рівноваги Кр – це відношення константи швидкості прямої реакції kпр до константи швидкості зворотної реакції kзв, або відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам:
 ;
;
![]() .
.
Відповідь.б.
Задача 11. Назвати оптимальні умови, необхідні для збільшення виходу продуктів реакції в системі:
![]() кДж/моль
кДж/моль
Розв’язання. Напрямок зміщення рівноваги визначається за принципом Ле-Шательє: якщо на систему, що перебуває в стані хімічної рівноваги, чиниться будь-який зовнішній вплив, то він сприяє перебігу тієї з двох протилежних реакцій, яка протидіє цьому впливу.
а) Оскільки реакція розкладу
![]() є ендотермічною(Н
0), то для зміщення стану рівноваги в
бік прямої реакції треба підвищити
температуру.
є ендотермічною(Н
0), то для зміщення стану рівноваги в
бік прямої реакції треба підвищити
температуру.
б) Оскільки в цій системі
розклад
![]() веде до збільшення тиску (з однієї
молекули газу утворюється дві газоподібні
молекули), то для зміщення стану рівноваги
в бік прямої реакції треба зменшити
тиск.
веде до збільшення тиску (з однієї
молекули газу утворюється дві газоподібні
молекули), то для зміщення стану рівноваги
в бік прямої реакції треба зменшити
тиск.
в) Зміщення стану рівноваги
в бік прямої реакції можна досягти як
збільшенням концентрації
![]() ,
так і зменшенням концентрацій
,
так і зменшенням концентрацій![]() або
або![]() .
.
Відповідь. а.
Задача 12. Визначити, яка з представлених електронних формул є формулою іона хлору.
а)
![]() ;
;
б)
![]() ;
;
в)
![]() ;
;
г)
![]() .
.
Розв’язання.
Хлор у таблиці хімічних елементів Д.І.
Менделєєва знаходиться в третьому
періоді, в сьомій групі, отже зовнішній
рівень атома хлору матиме вигляд
3s23p5.
Іон хлору Cl–
містить зайвий
електрон, отже зовнішній
рівень іона хлору матиме вигляд
3s23p6.
Електронна формула
іона хлору наступна:
![]() .
.
Відповідь. б.
Варіант тесту до другого модуля
1 1л розчину містить 98г речовини (1М розчин). Яку речовину було розчинено?
а) HCl; б) NaOH; в) H3PO4; г) Na3PO4.
2 Визначити
температуру замерзання двопроцентного
водного розчину глюкози
![]() ,
якщо кріоскопічна стала води складає
1,860С.
,
якщо кріоскопічна стала води складає
1,860С.
а) – 0,210С; б) – 0,510С; в) + 0,210С; г) + 0,510С .
3 250 мл розчину містять 2,3г розчиненої речовини, осмотичний тиск розчину при температурі 270С дорівнює 2,46 атм. Визначити молярну масу речовини.
а) 11г/моль; б) 6,6г/моль; в) 9,3г/моль; г) 92 г/моль.
4 Визначити ступінь дисоціації вугільної кислоти за першим ступенем у 0,1М розчині, якщо константа дисоціації для цього ступеня дорівнює 4,5·10 -7.
а) 0,47; б) 0,67; в) 0,5; г) 1.
5 Визначити концентрацію
іонів ![]() і
і ![]() 0,01М розчину гідроксиду натрію, якщо
ступінь дисоціації
0,01М розчину гідроксиду натрію, якщо
ступінь дисоціації ![]() .
.
а) 10-12, 12; б) 10-2; 2; в) 10-12, 2; г) 10-2, 12.
6 Обрати скорочене молекулярно-іонне рівняння, що відповідає реакції взаємодії між сульфатом натрію та хлоридом барію.

7 Яке значення рН має розчин солі Na2CO3?
а) рН=7; б) рН >7; в) рН < 7.
8 За допомогою яких реакцій можна одержати колоїдний розчин? Відповідь пояснити.
а) H2SO4 + BaCl2→
б) NaOH+H2SO4→
в) Na2CO3 + H2O→
г) K2SO3 + HCl→
9 Виходячи зі ступенів окиснення азоту і марганцю в сполуках: а)NH3, б)HNO3, в)MnO2, г)KmnO4, визначити, які з них можуть бути тільки окисниками.
а) а, б; б) б, г; в) в, г; г) а, г.
10 Методом електронного балансу визначити суму коефіцієнтів окисно-відновної реакції, що відбувається за схемою
![]()
а) 17; б) 10; в) 20; г) 16.
