
Лабораторний_практикум_з_дисципліни Хімія”_2014
.pdf
Скориставшись законом еквівалентів
mCaCO3 ME(CaCO3) ,
mCO2 ME(CO2)
обчислити молярну масу еквівалента карбонату кальцію, маючи на увазі те, що молярна маса еквівалента CO2 в реакції нейтралізації, що проходить з утво-
ренням середньої солі, дорівнює 1 моля.
2
Обчислити відносну похибку досліду за формулою
ПМЕтеор МекспЕ 100%,
МЕтеор
де П− відносна похибка, %;
МЕтеор− теоретичне значення молярної маси еквівалента;
МекспЕ − значення молярної маси еквівалента, обчислене на основі вимірю-
вань.
Питання для самоперевірки
1Що називається еквівалентом речовини?
2Які елементи мають змінні значення еквівалентів?
3Як обчислюється молярна маса еквівалента елемента та складних речовин? У яких одиницях вона виражається?
4Чи однакові молярні маси еквівалентів Феруму у сполуках FeCl2, FeCl3
та хрому у сполуках CrCl3,Cr2(SO4)3?
5Як формулюється закон еквівалентів? Навести його математичне вираження.
6На чому базується метод визначення молярної маси еквівалента карбонату кальцію?
7Обчислити молярну масу еквівалента Купруму, якщо відомо, що 3,18 г міді повністю сполучилися з 0,8 г кисню з утворенням CuO.
Лабораторна робота № 4
ВИЗНАЧЕННЯ ТЕПЛОВИХ ЕФЕКТІВ ХІМІЧНИХ РЕАКЦІЙ
4.1 Мета роботи ― визначення теплоти гідратації солі на основі калориметричних вимірювань.
20
4.2 Загальні вказівки
Під теплотою гідратації солі слід розуміти тепловий ефект реакції утворення кристалогідрату з безводної солі, віднесений до одного моля речовини.
Оскільки в хімії часто відбуваються процеси за сталого тиску й сталої температури, то слід мати на увазі, що в ізобарно-ізотермічних процесах тепловий ефект реакції визначається зміною ентальпії системи ΔH в ході реакції. Ця величина пов’язана з теплотою, що виділяється або поглинається в ході перетворення, співвідношенням
ΔH Qp.
Узв’язку з тим, що безпосередньо теплоту гідратації солі визначити важко, її знаходять на основі закону Гесса, визначаючи теплоти розчинення безводної солі та її кристалогідрату.
Згідно з законом Гесса тепловий ефект реакції не залежить від шляху її перебігу, а залежить лише від природи і фізичного стану вихідних речовин та продуктів реакції.
Таким чином, загальний тепловий ефект процесу розчинення кристалічної речовини дорівнює сумі теплових ефектів окремих стадій, що складають процес розчинення:
НΔH1 ΔH2
Уданій роботі процес розчинення сульфату міді у воді складається з двох
стадій.
Перша стадія процес гідратації солі, тобто утворення кристалогідрату сульфату міді:
CuSO4 К 5H2O Р CuSO4 5H2O К ; ΔHГІДР.
Друга стадія розчинення кристалогідрату у воді:
СuSO4 5H2O К aq CuSO4 Р ; ΔHР.К Г
Сумарний процес розчинення безводної солі:
CuSO4 К 5H2O Р aq CuSO4 Р ; ΔHР.Б.С.
має тепловий ефект згідно з законом Гесса:
НР.Б.С. НГІДР. НР.К Г.
Таке співвідношення дозволяє розрахувати теплоту гідратації сульфату
міді.
4.3 Порядок виконання роботи
Дослід потрібно проводити у спрощеному калориметрі (рис. 4). У внут-
21
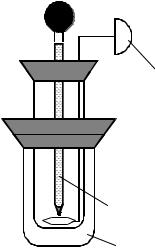
рішню посудину налити 25 мл дистильованої води, опустити в неї термометр і заміряти температуру з точністю до 0,10С – початкову температуру досліду tпоч. Висипати наважку безводної солі в посудину з водою. Обережно перемішуючи розчин мішалкою, слідкувати за зміною температури, відмітити найвищу температуру розчину tmax.
Дослід повторити, взявши наважку кристалогідрату. Під час проведення досліду слід звернути увагу на пониження температури після внесення кристалогідрату й відмітити найнижчу температуру розчину tmin
4.4 Оформлення результатів роботи
Записати в лабораторний журнал дані досліду для обох солей:
1)масу солі mсолі, г;
2)об’єм води Vводи, мл;
3)початкову температуру tпоч., 0С;
4)максимальну (мінімальну) температуру (tmax, tmin), 0C. Розрахувати зміну температури за формулою Δt tmax(min) tпоч..
Визначити кількість теплоти, що виділяється або поглинається під час розчинення безводної солі та кристалогідрату, у перерахуванні на 1 моль речовини за формулою
4 
 1 2
1 2 
5
3
Рисунок 4.1– Калориметрична установка
1– мішалка, 2 – калориметрична склянка, 3 – зовнішня посудина, 4 – кришка, 5 - термометр
Qp |
|
Δt c mp |
Mc |
, |
|
mc 103 |
|||||
|
|
|
|||
де Qp- кількість теплоти, кДж/моль;
Δtрізниця температур, 0С;
C - питома теплоємність розчину прийнята рівною теплоємності води, тобто 4,18 (Дж/г ∙ град);
mp- маса розчину, г;
mc- маса солі, г;
Mc- молярна маса солі, г/моль.
Записати теплові ефекти розчинення двох солей, виходячи з того, що
ΔH Qp .
22

Розрахувати теплоту гідратації ΔHгідр |
Нр.б.с. |
Нр.к г . |
||
Розрахувати відносну похибку досліду |
|
|
|
|
П |
Нгідртеор Нгідрексп |
100%, |
|
|
|
|
|||
|
Нтеор |
|
|
|
|
гідр |
|
|
|
де П – відносна похибка, %;
ΔHгідртеорCuSO4 −77,8 кДж/моль;
ΔHекспгідр CuSO4 − розраховане значення теплоти гідратації.
Питання для самоперевірки
1 Чим визначається тепловий ефект хімічної реакції? В яких одиниця він вимірюється?
2Що називається теплотою утворення речовин?
3Теплоти утворення яких речовин дорівнюють нулю?
4Який закон лежить в основі термохімічних розрахунків? Сформулюйте цей закон.
5Що називається теплотою гідратації солі? Як можна розрахувати теплоту гідратації солі?
Лабораторна робота № 5
ХІМІЧНА КІНЕТИКА
5.1 Мета роботи − вивчення впливу концентрації реагуючих речовин на швидкість хімічної реакції.
5.2 Загальні вказівки
Під час виконання даної роботи необхідно знати, що швидкість хімічної реакції визначається зміною концентрацій речовин, які вступають в реакцію або утворюються в результаті реакції за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці поверхні поділу фаз (для гетерогенних реакцій). Знайдена таким чином швидкість є середньою швидкістю реакції за певний проміжок часу:
ν ΔC C2 C1 , Δt t2 t1
де C1 і C2 - концентрації будь-якої з речовин у моменти часу t1, t2.
23
Необхідно пам’ятати, що швидкість хімічних реакцій залежить від природи взаємодіючих речовин і від умов проведення реакцій, насамперед від концентрації реагуючих речовин і температури.
Залежність швидкості хімічної реакції від концентрації реагуючих речо-
вин виражається законом дії мас: швидкість хімічної реакції за сталої температури пропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють значенням стехіометричних коефіцієнтів.
У загальному вигляді для реакції аА + вВ + ... = ... закон дії мас має ви-
гляд:
V kCaA CвB,
де CA і CB - концентрації взаємодіючих речовин;
k − константа швидкості, що залежить від природи взаємодіючих речовин, температури, каталізатора, але не залежить від концентрації речовин.
5.3 Порядок виконання роботи
Залежність швидкості реакції від концентрації реагуючих речовин вивчають на прикладі взаємодії тіосульфату натрію з сірчаною кислотою:
Na2S2O3 H2SO4 Na2SO4 SO2 S H2O
Ознакою реакції є помутніння розчину внаслідок виділення сірки. Необхідно приготувати розчини тіосульфату натрію різних концентрацій.
Для цього в чотири великі пробірки потрібно послідовно за допомогою бюретки налити: в першу пробірку − 5 мл розчину тіосульфату натрію і 15 мл дистильованої води, в другу – 10 мл тіосульфату натрію і 10 мл дистильованої води, в третю – 15 мл тіосульфату натрію і 5 мл води, в четверту – 20 мл тіосульфату натрію.
У чотири маленькі пробірки потрібно налити по 5 мл сірчаної кислоти й долити кислоту по черзі в кожну з чотирьох пробірок з розчином тіосульфату натрію. Для перемішування розчину тіосульфату з розчином сірчаної кислоти пробірку потрібно закрити великим пальцем і двічі перевернути. Визначити час, через який в результаті перемішування почнеться помутніння в кожній пробірці.
5.4 Оформлення результатів роботи
Результати спостережень занести до наступної таблиці.
Номер |
|
|
|
|
Об’єм |
|
Відносна |
|
Об’єм |
Час t |
Відносна |
||||||
пробір- |
|
|
|
|
V, мл |
|
концентрація |
V, мл |
появи |
швидкість |
|||||||
ки |
Na S |
2 |
O |
3 |
|
H |
2 |
O |
суміші |
Na S |
2 |
O |
3 |
H SO |
4 |
муті, с |
реакції 1/t |
|
2 |
|
|
|
|
|
2 |
|
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
24 |
|
|
|
|
|
|
|

Розрахувати швидкість реакції в умовних одиницях (1/t). Побудувати графік залежності швидкості реакції від концентрації тіосульфату натрію, відкладаючи на осі абсцис концентрацію, а на осі ординат – швидкість реакції в умовних одиницях. На основі графіка зробити висновок про залежність швидкості реакції від концентрації. Написати рівняння реакції і математичне вираження закону дії мас.
Питання для самоперевірки
1Чим визначається швидкість хімічної реакції?
2Від яких факторів залежить швидкість хімічних реакцій?
3Який закон виражає залежність швидкості реакції від концентрації реагуючих речовин? Сформулюйте цей закон.
4Що таке константа швидкості реакції?
Лабораторна робота № 6
ХІМІЧНА РІВНОВАГА
6.1Мета роботи ― вивчення впливу концентрації реагуючих речовин на стан хімічної рівноваги.
6.2Загальні вказівки
Слід мати на увазі, що хімічна рівновага можлива лише для оборотних реакцій. Стан системи, за якого швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою. Концентрації реагуючих речовин не змінюються тому мають назву рівноважних концентрацій. Вони позначаються формулами речовин у квадратних дужках.
Величина, яка дорівнює відношенню добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степенях, що дорівнюють стехіометричним коефіцієнтам, називається конс-
тантою рівноваги. Наприклад, для оборотної реакції: 4HCl O2 2H2O 2Cl2 константа рівноваги має вигляд:
K [H2O]2 [Cl2]2 .
[HCl]4 [O2]
Необхідно звернути увагу на те, що константа рівноваги не залежить від концентрації речовин у системі, а залежить лише від природи реагентів і температури.
Хімічна рівновага залишається незмінною доти, доки залишаються постійними параметри, за яких вона встановилася. У випадку зміни умов рівновага зміщується. Через деякий час у системі знову настає рівновага, яка характе-
25
ризується новими рівноважними концентраціями всіх речовин і новою рівністю швидкостей прямої і зворотної реакцій.
У загальному випадку напрям зміщення рівноваги визначається за прин-
ципом Ле Шательє: якщо на систему, що знаходиться в рівновазі, впливати ззовні, то рівновага зміщується в напрямку тієї реакції, яка протидіє зовнішньому впливу.
6.3 Порядок виконання роботи
У даній роботі розглядається оборотна реакція взаємодії хлориду заліза (Ш) з роданідом калію. Роданід заліза Fe(SCN)3 надає розчину червоного кольору. За зміною інтенсивності кольору можна судити про зміну концентрації Fe(SCN)3, тобто про зміщення рівноваги в той чи інший бік. Для цього необхідно в склянці змішати 10 мл розведеного розчину хлориду заліза FeCl3 і 10 мл розчину роданіду калію KSCN, розлити приготовлений розчин порівну в чотири пробірки, одну з яких залишити як контрольну. В першу пробірку додати 1 мл концентрованого розчину хлориду заліза, в другу – невелику кількість кристалічного роданіду калію, в третю – кристалічного хлориду калію. Розчини в усіх пробірках розмішати. Звернути увагу на інтенсивність зміни забарвлення розчину, порівнюючи його з розчином у контрольній пробірці.
6.4 Оформлення результатів роботи
Записати рівняння реакцій між FeCl3 і KSCN. Зробити висновок щодо напрямку зміщення рівноваги за додання: хлориду заліза, роданіду калію, хлориду калію.
Пояснити зміни кольору, керуючись принципом Ле Шательє, записати вирази закону дії мас для прямої і зворотної реакції, а також константи рівноваги для даної системи.
Питання для самоперевірки
1 Який стан називається станом хімічної рівноваги? Для яких реакцій він є характерним?
2Що таке константа рівноваги?
3Від яких факторів залежить константа рівноваги?
4Які фактори впливають на стан хімічної рівноваги?
5Який принцип визначає напрям зміщення рівноваги? Сформулюйте цей принцип.
26

Лабораторна робота № 7
ПРИГОТУВАННЯ РОЗЧИНУ ДАНОЇ КОНЦЕНТРАЦІЇ
ІВСТАНОВЛЕННЯ ЙОГО ТИТРУ
7.1Мета роботи ― набуття навичок приготування розчинів з більш концентрованого розчину.
7.2Загальні вказівки
Склад розчину виражається концентрацією або часткою розчиненої речовини.
Молярна концентрація (См) визначається відношенням кількості речовини до об’єму розчину, моль/л:
Cм νреч . Vр ну
Молярна концентрація еквівалента, або нормальність (Сн) визначається відношенням кількості речовини еквівалента до об’єму розчину, моль/л:
Cн νреч.екв. .
Vр ну
Моляльна концентрація (Сm) визначається відношенням кількості речовини до маси розчинника, моль/кг:
Cm νреч. . mр ка
Масова концентрація (або титр) T визначається відношенням маси розчиненої речовини до об’єму розчину, г/мл:
T mреч .
Vр ну
Розрізняють такі частки розчиненої речовини: молярну, масову та об’ємну. Найчастіше вживаються масова та молярна частки.
Масова частка або процентна концентрація С%, визначається відно-
шенням маси розчиненої речовини до маси всього розчину:
ω |
mреч. |
або С% |
mреч. |
100%. |
|
mр ну |
mр ну |
||||
|
|
|
|||
|
|
27 |
|
|

Молярна частка розчиненої речовини, або мольна частка N визначається відношенням числа молів розчиненої речовини до сумарного числа молів усіх
компонентів розчину: N |
i |
|
|
νi |
|
, або в загальному вигляді: N |
i |
|
νi |
. |
|
|
|
|
|||||||||
|
|
ν |
ν |
2 |
|
|
ν |
j |
|||
|
|
1 |
|
|
|
|
|
||||
7.3 Порядок виконання роботи
Дослід 1 Приготування 0,1 н розчину HCl з більш концентрованого розчину
Спочатку треба розрахувати об’єм (мл) вихідного розчину кислоти, потрібний для приготування 100 мл 0,1 н розчину:
1 л 0,1 н розчину HCl містить 0,1 моль еквівалента HCl. Молярна маса еквівалента HCl дорівнює молярній масі, тому в 100 мл 0,1 н розчину HCl міститься 0,365 г HCl.
Далі необхідно розрахувати, об’єм концентрованої соляної кислоти, в якому міститься розрахована маса HCl. Із таблиці густини розчинів сильних кислот і лугів видно, що соляна кислота з густиною 1,06 г/см3 має концентрацію 12,2%. Оскільки,
С% mHCl 100%,
mр ну
то
mр ну mHCl 100%. C%
Для перерахування знайденої маси кислоти на її об’єм потрібно скористатися формулою
V m .
ρ
За допомогою мірного циліндра відміряти розрахований об’єм соляної кислоти, вилити кислоту в мірну колбу на 100 мл і довести дистильованою водою до позначки. Одержаний розчин ретельно перемішати.
Дослід 2 Встановлення концентрації (титру) приготовленого розчину
Для перевірки концентрації приготовленого розчину соляної кислоти користуються методом титрування, який полягає в тому, що до певного, точно виміряного об’єму кислоти поступово додають з бюретки розчин лугу відомої концентрації до досягнення еквівалентної кількості, яка визначається за допомогою індикатора.
Титрування потрібно провести наступним чином. Бюретку наповнити 0,1 н розчином NaOH. Потім, підставивши під неї колбу або склянку і відкривши
28
затискач, заповнити відтягнуту трубку бюретки так, щоб у ній не залишилось бульбашок повітря. Встановити рівень розчину на нульовій позначці.
У чисту конічну колбу перенести піпеткою 10 мл приготовленого розчину кислоти й додати 2 – 3 краплі індикатора – фенолфталеїну (в кислому й нейтральному середовищах фенолфталеїн стає безбарвним, у лужному середовищі він має малиновий колір). Колбу з кислотою потрібно поставити на аркуш білого паперу для отримання можливості спостерігати за зміною кольору індикатора. Луг додавати краплями з бюретки в колбу (вміст колби перемішувати) доти, доки від однієї краплі лугу розчин в колбі набуде блідо-рожевого кольору. Повторювати дослід декілька разів, доки останні три відліки не будуть відрізнятися один від одного не більше ніж на 0,2 – 0,3 мл.
7.4 Оформлення результатів роботи
Дослід 1 Занести в графу “розрахунки” дані, необхідні для приготування 100 мл 0,1 н розчину HCl.
Дослід 2 Результати титрування оформити в вигляді таблиці:
|
Номер проби |
Об’єм кислоти, мл |
|
|
|
Об’єм лугу, мл |
Нормальність |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лугу, моль/л |
|
Розрахувати нормальність кислоти, користуючись формулою |
||||||||||||||
|
|
|
|
|
Сн(к - ти) |
|
|
V(лугу) |
. |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Сн(лугу) V(к-ти) |
|
|||||||||
|
Розрахувати відносну похибку досліду за формулою |
|
|||||||||||||
|
|
|
|
|
|
Снтеор Сексп |
|
|
|
|
|||||
|
|
|
|
П |
|
|
|
н |
100% , |
|
|||||
|
|
|
|
Снтеор |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
де |
П− відносна похибка, %; |
|
|
|
|
|
|
|
|||||||
|
Снтеор− теоретичне значення нормальності розчину (в даному разі – 0,1); |
||||||||||||||
|
експ |
− обчислене значення нормальності розчину. |
|
||||||||||||
|
Сн |
|
|
||||||||||||
|
|
Розрахувати титр приготовленого розчину кислоти за формулою: |
|||||||||||||
|
|
|
|
|
|
Т |
Сн ME |
, |
|
||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
||
де |
T − титр приготовленого розчину кислоти, г/мл; |
|
|||||||||||||
|
Cн − нормальність приготовленого розчину кислоти, моль/л; |
||||||||||||||
|
ME − молярна маса еквівалента кислоти, г/моль. |
|
|||||||||||||
|
|
|
|
29 |
|
|
|
|
|
|
|
||||
