Термодинамические потенциалы или функции состояния
Все законы в термодинамике основываются
на использовании функций состояния,
называемых термодинамическими
потенциалами. Каждому набору независимых
параметров соответствует свой
термодинамический потенциал. Изменения
потенциалов, происходящие в ходе
каких-либо процессов, определяют либо
совершаемую системой работу, либо
получаемую системой теплоту.
При рассмотрении
термодинамических потенциалов мы будем
пользоваться соотношением
 .
.
Внутренняя
энергия.С одним из термодинамических
потенциалов мы уже хорошо знакомы. Это
-внутренняя энергиясистемы.
Выражение первого начала термодинамики
для обратимого процесса можно представить
в виде
 .
(9)
.
(9)
Как видно
отсюда, в качестве естественных переменных
для потенциала
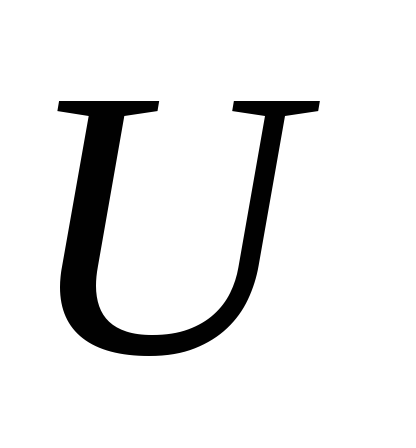 выступают переменные
выступают переменные
 и
и
 .
Тогда
.
Тогда
 .
.
Свободная
энергия.Согласно (9) работа, производимая
телом при обратимом изотермическом
процессе, может быть представлена в
виде:
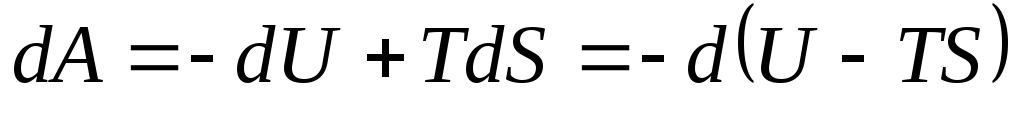 .
.
Функцию
состояния
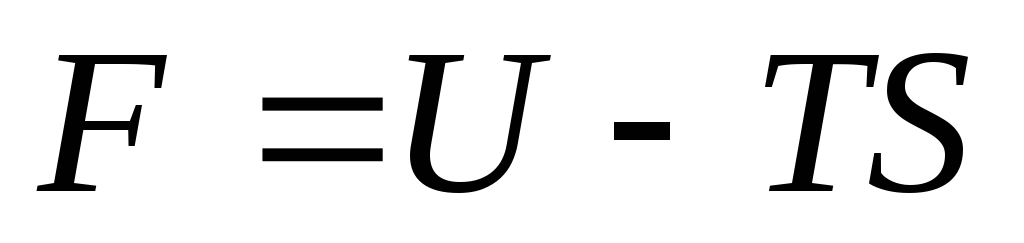 (10)
(10)
называют
свободной энергиейтела. Возьмём
дифференциал от функции (10). Приняв во
внимание (9), получим
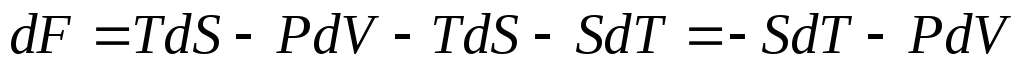 .
.
Таким образом,
естественными переменными для свободной
энергии являются
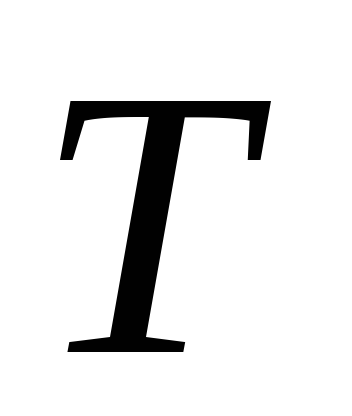 и
и
 .
Тогда
.
Тогда
 .
.
Энтальпия.Если процесс происходит
при постоянном давлении, то количество
получаемой телом теплоты можно представить
следующим образом
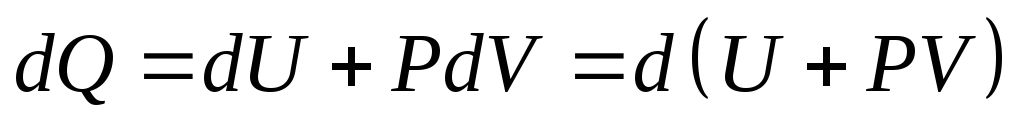
Функцию
состояния
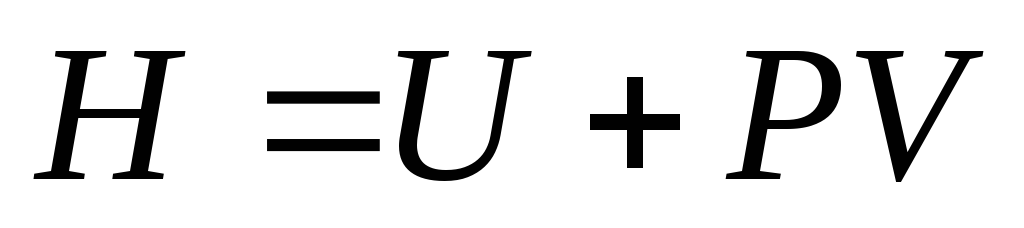 (11)
(11)
называют энтальпией
или тепловой функцией. Дифференцируя
выражение (11) с учётом (9), получим
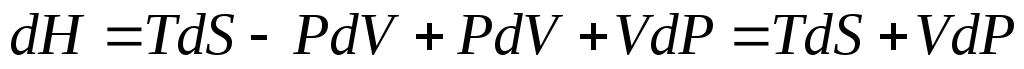 .
.
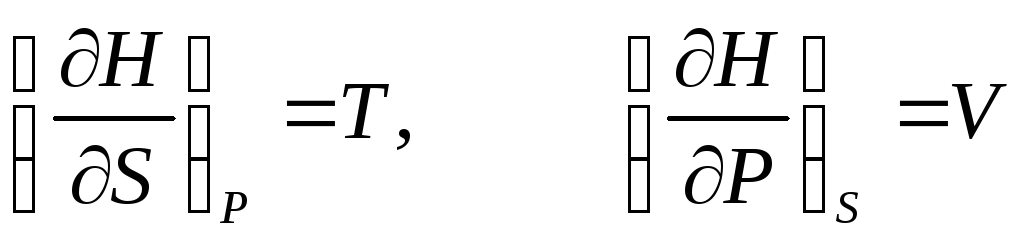
Отсюда
заключаем, что энтальпия есть
термодинамический потенциал в переменных
 и
и
 .
Его частные произведения равны
.
Его частные произведения равны
 .
.
Термодинамический
потенциал Гиббса.
Так называется функция
состояния, определяемая следующим
образом:
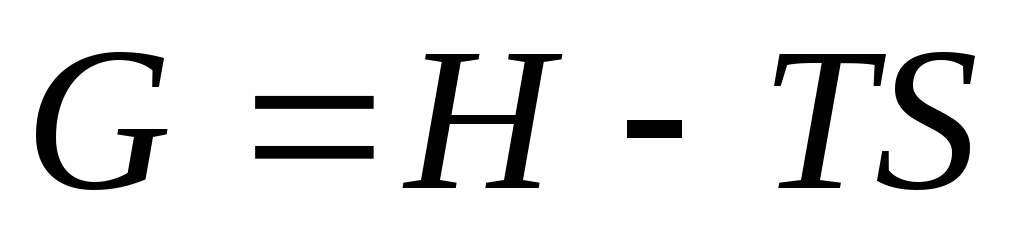 .
(12)
.
(12)
Её полный
дифференциал равен
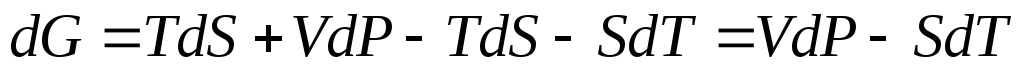 .
.
Следовательно,
естественными переменными для функции
 являются
являются
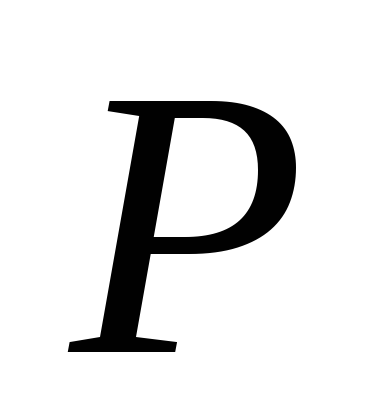 и
и
 .
Частные производные этой функции равны
.
Частные производные этой функции равны
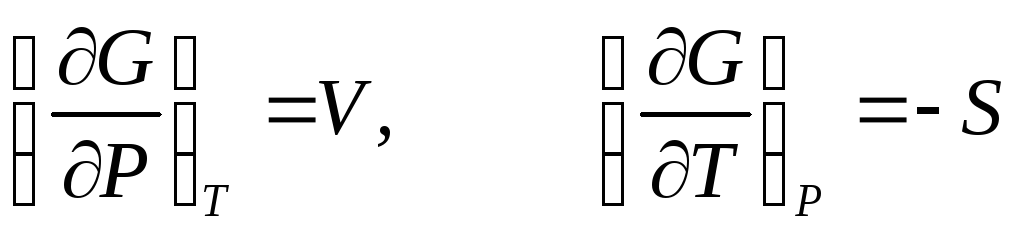 .
.

