
Praktikum_Solodovnik
.pdf
фільтрування, піпетка місткістю 10,0 см3, зразок повітряно-сухого ґрунту, титрований розчин NaOH - 0,1 моль/дм3, розчин СН3СООNa – 1,0 моль/дм3, розчин фенолфталеїну.
Виконання роботи
1. Грунт для аналізу попередньо висушити на повітрі та просіяти крізь сито діаметром 1 мм. На технохімічних терезах взяти наважку ґрунту 5 г (з точністю до 0,01 г).
2.Перенести наважку ґрунту в колбу, додати 50 см3 розчину СН3СООNa – 1,0 моль/дм3, закрити пробкою і збовтувати впродовж 1 години.
3.Після збовтування суміш профільтрувати крізь фільтр в суху колбу. При фільтруванні треба стежити, щоб більшість ґрунту була перенесена на фільтр.
4.Після фільтрування відібрати піпеткою 10 см3 прозорого фільтрату в конічну колбу, додати 5-6 крапель фенолфталеїну і титрувати 0,1 моль/дм3 розчином NaOH до блідо-рожевого кольору, який не зникає впродовж 0,5-1 хв.
5.Обчислити гідролітичну кислотність ґрунту – Нгід, яку виразити кількістю мілімоль еквівалентів гідроген-іонів на 100 г ґрунту, використовуючи формулу:
H |
гід = |
c ( f |
екв. |
(NaOH)NaOH) ×V (NaOH) ×100 ×1,75 |
, |
|
|
10 |
|||
|
|
|
|
|
де с(fекв.(NaOH)NaOH) – молярна концентрація речовини еквівалента NaOH, моль/дм3; V(NaOH) – об’єм розчину NaOH, який використаний на титрування, см3; 100 – коефіцієнт для перерахунку результату на грунт масою 100 г (для титрування взяли 10 см3 фільтрату, а цей об’єм відповідає масі грунту 1 г); 1,75
– коефіцієнт перерахунку на повну величину гідролітичної кислотності грунту (коефіцієнт виведений експериментально); 10 – поправка для переводу в мілімоль еквіваленти.
6. Обчислити норми внесення вапняку на гектар ґрунту за формулою:
m (CaCO3) = c ( fекв . (NaOH)NaOH) ×V (NaOH) ×100 × 50 ×1,75 ×3×106 ×10 , 10 ×1×109
де с(fекв.(NaOH)NaOH) – молярна концентрація речовини еквівалента NaOH, моль/дм3; V(NaOH) – об’єм розчину NaOH, який використаний на титрування, см3; 100 – коефіцієнт для перерахунку результату на грунт масою 100 г; 50 – маса речовини еквівалента CaCO3 (fекв.(CaCO3) = ½), мг; 1,75 – коефіцієнт перерахунку на повну величину гідролітичної кислотності грунту; 3·106 – коефіцієнт для переходу від 1 кг грунту до маси орного шару завглибшки 20 см в кілограмах; 10 (в чисельнику) поправка для переходу від 100 г грунту до 1 кг; 10 (в знаменнику) поправка для переходу від см3 0,1М розчину NaOH до мілімоль еквівалентів; 1·109 – коефіцієнт для переведення маси вапняку у міліграмах в тони.
Якщо провести можливі обчислення, то формула спрощується:
m (CaCO3) = c ( fекв . (NaOH)NaOH) ×V (NaOH) × 26,2
101
4.4. ЛАБОРАТОРНА РОБОТА № 19
Методи окислення – відновлення (редоксиметрії). Йодометрія
Теоретична частина
Методи редоксометрії ґрунтуються на хімічних реакціях, які відбуваються зі зміною ступеня окислення реагуючих речовин. Назва методів, в яких використовується принцип редоксометрії, походить зазвичай від назви робочих титрованих розчинів.
Йодометрія. В основі даного метода лежать окисно-відновні процеси, пов’язані з відновленням I2 до 2І–- іонів або окислення їх до I2. Вільний йод є слабким окисником, а І–-іони – сильним відновником. Індикатор – водний розчин крохмалю (0,1-0,2%). Основна реакція при йодометричних визначеннях:
І2+2е-↔2І–
В йодометрії при визначенні відновників титрування проводять робочим розчином вільного йоду, а виходячи з логічних міркувань при визначенні окисників треба титрувати робочим розчином калій йодиду, але таке титрування неможливо проводити, тому що не можна буде зафіксувати точку еквівалентності. Вільний йод утворюється при додаванні самих перших порцій розчину KІ. Індикатор (крохмаль) при цьому зразу ж синіє, ще задовго до точки еквівалентності. На І–-іон індикатора не існує. Тому в таких випадках використовують непрямий метод титрування замісника. Суть цього методу в тому, що до розчину визначуваної речовини додають надлишок KІ (допоміжний нетитрований розчин). Наприклад:
K2Cr2O7 +6KІ+7H2SO4 = 4K2SO4+Cr2(SO4)3+3І2+7H2O
Внаслідок реакції утворюється вільний йод, причому його кількість є чітко еквівалентною кількості окисника. Йод, що виділився, титрують розчином динатрій триоксотіосульфат-вода (1/5) – Na2S2O3:
І2+2Na2S2O3=2NaІ+Na2S4O6
Кількість Na2S2O3, що пішла на титрування, еквівалентна кількості йоду, яка виділилась за попередньою реакцією. Таким чином, в якості робочого титрованого розчину при йодометричному визначенні окисників застосовується розчин Na2S2O3. І хоча динатрій триоксотіосульфат-вода (1/5) в даному випадку безпосередньо не взаємодіє з окисником, їх кількості еквівалентні. Знаючи кількість одного, можна завжди розрахувати кількість іншого.
Практична частина Завдання 1. Приготувати та провести стандартизацію робочих розчинів
йодометрії
Обладнання та реактиви Терези технохімічні, бюкс, лійка, мірна колба з притертою пробкою
(місткістю 50 см3), штатив для титрування, колби для титрування, бюретка, градуйовані піпетки, мірний циліндр, кристалічний Na2S2O3·5H2O, розчин дикалій
102
дихромат (VI) – K2Cr2O7 з молярною концентрацією речовини еквівалента 0,05 моль/дм3, 10% розчин КІ, 20% розчин H2SО4, 0,2% розчин крохмалю.
Виконання роботи
1. Приготування розчину Na2S2O3·5H2O з молярною концентрацією речовини еквівалента 0,05 моль/дм3
а) Розрахувати теоретичну наважку кристалогідрату Na2S2O3·5H2O для приготування 50 см3 розчину з молярною концентрацією речовини еквівалента 0,05 моль/дм3 за формулою:
m (Na2S2O3 |
×5H |
2O) = |
c (Na |
2S2O3 ×5H2O) × M E (Na2S2O3 ×5H2O) ×V (Na2S2O3 ×5H2O) |
|
1000 |
|||
|
|
|
|
Для розрахунку попередньо записати рівняння реакції взаємодії Na2S2O3·5H2O з йодом, урівняти іонно-електронним методом та визначити для них фактори еквівалентності речовини та молярні маси еквівалентів.
б) Взяття наважки кристалогідрату Na2S2O3·5H2O. Кристалогідрат динатрій триоксотіосульфат-вода (1/5) не відповідає вимогам, що ставляться до вихідних речовин, тобто дуже легко вивітрюється на повітрі, в водних розчинах може розкладатися вугільною кислотою та киснем повітря а також розкладається під дією мікроорганізмів та світла. В зв’язку з цим, приготувати титрований розчин його за точною наважкою не можна і тому готують розчин приблизної концентрації, витримують його 8-10 днів а потім встановлюють його титр.
Взяти розраховану наважку Na2S2O3·5H2O на технічних терезах.
маса бюкса з речовиною |
– |
... |
г |
маса порожнього бюкса |
– |
... |
г |
маса речовини m(Na2S2O3·5H2O) |
– |
... г. |
|
в) Розчинення наважки Na2S2O3 ·5H2O у воді. Для розчинення необхідно кількісно перенести наважку в мірну колбу (50 см3) і розчинити в невеликому об’ємі дистильованої води, після чого долити дистильованою водою до мітки та залишити розчин до наступного заняття.
2. Стандартизація розчину Na2S2O3·5H2O за розчином дикалій дихромату (VI), який одержано з „фіксаналу”
а) Перед проведенням стандартизації розчину Na2S2O3·5H2O записати рівняння реакції взаємодії дикалій дихромату(VI) з калій йодидом в кислому середовищі (H2SO4), урівняти іонно-електронним методом та визначити для K2Cr2O7 фактор еквівалентності речовини та молярну масу речовини еквівалента.
б) Титрування. Перед початком титрування сполоснути бюретку 2-3 cм3 розчину Na2S2O3·5H2O, потім заповнити її цим розчином та встановити рівень в бюретці на нуль. Далі взяти три конічні колби і в кожну з них піпеткою відібрати 2,00 см3 K2Cr2O7, мірним циліндром 10,00 cм3 20 % розчину H2SO4 та 5,00 см3 10 % розчину КI. Колби закрити і на 5-7 хвилин залишити в темному місці.
в) При титруванні розчин Na2S2O3·5H2O треба додавати по краплям весь час перемішуючи круговими рухами вміст колби. Спочатку без індикатора. Коли забарвлення з темно-коричневого перетвориться на світло-жовте, додати
103

приблизно 3-5 крапель розчину крохмалю і продовжити титрувати до переходу темно-синього забарвлення в світло-зелене. Зробити відлік об’єму розчину Na2S2O3·5H2O, який пішов на титрування з точністю до сотих та записати в журнал. Титрування повторити три рази а для розрахунку взяти середній об’єм Vсер. (різниці між об’ємами не повинна перевищувати 0,04 см3).
Форма запису: |
|
− ...см3 |
|
V(Na2S2O3) |
І титрування |
||
|
|
ІІ титрування |
− ...см3 |
|
|
ІІІ титрування − ...см3 |
|
|
|
|
|
V(Na2S2O3)середнє значення |
– ... см3 |
||
в) Розрахувати характеристики робочого розчину динатрій триоксотіосульфат-
вода (1/5): (с (fекв(Na2S2O3·5H2O), Т(Na2S2O3·5H2O).
Завдання 2. Визначити масову частку СuSO4·5H2O в мідному купоросі марки “ч” методом йодометрії
Обладнання та реактиви Терези технохімічні та аналітичні, бюкс, лійка, мірна колба з притертою
пробкою (місткістю 50 см3), штатив для титрування, колби для титрування, бюретка, градуйовані піпетки, мірний циліндр, кристалічний зразок мідного купаросу, 10% розчин КІ, 20% розчин H2SО4, 0,2% розчин крохмалю.
Виконання роботи
1. Приготування розчину CuSO4·5H2O з молярною концентрацією речовини еквівалента 0,05 моль/дм3
а) Розрахувати теоретичну наважку CuSO4·5H2O для приготування 50 см3 розчину з молярною концентрацією речовини еквівалента 0,05 моль/дм3 за формулою:
m (CuSO4 ×5H2O) = c ( fекв (CuSO4 ×5H2O) × M E (CuSO4 × 5H2O) ×V (CuSO4 × 5H2O) 1000
Для розрахунку попередньо записати рівняння реакції взаємодії CuSO4·5H2O з калій йодидом, урівняти іонно-електронним методом та визначити для них фактори еквівалентності речовини та молярні маси еквівалентів.
б) Взяти розраховану наважку мідного купоросу на аналітичних терезах.
Форма запису: |
|
|
маса бюкса з речовиною |
– ... |
г; |
маса порожнього бюкса |
– ... |
г; |
маса речовини m(CuSO4·5H2O) – ... |
г. |
|
в) Для приготування розчину в мірну колбу на 50 см3 перенести наважку, розчинити в невеликій кількості дистильованої води, довести до мітки дистильованою водою, ретельно перемішати.
104
2. Визначення масової частки CuSO4·5H2O в зразку мідного купоросу марки «ч»
а) Титрування. Перед початком титрування сполоснути бюретку 2-3 cм3 стандартного розчину Na2S2O3·5H2O (який було приготовлено та стандартизовано в попередній роботі), потім заповнити бюретку цим розчином та встановити рівень на нуль. Далі взяти три конічні колби і в кожну з них піпеткою відібрати Vа = 2,00 см3 CuSO4·5H2O, мірним циліндром 10,00 cм3 20 % розчину H2SO4 та 5,00 см3 10 % розчину КІ. Колби закрити і на 5-7 хвилин залишити в темному місці.
б) При титруванні розчин Na2S2O3·5H2O треба додавати по краплям весь час перемішуючи круговими рухами вміст колби. Спочатку без індикатора. Коли забарвлення з темно-коричневого перетвориться на світло-жовте, додати приблизно 3-5 крапель розчину крохмалю і продовжити титрувати до переходу темно-синього забарвлення в світло-зелене. Зробити відлік об’єму розчину Na2S2O3·5H2O, який пішов на титрування з точністю до сотих та записати в журнал. Титрування повторити три рази а для розрахунку взяти середній об’єм Vсер. (різниця між об’ємами не повинна перевищувати 0,04 см3).
Форма запису: |
|
|
− ...см3 |
|
|
|
||
V(Na2S2O3) |
І титрування |
|
|
|
|
|||
|
|
ІІ титрування |
|
− ...см3 |
|
|
|
|
|
|
ІІІ титрування |
− ...см3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
V(Na2S2O3)середнє значення |
|
– ...см3 |
|
|
|
|||
в) За даними титрування розрахувати практичну молярну концентрацію |
||||||||
речовини еквівалента СuSO4·5H2O: |
|
|
|
|
|
|
||
c ( fекв (CuSO |
4 × 5H2O)практ. = |
c ( fекв (Na2S2O3 ×5H2O) ×Vсер |
(Na2S2O3 |
× 5H2O) |
, |
|||
|
Va (CuSO4 × 5H |
2O) |
|
|||||
|
|
|
|
|
|
|||
та масову частку СuSO4 ·5H2O в мідному купоросі:
|
|
|
w%(CuSO4 |
× 5H |
2O) = |
m (CuSO4 ×5H |
2O) |
×100% , |
|
|
|
|
mнаважки |
|
|
||||
де |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m (CuSO4 |
×5H |
2O) = |
с ( fекв (CuSO4 ×5H2O)практ. × M E (CuSO |
4 × 5H2O) ×V (CuSO4 ×5H2O) |
|||||
|
|
|
1000 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
г) У висновку порівняти одержаний результат з даними Держстандарту відповідно до якого вміст основної речовини СuSO4 ·5H2O в мідному купоросі марки «ч» не повинна бути меншою за 99%.
105

4.5. ЛАБОРАТОРНА РОБОТА № 20
Методи окислення – відновлення (редоксиметрії). Перманганатометрія
Теоретична частина
Перманганатометрія є одним з найпоширених методів редоксиметрії. В якості робочого титрованого розчину використовується KMnO4, який в кислих розчинах є дуже сильним окисником здатним відновлюватися до Mn2+-іона. Основною умовою перманганатометричних визначень є висока кислотність середовища, для створення якого використовують сульфатну кислоту. Якщо середовище недостатньо кисле в розчині можуть відбуватися інші реакції, які призводять до значних помилок результатів аналізу. Стандартизацію робочого розчину KMnO4 проводять за оксалатною кислотою, яку готують з фіксаналу або за точною наважкою. Титрування відбувається за реакцією:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
Титрування проводиться без індикатора, індикатором є сам калій манганат(VII), забарвлений в червоно-фіолетовий колір. Закінчення реакції фіксують по зміні забарвлення від додавання однієї надлишкової краплі KMnO4.
Практична частина Завдання 1. Приготувати та встановити молярну концентрацію речовини
еквівалента та титр робочого розчину калій тетраоксоманганату(VII) – KMnO4
Обладнання та реактиви
Терези технохімічні, бюкс, лійка, мірна колба з притертою пробкою (місткістю 250 см3), штатив для титрування, колби для титрування, бюретка зі скляним краном, електрична плитка, градуйована піпетка (місткістю 20 cм3), мірний циліндр, кристалічний KMnO4, фіксанал оксалатної кислоти для приготування розчину з молярною концентрацією речовини еквівалента 0,05 моль/дм3, розчин H2SО4, з молярною концентрацією речовини еквівалента 2 моль/дм3.
Виконання роботи
1. Приготування розчину KMnO4 з молярною концентрацією речовини еквівалента 0,05 моль/дм3
а) Розрахувати теоретичну наважку кристалогідрату KMnO4 для приготування 250 см3 розчину з молярною концентрацією речовини еквівалента 0,05 моль/дм3 за формулою:
m (KMnO4) = c ( fекв (KMnO4)) × M E (KMnO4) ×V (KMnO4) 1000
Для розрахунку попередньо записати рівняння реакції взаємодії KMnO4 з оксалатною кислотою в кислому середовищі (H2SО4), урівняти іонно-електронним методом та визначити для них фактори еквівалентності речовини та молярні маси еквівалентів.
106
б) Взяття наважки. Калій тетраоксоманганат(VII) – KMnO4 не належить до вихідних речовин, тому що завжди містить домішки двооксиду марганцю MnO2, від якого дуже важко позбутись. Окрім цього, концентрація KMnO4 з часом змінюється під дією світла і внаслідок відновлення його невеликою кількістю органічних речовин, які попадають в розчин з пилом. Тому розраховану кількість KMnO4 зважують на технічних терезах і готують розчин приблизної концентрації. Точну концентрацію встановлюють через 10-12 днів.
Взяти розраховану наважку KMnO4 на технічних терезах.
Форма запису: |
|
|
|
маса бюкса з речовиною |
– |
... |
г; |
маса порожнього бюкса |
– |
... |
г; |
маса речовини m(KMnO4) – |
... |
г. |
|
в) Розчинення наважки KMnO4 у воді. Для розчинення необхідно кількісно перенести наважку в мірну колбу (250 см3) і розчинити в невеликому об’ємі дистильованої води, після чого долити дистильованою водою до мітки та залишити розчин до наступного заняття.
2. Стандартизація розчину KMnO4 за розчином оксалатної кислоти, який одержано з «фіксаналу»
а) Перед проведенням стандартизації приготувати розчин оксалатної кислоти з фіксаналу з молярною концентрацією речовини еквівалента с(fекв(Н2С2О4·2Н2О)=0,05 моль/дм3.
б) Титрування. Перед початком титрування сполоснути бюретку 2-3 cм3 розчину KMnO4, потім заповнити її цим розчином та встановити рівень в бюретці на нуль. Далі взяти три конічні колби і в кожну з них піпеткою відібрати Vа=20,00 см3 розчину оксалатної кислоти, мірним циліндром 15,00 cм3 розчину H2SO4 з молярною концентрацією речовини еквівалента 2 моль/дм3. Колби нагріти на плитці до 800С (не можна доводити до кипіння, тому що в такому випадку розкладається оксалатна кислота).
в) На початку титрування до гарячого розчину оксалатної кислоти додають декілька краплин KMnO4 і чекають зникнення рожевого забарвлення. Кожну нову порцію розчину додають після зникнення забарвлення попередньої порції. Титрують до появи забарвлення, яке не зникає впродовж 30 с. Титрування повторити три рази, а для розрахунку взяти середній об’єм Vсер. (різниці між об’ємами не повинна перевищувати 0,04 см3).
Форма запису: |
|
|
− … см3 |
|
|
|
|
|
V(KMnO4) |
І титрування |
|
|
|
|
|||
|
|
ІІ титрування |
− … см3 |
|
|
|
|
|
|
|
ІІІ титрування |
− … см3 |
|
|
|
|
|
|
|
|
|
|
|
|
||
V(KMnO4)середнє значення |
– … см3 |
|
|
|
|
|||
г) |
Розрахувати |
характеристики |
робочого |
розчину |
калій |
|||
тетраоксоманганату(VII): (с(fекв(KMnO4), Т(KMnO4). |
|
|
||||||
107
Завдання 2. Визначити вміст (%) Fe2+-іонів в солі Мора (NH4)2Fe(SO4)2·6H2O і порівняти з теоретичним вмістом
Обладнання та реактиви
Терези технохімічні та аналітичні, бюкс, лійка, мірна колба з притертою пробкою (місткістю 100 см3), штатив для титрування, колби для титрування, бюретка зі скляним краном, електрична плитка, градуйована піпетка (місткістю 20 cм3), мірний циліндр, сіль Мора – (NH4)2Fe(SO4)2·6H2O, стандартний розчин KMnO4 з молярною концентрацією речовини еквівалента 0,05 моль/дм3, розчин H2SО4, з молярною концентрацією речовини еквівалента 2 моль/дм3.
Виконання роботи
1. Приготування розчину (NH4)2Fe(SO4)2·6H2O з молярною концентрацією речовини еквівалента 0,05 моль/дм3
а) Розрахувати теоретичну наважку (NH4)2Fe(SO4)2·6H2O для приготування 100 см3 розчину з молярною концентрацією речовини еквівалента 0,05 моль/дм3. Для розрахунку попередньо записати рівняння реакції взаємодії (NH4)2Fe(SO4)2·6H2O з KMnO4 в кислому середовищі (H2SО4), урівняти іонноелектронним методом та визначити для них фактори еквівалентності речовини та молярні маси еквівалентів.
б) Взяти розраховану наважку солі Мора на аналітичних терезах.
Форма запису: |
|
|
маса бюкса з речовиною |
– ... |
г; |
маса порожнього бюкса |
– ... |
г; |
маса речовини m(сіль Мора) |
– ... |
г. |
в) Для приготування розчину в мірну колбу на 100 см3 відміряти мірним циліндром 30 см3 розчину сульфатної кислоти (с(1/2 H2SО4)=2 моль/дм3)), перенести наважку, довести до мітки дистильованою водою, ретельно перемішати.
2. Визначення вмісту (%) Fe2+-іонів у солі Мора
а) Титрування. Перед початком титрування сполоснути бюретку 2-3 cм3 стандартного розчину KMnO4 (який було приготовлено в попередній роботі), потім заповнити бюретку цим розчином та встановити рівень на нуль. Далі взяти три конічні колби і в кожну з них піпеткою відібрати Vа = 20,00 см3 солі Мора, мірним циліндром 15,00 cм3 розчину H2SO4.
б) При титруванні розчин KMnO4 треба додавати по краплям весь час перемішуючи круговими рухами вміст колби (без нагрівання). Титрувати до появи рожевого забарвлення, яке не зникає впродовж 30 с. Зробити відлік об’єму розчину KMnO4, який пішов на титрування з точністю до сотих та записати в журнал. Титрування повторити три рази а для розрахунку взяти середній об’єм Vсер. (різниця між об’ємами не повинна перевищувати 0,04 см3).
V(KMnO4) |
І титрування |
− ... см3 |
|
|
ІІ титрування |
− ... |
см3 |
|
ІІІ титрування |
− ... |
см3 |
|
|
|
|
V(KMnO4)середнє значення |
– ... см3 |
||
108

в) За даними титрування та законом еквівалентів розрахувати практичний вміст Fe2+-іонів у солі Мора:
|
m (Fe2+) |
алікв. |
= |
|
c ( f |
екв |
(KMnO4) ×Vсер (KMnO4) |
, |
|||||||
|
M E (Fe2+) |
|
|
|
|
1000 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
m (Fe2+) |
наважка |
= m (Fe2+) |
алікв. |
× |
VМ,К, |
, |
|
|||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
Vа |
|
|||||
|
w%(Fe+2)практ. |
= |
m (Fe2+ ) |
наважка |
×100% . |
|
|||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
mнаважки |
|
|
|
|
|
||
г) Розрахувати теоретичний |
|
вміст (%) |
Fe2+-іонів у солі Мора – |
||||||||||||
(NH4)2Fe(SO4)2·6H2O.
д) У висновку порівняти одержаний результат з теоретичними розрахунками.
4.6. ЛАБОРАТОРНА РОБОТА № 21 Методи осадження. Аргентометрія
Теоретична частина
В основі методів осадження лежать реакції, в результаті яких відбувається утворення малорозчинних сполук, тобто реакції осадження. Основною кількісною характеристикою розчинності осадів є добуток розчинності (ДР), який дорівнює добутку концентрацій іонів у насиченому розчині в ступені, що відповідає їх стехіометричним коефіцієнтам. В методах осадження використовують реакції, що задовольняють таким вимогам:
а) Осад має бути практично нерозчинним, тобто розчинність його не повинна перевищувати 10-6 моль/дм3;
б) Утворення осаду при титруванні має відбуватися миттєво, тобто не повинен утворюватись пересичений розчин;
в) Осади, що утворюються, не повинні адсорбувати речовини, які реагують; г) Необхідно мати можливість визначати точку еквівалентності, тому що осад,
який утворюється, часто заважає спостереженню за зміною забарвлення індикатора.
Вказаним вимогам відповідають далеко не всі реакції осадження. На практиці найчастіше використовують реакції утворення малорозчинних сполук срібла, використовуючи в якості робочого розчину AgNO3. Засновані на цих реакціях методи об’єднані під загальною назвою аргентометрія. Зазвичай аргентометрія застосовується для кількісного визначення галогенідта роданідіонів: Cl–, Br–, I–, SCN–. Точка еквівалентності в методах осадження характеризується певною концентрацією іонів у розчині. Ця концентрація розраховується за значенням добутку розчинності осаду, що утворюється.
Приклад:
Розрахувати концентрацію іонів у точці еквівалентності для осаду AgCl. Для розрахунку знаходимо в довіднику значення добутку розчинності ДРAgCl=10-10 моль/дм3. В точці еквівалентності в розчині немає надлишку іонів
Ag+ або Cl–, тобто [Ag+]=[Cl–]= 
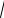 10−10 =10-5 моль/дм3.
10−10 =10-5 моль/дм3.
109
Існує дві групи методів визначення точки еквівалентності в аргентометрії:
1)Безіндикаторні, які є незручними в роботі і не забезпечують точних результатів титрування;
2)Індикаторні, в яких індикатор підбирають залежно від умов титрування. Зазвичай використовують речовини, які поблизу точки еквівалентності утворюють
зробочим розчином забарвлені осади або розчинні забарвлені сполуки. Найбільш розповсюдженими індикаторними методами в аргентометрії є метод Мора та метод Фольгарда.
а) Метод Мора або метод прямого титрування застосовується для кількісного визначення іонів Cl– та Br–. В якості робочого розчину використовують розчин
AgNO3.
NaCl+ AgNO3= AgCl↓+ NaNO3
Індикатором є дикалій хромат K2CrO4, який з іонами Ag+ утворює забарвлений
уцегляно-червоний колір осад Ag2CrO4. Цей осад більш розчинний ніж AgCl і починає утворюватися лише після того, як практично всі Cl– -іони будуть осаджені
увигляді білого осаду AgCl, тобто в точці еквівалентності.
Ag++CrO42– = Ag2CrO↓
Головним недоліком методу Мора є те, що він може бути застосований лише в нейтральних розчинах, а також визначенню заважають усі іони, які в нейтральному середовищі утворюють з Ag+ важкорозчинні сполуки, або забарвленні осади.
б) Метод Фольгарда (тіоціанатометрія) застосовується для кількісного визначення іонів Cl–, Br–, I–, SCN–, CN–. Як робочі використовують розчини AgNO3 та KSCN. Індикатором є розчин залізоамонійних галунів – NH4Fe(SO4)2·12H2O. Даний метод ґрунтується на використанні зворотнього титрування. До аналізованого розчину додають надлишок стандартного розчину AgNO3 та відтитровують його розчином тіоціонату в присутності залізоамонійних галунів, які утворюють з NCS–-іонами розчинну у воді інтенсивно-червону сіль заліза тіоціонату(ІІІ). Для встановлення точки еквівалентності іноді використовують адсорбційні індикатори (флуоресцеїн, еозин), які є органічними барвниками та здатні адсорбуватися на поверхні осадів і різко змінювати своє забарвлення. Метод Фольгарда застосовують в кислому середовищі – це є його основною перевагою.
Аргентометричний метод визначення є дуже точним та зручним і широко використовується на практиці. Основним недоліком цього методу є висока ціна і дефіцитність AgNO3.
Практична частина
Завдання 1. Приготувати та провести стандартизацію робочих розчинів аргентометрії
Обладнання та реактиви
Терези технохімічні та аналітичні, бюкси, лійка, мірні колби з притертими пробками (місткістю 50 та 100 см3), штатив для титрування, колби для титрування, бюретка, градуйована піпетка (місткістю 25 cм3), мірна пробірка, кристалічний AgNO3, кристалічний NaCl марки „х.ч.”, 5% розчин K2CrO4.
110
