
- •А.А.Свитцов введение в мембранную технологию Учебное пособие
- •Глава 1. Вода и ее свойства
- •Какая же она – молекула воды?
- •Структура жидкой воды
- •Водные растворы
- •Растворы неэлектролитов в воде
- •Растворы электролитов в воде
- •Энергетические эффекты растворения
- •Осмотическое давление раствора
- •0,5 Г/л, температура – 10оС.
- •32,0 Г/л; температура – 20оС.
- •Осмотическая машина
- •Глава 2. Мембранные процессы
- •2.1. Массоперенос через мембраны
- •2.2.Баромембранные процессы
- •2.2.1.Обратный осмос
- •2.2.2. Ультрафильтрация
- •2.2.3. Микрофильтрация
- •2.2.4. Нанофильтрация
- •2.2.5. Классификация баромембранных процессов
- •2.3. Диффузионные мембранные процессы
- •2.3.1. Разделение газовых смесей
- •2.3.2. Диализ
- •2.3.3. Мембранная экстракция (жидкие мембраны)
- •2.4. Термомембранные процессы
- •Мембранная дистилляция
- •2.4.2.Первапорация (испарение через мембрану)
- •2.5. Электромембранные процессы (электродиализ)
- •Глава 3. Поляризационные явления на мембранах
- •3.1. Концентрационная поляризация
- •3.2. Гелевая поляризация
- •3.3. Осадкообразование на мембране
- •3.4. Влияние поляризационных явлений на удельную производительность мембран
- •Глава 4. Полупроницаемые мембраны
- •4.1. Классификация мембран
- •4.3.1. Основные понятия о полимерах
- •4.3.3.Растворы полимеров
- •4.3.4.Расплавы полимеров
- •4.3.5. Методы получения полимерных мембран
- •4.22. Схема строения активного слоя анизотропной мембраны
- •4.26. Схема получения полого волокна методом сухого формования:
- •4.3.5.3. Получение пористых мембран из порошков полимеров
- •4.3.5.4.Получение пористых мембран растворением полимера
- •4.4.1.Мембраны из микропористого стекла
- •4.4.2. Металлические мембраны
- •4.4.3.Мембраны из керамики
- •4.4.4.Мембраны из графита
- •4.5.Композиционные мембраны
- •4.5.1.Композитные мембраны с полимерным разделительным слоем, полученным методом полива на поверхность воды
- •4.5.3.Композитные мембраны с полимерным разделительным слоем, полученные методом полива на подложку
- •4.5.3.Композитные мембраны с полимерным разделительным слоем, полученные методом межфазной поликонденсации
- •4.5.4. Композитные мембраны на неорганических носителях
- •4.5.5. Динамические мембраны
- •4.5.6.Нанесенные мембраны
- •Определение структуры и свойств мембран
- •4.6.1. Общая пористость
- •4.6.2.Размер пор
- •1. Электронная микроскопия
- •2.Ртутная порометрия
- •3.Метод "точка пузырька"
- •4. Проточная порометрия
- •4.6.3.Физико-механические характеристики мембран
- •1. Толщина мембраны
- •2.Механическая прочность
- •3.Анизотропия мембран
- •4.6.4.Технологические свойства мембран
- •1. Удельная производительность (проницаемость)g.
- •2.Задерживающая способность r
- •4.6.5. Методы калибровки пористых мембран
- •1. Калибровка по определению молекулярно-массового отсекания (cut-off) мембран.
- •2.Калибровка по задержанию частиц определенного размера.
- •Глава 5. Мембранная техника
- •Мембранные элементы
- •5.1.1. Аппараты с плоскими мембранными элементами
- •Аппараты с рулонными мембранными элементами
- •Аппараты с патронными мембранными элементами
- •Аппараты с трубчатыми мембранными элементами
- •Аппараты с капиллярными мембранными модулями
- •5.2. Мембранные установки
- •Генератор движущей силы
- •Предварительная обработка исходной смеси
- •Регенерация мембран и мойка оборудования
- •Рекуперация энергии
- •3) Составим материальный баланс процесса опреснения:
- •6) Расход энергии на нагнетание морской воды в опреснительную установку
- •Контроль, управление и автоматизация
- •5.3.Поточные схемы мембранных установок
- •Глава 6. Прикладная мембранная технология
- •6.1. Технологические приемы осуществления мембранных процессов разделения
- •6.1.1. Диафильтрация
- •6.1.2. Мицеллярно-усиленная ультрафильтрация
- •6.1.3. Мембранный реактор
- •6.2. Рынок мембранных технологий
- •6.2.1. Опреснение соленых вод
- •6.2.2. Получение сверхчистой воды
- •6.2.3. Переработка промышленных отходов
- •6.2.4. Биотехнология
- •6.2.5. Пищевая промышленность
- •6.2.6. Медицина
- •6.2.7. Первапорация
- •6.2.8. Разделение газовых смесей
Водные растворы
Вода – прекрасный растворитель, и вся земная жизнь протекает в водных растворах. Человечество постепенно выстраивает представление о том, что такое раствор, и наши соотечественники – М.В.Ломоносов и Д.И.Менделеев были одними из первых. Оценивая вклад Д.И.Менделеева в эту проблему, академик Н.А.Морозов писал, что «после периодической системы элементов химическая теория растворов – это самое важное его достижение».
Развитие теории растворов связано с одним, по тем временам загадочным явлением, получившим название «осмос». Впервые его наблюдал и открыл в 1748 году профессор физики в Париже аббат Ж.Нолле (1700-1770). Сосуд с вином плотно закрывали пленкой животного происхождения и помещали воду. Через некоторое время пленка разрывалась, т.е. через нее в сосуд втягивалась вода и повышалось давление до разрушения пленки.
Немецкий физиолог В.Пфеффер (1845-1920) продолжил изучение осмоса и установил, что втягивание воды через пленку, во-первых, происходит до некоторого равновесия, которое он определил количественно в следующем эксперименте (рис.1.10). Эта величина получила название «осмотическое давление раствора».
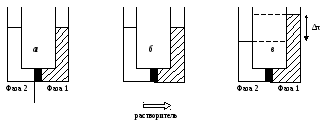
Рис.1.10. Схема эксперимента по определению осмотического давления
Во-вторых, Пфеффер обнаружил, что химический состав раствора не меняется после разбавления его водой, т. е. пленка обладает селективностью (избирательностью) по проникающим компонентам. Появился термин «полупроницаемая мембрана». Однако Пфеффер не смог установить количественные зависимости осмотического давления от концентрации и температуры.
В 1886 году известный физико-химик Я.Вант-Гофф (1852-1911) в журнале шведской академии наук опубликовал работу под названием «Химическое равновесие в системах газов и разведенных растворов». В конце концов открытый им закон формулировался так: Свойства разбавленных растворов (температура кипения, температура замерзания, плотность, осмотическое давление) изменяются прямо пропорционально молекулярной концентрации растворенного вещества».
Уравнение Вант-Гоффа:
π = i c R T (1.1)
где π – осмотическое давление;
i– коэффициент Вант-Гоффа;
c– мольная концентрация;
R– газовая постоянная;
T– абсолютная температура
Эмпирический коэффициент Вант-Гоффа в дальнейшем развитии теории оказался тем узелком, на котором все сошлось. Для NaCl,KCl–i= 2, дляNa2SO4–i= 3. Экспериментально это было определено, а объяснений не было, пока к разработке теории растворов не подключился шведский физико-химик С.Аррениус (1859-1927).
То, что предложил Аррениус, разрушало все основы теоретической химии. Принципиальным считалось, что молекула сложного вещества представляет собой очень прочное соединение, атомы в котором связаны могучими силами химического сродства. Растворение вещества в воде представляли как его распределение в объеме в виде отдельных молекул.
Аррениус же утверждал, что вещество в воде самопроизвольно распадается на свободные ионы. Сегодня в это трудно поверить, но тогда много лет теория электролитической диссоциации считалась бредом, о ней было неприлично говорить вслух.
Закончилось все тем, что в 1903 году Аррениус получил Нобелевскую премию за свою теорию, но сам превратился в ретрограда, поскольку в 1889 году Д.И.Менделеев опубликовал свою работу «Заметки о диссоциации растворенных веществ». Там утверждалось, что после диссоциации ионы вступают во взаимодействие с молекулами воды и существуют в растворах в виде гидратов. Аррениус же и большинство других ученых считали, что молекулы Н2О нейтральны и связываться с ионами не могут.
Современное представление электролитической диссоциации – это полный или частичный распад молекул растворяемого вещества на катионы и анионы, который происходит в полярных растворителях и касается наиболее полярных связей.
Основные причины диссоциации – сольватация ионов и резкое ослабление электростатического взаимодействия между ионами за счет диэлектрической проницаемости воды. Понятно, что энергия сольватации существенно больше, чем энергия кристаллической решетки.
По причине электролитической диссоциации понижается давление пара воды над раствором, снижается температура замерзания и повышается температура кипения по сравнению с чистой водой.
