
- •2011 Укладачі:Столяренко Геннадій Степанович, д.Т.Н., професор; Паранько н.Г., старший викладач. Рецензент: Вязовик Віталій Миколайович, к.Т.Н., доцент
- •1.2 Мембрани, що використовують в процесах зворотного осмосу і ультрафільтрації
- •1.3 Фізико-хімічні основи мембранних методів
- •1.4 Зворотній осмос
- •1.5 Ультрафільтрація
- •6 Розрахункова частина
- •1.2 Вплив в’язкості і температури на процес розділення
- •3 Розрахункова частина
- •1 Теоретичні основи
- •2 Опис лабораторної установки та послідовність виконання роботи
1.4 Зворотній осмос
Сутність процесу полягає в фільтруванні розчинів під тиском, який перевищує осмотичний, через напівпроникну мембрани, які пропускають розчинник і затримують молекули або іони розчинених речовин. В основі зворотного осмосу лежить явище осмосу – самовільного переходу розчинника через напівпроникну мембрану в розчин, по досягненню рівноваги. Тиск, при якому він встановлює, називається осмотичним. Якщо з боку розчину прикласти тиск, що перевищує осмотичний, то перенос розчинника буде відбувається у зворотному напрямку, що знайшло своє відображення в назві процесу «зворотний осмос». На рис. 2 показана схема проходження води через мембрану.
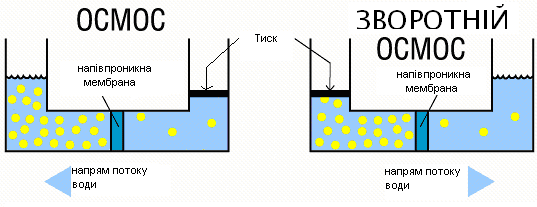
Рисунок 2 – Схема проходження води через мембрану
Робочий тиск в зворотно осмотичних установках повинен бути значно більший за осмотичний тиск розчинів, оскільки їх продуктивність визначається рушійною силою процесу – різницею між робочим і осмотичним тисками. Він складає 6-10 МПа. Зворотному осмосу підлягають розчини з діаметром часток:
![]() (3)
(3)
 де
П2 –
осмотичний тиск пермеату;
де
П2 –
осмотичний тиск пермеату;
П3 – осмотичний тиск у поверхні мембрани розчину, що розділяється.
Так як визначення величини
осмотичного тиску біля поверхні мембрани
П3
часто ускладнено, тому його прирівнюють
до осмотичного тиску П1
в розчині, що розділяється, тобто П3
= П1.
По капілярно-фільтраційній моделі
селективної проникності на поверхні
та в середині пор ліофільної мембрани,
яка занурена в розчин електроліту,
утворюється поверхневий шар зв’язаної
води товщиною tз.
Зв’язана вода має знижену розчину
здатність, тому її присутність в порах
мембрани – одна з основних причин того,
що іони (або молекули), для яких зв’язана
вода практично не є розчинником, не
проходить через мембрану. Якщо діаметр
пор мембрани
![]() (де
dг.і.
– діаметр гідравлічного іону),то через
пори буде проходити лише вода, що і
зумовлює селективність таких мембран.
(де
dг.і.
– діаметр гідравлічного іону),то через
пори буде проходити лише вода, що і
зумовлює селективність таких мембран.
За звичай мембрани мають
пори різного діаметра, в тому числі і
великі
![]() ,
а зв’язана вода, хоча і в малих кількостях,
але все ж таки розчиняє неорганічні
солі. Тому селективність мембран тим
вища, чим більша товщина зв’язаної води
і чим більша здатність до гідратації
іону, що визначається енергією або
теплотою гідратації.
,
а зв’язана вода, хоча і в малих кількостях,
але все ж таки розчиняє неорганічні
солі. Тому селективність мембран тим
вища, чим більша товщина зв’язаної води
і чим більша здатність до гідратації
іону, що визначається енергією або
теплотою гідратації.
Таким чином, мембрана, що використовується в процесі зворотного осмосу, повинна володіти селективною сорбцією по відношенню до проникаючого компонента; діаметр пор не повинен перевищувати суму подвоєної товщини шару зв’язаної води і діаметра гідравлічного іону (так як розділення відбувається на межі розділу мембрана – розчин, вказаний розмір пор необхідний лише в поверхневому шарі мембрани, який повернений до розчину); мати анізотропну структуру по товщині для зниження гідравлічного опору.
1.5 Ультрафільтрація
Ультрафільтрація – це процес розділення розчинів високомолекулярних та низькомолекулярних з'єднань, а також фракціонування та концентрування високомолекулярних з'єднань. Він протікає під дією різниці тисків до та після мембрани.
Ультрафільтрацію на відмінну
від зворотного осмосу використовують
для розділення систем, в яких молекулярна
маса розчинних компонентів набагато
більша за молекулярну масу розчинника.
Оскільки осмотичні тиски високомолекулярних
з’єднань невеликі (як правило, вони не
перевищують десятих часток мега Паскаля),
тому ультрафільтрацію проводять при
невеликих тисках (0,2 – 1,0 МПа), а при
розрахунках рушійної сили осмотичними
тисками часто можна знехтувати. Якщо ж
ультрафільтрації піддають розчин
достатньо високої концентрації або
якщо відбувається відкладення на
мембрані речовини, що затримується, то
при розрахунках рушійної сили процесу
слід враховувати осмотичний тиск розчину
 високомолекулярної
речовини біля поверхні мембрани.
Ультрафільтрації підлягають розчини
з діаметром часток – 0,005-0,05 мкм. На рис.
3 показана мембранна установка для
глибокого очищення питної води.
високомолекулярної
речовини біля поверхні мембрани.
Ультрафільтрації підлягають розчини
з діаметром часток – 0,005-0,05 мкм. На рис.
3 показана мембранна установка для
глибокого очищення питної води.

Рисунок 3 – Мембранна установка для глибокого очищення питної води
Для досягнення селективності φ = 100% в ультрафільтрації при діаметрі часток в системі, що розділяється, порядку декількох мікрометрів та менше достатньо дотримання умови:
![]() (4)
(4)
де R – радіус пори;
r – радіус часток.
Це відношення дозволяє у першому наближені підбирати мембрани з раціональним розміром пор для ультрафільтрації, якщо відомо значення r.
2 ПОСУД, РОЗЧИНИ ТА ОБЛАДНАННЯ
Посуд:
піпетки ємкістю: 1, 2, 5 см3;
колби мірні ємкістю: 1 дм3, 50 см3;
стакан ємкістю 250 см3;
піпетка Мора ємкістю 20 см3.
Розчини:
кислота ортофосфорна H3PO4 17%-ий розчин;
дифенілкарбазид (С6H5)2C(NH)4 0,25%-ий розчин;
розчин з вмістом Cr6+ – 1 мг/см3;
дистильована вода.
Обладнання:
КФК-2;
мембрана УАМ – 100;
мембранна установка;
балон з стиснутим аргоном.
 3
ПРИГОТУВАННЯ МОДЕЛЬНОГО
РОЗЧИНУ
3
ПРИГОТУВАННЯ МОДЕЛЬНОГО
РОЗЧИНУ
В колбу ємкістю 1 дм3 вносимо 10 см3 розчину, що містить Cr6+ – 1мг/см3, та доводимо об'єм до мітки дистильованою водою.
Таким чином отримуємо модельний розчин, який містить 10 мг/дм3 іонів Cr6+.
4 ОПИС ЛАБОРАТОРНОЇ УСТАНОВКИ
Лабораторна установка для проведення іонообмінного очищення моделі стічної води зображена на рис. 4.
Лабораторна установка складається з мембранної установки (1), (в ній розміщена напівпроникна мембрана, над якою знаходиться попередньо залитий модельний розчин , що містить іони хрому), балона із стиснутим аргоном (2), який створює тиск у мембранній установці необхідний для проведення процесу зворотного осмосу. Та приймальної колби (3), у яку стікає очищена вода.
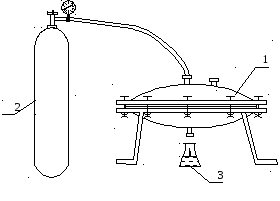
1 – мембранна установка;
2 – балон з стиснутим аргоном;
3 – приймальна колба.
Рисунок 4 – Схема лабораторної установки для проведення зворотного
осмосу.
5 ПОСЛІДОВНІСТЬ ВИКОНАННЯ РОБОТИ
Модельний розчин, що містить 10 мг/дм3 іонів Cr6+ заливаємо в мембранну установку. Під’єднуємо шланг від балону та потроху відкриваємо вентиль балону, створюючи у мембранній установці тиск. Після появи перших порцій перміату, відкидаємо його перші 50 см3. Далі відбираємо три проби перміату по 100 см3. Після цього розкручуємо мембранну установку, та відбираємо пробу ретанту.
Для визначення концентрації
іонів Cr6+,
у 3 мірні колби ємкістю 50 см3
відбираємо по 1 см3
очищеної води (перміату)із кожної проби,
у четверту  колбу
– 1 см3
ретанту. Додаємо у кожну колбу 1 см3
розчину, 4 каплі розчину фосфорної
кислоти, 2 см3
розчину дифенілкарбазиду, доводимо
дистильованою водою до мітки і перемішуємо.
Паралельно робимо розчин порівняння,
у який додаємо всі розчини окрім очищеного
розчину і доводимо дистилятом до мітки.
Видержуємо 15 хвилин і визначаємо оптичну
густину розчинів по відношенню до
розчину порівняння на КФК-2 при λ = 540 нм
у кюветі з шириною поглинаючого шару l
= 50 мм та чутливістю приладу – 2. За
виміряною оптичною густиною по
калібрувальному графіку визначаємо
концентрацію іонів Cr6+
у пробах перміату, та у ретанті.
колбу
– 1 см3
ретанту. Додаємо у кожну колбу 1 см3
розчину, 4 каплі розчину фосфорної
кислоти, 2 см3
розчину дифенілкарбазиду, доводимо
дистильованою водою до мітки і перемішуємо.
Паралельно робимо розчин порівняння,
у який додаємо всі розчини окрім очищеного
розчину і доводимо дистилятом до мітки.
Видержуємо 15 хвилин і визначаємо оптичну
густину розчинів по відношенню до
розчину порівняння на КФК-2 при λ = 540 нм
у кюветі з шириною поглинаючого шару l
= 50 мм та чутливістю приладу – 2. За
виміряною оптичною густиною по
калібрувальному графіку визначаємо
концентрацію іонів Cr6+
у пробах перміату, та у ретанті.
Вміст іонів хрому у пробі, з урахуванням розведення обчислюємо за формулою:
![]() (5)
(5)
де α – вміст Cr6+, визначений за допомогою калібрувального графіку,
мг/дм3;
γ – об'єм води, взятої для аналізу, см3.
Ефективність очищення визначаємо за формулою:
![]() (6)
(6)
де СП – концентрація Cr6+ у модельному розчині, мг/дм3;
СК – концентрація Cr6+ після очищення, мг/дм3.
