
- •Міністерство освіти і науки України
- •Строение и уровни структурной организации белков
- •3. Свойства белков
- •4. Классификация белков
- •Лекция № 2 « Ферменты» План лекции
- •Строение ферментов
- •4.2. Механизм действия ферментов
- •4.3. Свойства ферментов
- •Лекция № 3 углеводы.
- •Лекция № 4 липиды. План лекции
- •3.Сложные липиды
- •Лекция № 5 “Основные представления об обмене белков”
- •Пути обмена аминокислот
- •Дезаминирование аминокислот
- •Трансаминирование (переаминирование) аминокислот
- •Восстановительное аминирование
- •Обмен липидов
- •Лекция № 8 «витамины» План лекции
- •8.2. Водорастворимые витамины
3.Сложные липиды
Фосфолипиды — сложные эфиры многоатомных спиртов и высших жирных кислот, содержащие остатки фосфорной кислоты и связанные с нею добавочные соединения (аминоспирты, аминокислоты и др.). Фосфолипиды в зависимости от спирта, входящего в их состав, подразделяют на фосфатиды и сфингофосфолипиды. В состав фосфатидов входит глицерин. Их рассматривают как производные фосфатидной кислоты, откуда и происходит название этой группы фосфолипидов. Фосфатиды различаются высшими жирными кислотами и азотсодержащими соединениями, входящими в их состав. В зависимости от азотсодержащего соединения среди фосфатидов различают фосфатидилхолин (лецитин), фосфатидилколамин (кефалин), фосфатидилсерин и т. д. Наиболее распространены в природе лецитины.
Сфингофосфолипиды. Из названия этой группы фосфолипидов ясно, что в их состав входит спирт сфингозин. Большое количество сфингофосфолипидов содержится в нервной ткани и крови человека. В плазме крови содержится 8—15% сфингофосфолипидов, а в мембранах эритроцитов — 30—40% (от общего содержания липидов).
Гликолипиды. В состав гликолипидов входит сфингозин, ВЖК и углеводный компонент. В качестве углеводного компонента могут выступать глюкоза, галактоза, глкжозамин, галактозамин и их ацетильные производные либо олигосахаридные цепи, состоящие из перечисленных моносахаридов. Высшие жирные кислоты, входящие в состав гликолипидов, весьма разнообразны. Гликолипиды обнаружены в головном мозге.
Лекция № 5 “Основные представления об обмене белков”
План лекции.
5. 1.Биологическое значение белкового обмена
5.2. Переваривание белков в пищеварительном тракте.
5.3. Образование ядовитых продуктов распада белков и их обезвре-
живание.
Катаболизм белков и аминокислот в тканях.
5.5. Процессы обезвреживания аммиака.
Биологическое значение белкового обмена
Белковый обмен занимает основное место среди разнообразных превращений, свойственных живой материи. В течение всей жизни в организме происходят одновременно разрушение и биосинтез клеток и тканей. Эти противоположные, но тесно связанные между собой процессы ассимиляция и диссимиляция- составляют основу жизни. Следовательно, в организм должны постоянно поступать вещества, необходимые для построения новых клеток. Главная роль в этом принадлежит белкам.
Одним из методов, характеризующим состояние белкового обмена в организме, может быть определение баланса азота. У здорового человека при нормальном питании отмечается состояние белкового равновесия, когда поступление азота компенсирует его расходы. При отрицательном азотистом балансе количество выводимого азота превышает количество поступающего. Такое состояние может наблюдаться при нарушении деятельности пищеварительной системы, белковом голодании и т.п.
Положительный азотистый баланс бывает в тех случаях, когда количество выводимого азота меньше поступающего. Это характерно для растущего организма, беременности, при повышении активности процессов биосинтеза белка (например при физических нагрузках).
Для нормальной жизнедеятельности необходимо такое количества полноценного белка, которое будет покрывать все потребности организма. Суточная потребность в белке зависит от пола, возраста, интенсивности труда и т.д. С учетом этих факторов разработаны нормы белкового питания. Недостаточное потребление белков приводит к нарушению процессов жизнедеятельности, ухудшению здоровья, а продолжительное белковое голодание неизбежно заканчивается гибелью.
Белки, необходимые для организма как пластический материал, из которого строятся клетки всех органов, тканей и систем, поступают с пищей. Однако пищевые белки не могут быть использованы без предварительного расщепления в организме, так как они обладают сложной структурой и видовой специфичностью.
Расщепление (гидролиз) белков на аминокислоты, которые лишены видовой и тканевой специфичности, происходит в желудочно-кишечном тракте.
5.2. Переваривание белков в пищеварительном тракте.
Биологическое значение процесса переваривания чрезвычайно велико. Под влиянием целого комплекса ферментов молекула белка расщепляется (преимущественно путем ферментативного гидролиза) на аминокислоты и низкомолекулярные пептиды, которые всасываются через мембраны клеток тонкой кишки,
В процессе расщепления молекул белков утрачиваются уникальные свойства, присущие данному белку, в том числе антигенные, инфекционные, что предохраняет организм от различных неблагоприятных воздействий чужеродных белков. Чужеродные белки могут изменять реактивность организма, например, ослабить иммунитет или повысить восприимчивость к инфекционным заболеваниям, а иногда даже привести организм к гибели.
В процессе переваривания тысячи различных белков пищевых продуктов растительного и животного происхождения превращаются (главным образом) в смесь из двадцати аминокислот, что способствует усвоению белков пищи и единству обмена веществ в организме.
Сложные белки (нуклеопротеиды, хромопротеиды) вначале расщепляются на простой белок и простетические группы (нуклеиновые кислоты и гем). Простетические группы в свою очередь распадаются под действием ферментов на еще более простые соединения, а простые белки расщепляются до аминокислот.
В желудке простые и сложные белки подвергаются физико-химиче-ским изменениям и ферментативным превращениям. Желудочный сок содержит соляную кислоту и протеолитические ферменты, расщепляющие белки. Общее количество сока, выделяемого за сутки, в среднем составляет около 2,5 л. Благодаря наличию соляной кислоты, вырабатываемой в обкладочных клетках слизистой оболочки, желудочный сок имеет кислую реакцию среды, что способствует перевариванию. Под влиянием соляной кислоты белки пищи денатурируются и быстрее расщепляются ферментами, чем в нативном виде. Кроме того, в сильно кислой среде они набухают, разрыхляются, вследствие чего увеличивается их поверхность, а следовательно, и площадь контакта с ферментами.
Это особенно относится к белкам кожи, сухожилий, соединительной ткани (коллагену, эластину, кератину) и другим трудно перевариваемым белкам, ферментативному расщеплению которых способствует соляная кислота. Соляная кислота также обладает бактерицидными свойствами, способствует эвакуации пищи из желудка и регулирует ферментативную функцию поджелудочной железы.
Переваривание белков в желудке продолжается 6—8 ч и более под влиянием кислых протеаз, объединяемых общим названием пепсины. Различают пепсин А, пепсин В и пепсин С, или гастриксин. Они проявляют максимальную каталитическую активность при различных значениях рН: пепсин—при рН =1,5—2,5 и гастриксин при рН = 3,5—4,5. В результате действий пепсина образуются полипептиды различной величины и отдельные свободные аминокислоты. Гастриксин вступает в действие на последних этапах переваривания пищи в желудке. При рН =5,0—6,0 пепсин практически не расщепляет белки. Пепсин и гастриксин вырабатываются главными клетками слизистой оболочки желудка в неактивной форме в виде проферментов, которые превращаются в активные формы при участии соляной кислоты.
В желудке грудных детей обнаружен сычужный фермент- химозин. Оптимум действия этого фермента соответствует рН 3,5-4,5. Под влиянием химозина в присутствии солей кальция казеиноген молока в ходе гидролиза преобоазуется в казеин, и молоко сворачивается.
Легче других в желудке перевариваются альбумины и глобулины животного и растительного происхождения; плохо расщепляются белки соединительтной ткани (коллаген и элластин) и совершеннно не расщепляется кератин и протамины.
Образовавшиеся в желудке полипептиды и нерасщепленные белки поступают в двенадцатиперстную кишку – начальный отдел тонкой кишки, а затем в ее нижележащие отделы. Здесь они подвергаются воздействию большой группы ферментов, вырабатываемых поджелудочной железой и слизистой оболочкой тонкой кишки.
Сок поджелудочной железы поступает в двенадцатиперстную кишку и смешивается с кишечным соком.Эта смесь содержит протеолитические ферменты, расщепляющие белки до аминокислот. К нимотносятся трипсин, химотрипсин, карбоксипептидазы, аминопептидазы и большая группа три и дипептидаз
Трипсин находится в соке поджелудочной железы в неактивной форме, в виде профермента трипсиногена. Его активация происходит под действием фермента кишечного сока энтерокиназы. Для процесса активирования необходимы ионы Са . Процесс превращения трипсиногена в трипсин осуществляется путем отщепления небольшого пептида с N-конца петидной цепи фермента.
Трипсин гидролизует как не расщепленные в желудке белки, так и высокомолекулярные пептиды. действуя главным образом на пептидные связи между аргинином и лизином. Оптимуму рН для трипсина составляет 7,0-8,0. Трипсин производит сравнительно неглубокий гидролиз белка, образуя полипептиды и небольшое количество свободных аминокислот.
Активность трипсина может быть снижена под влиянием ряда ингибиторов. К ним относятся основные пептиды, обнаруженные в поджелудочной железе, крови, легких, в бобах сои. Снижает активность трипсина и мукопротеин, содержащийся в сырых яйцах.
Химотрипсин – второй протеолитический фермент поджелудочной железы. Он также секретируется в неактивной форме, в виде химотрипсиногена. Под действием трипсина химотрипсиноген переходит в активный фермент – химотрипсин. Действие химотрипсина подобно действию трипсина. Оптимум рН для обоих ферментов приблизительно одинаков, химотрипсин действует на белки и полипетиды, которые содержат ароматические аминокислоты(тирозин, фенилаланин,триптофан), а также на пептидные связи, не подвергающиеся воздействию трипсина (метионин,лейцин).
Пептиды, образовавшиеся в результате действия на белки пепсина, трипсина и химотрипсина в ниже лежащих отделах тонкой кишки, подвергаются дальнейшему расщеплению. Данный процесс осуществляют карбоксипептидазы, аминопептидазы. Эти ферменты относятся к металлоферментам. Они активируются двухвалентными ионами Mg 2+, Mn2+, Co2+ , которые играют важную роль в формировании фермент-субстратного комплекса.
Механизм действия амино- и карбоксипептидаз заключается в отщеплении от пептидов концевых аминокислот,имеющих свободную аминную или карбоксильную группу. Оставшиеся нерасщепленными небольшие пептиды, состоящие из трех-четырех аминокислотных остатков, подвергаются гидролизу специфическими ди- и триаминопептидазами.
Таким образом, в результате последовательного действия на белки протеолитических ферментов в кишечнике образуются свободные аминокислоты, которые всасываются в кровь через стенку кишечника.
5.3. Образование в кишечнике ядовитых продуктов распада белков и их обезвреживание.
Аминокислоты, не всосавшиеся в кровь через тонкую кишку, подвергаютс воздействию микролорганизмовв толстом кишенике. При этом ферменты микроорганизмов расщепляют аминокислоты т превращают их в амины, жирные кислоты, спирты, фенолы и другие вещества, нередко ядовитые для организма. Этот процесс иногда называют гниением белков в кишечнике. В его основе лежит декарбоксилирование аминокислот, при этом из аминокислот появляются биологические амины. Так из аминокислоты орнитина образуется путресцин:
С


 Н2–СН
2–СН
2–СН
–СООН → СН2-СН2-СН2-СН2
+ СО2
Н2–СН
2–СН
2–СН
–СООН → СН2-СН2-СН2-СН2
+ СО2
N
Н2
N
Н2
N
Н2
NН2
Орнитин Путресцин
Из лизина образуется кадаверин:
NН2-СН-СООН → NН2-(СН2)5-NН2 + СО2
 (СН2)4
Кадаверин
(СН2)4
Кадаверин
 NН2
NН2
Лизин
Путресцин и кадаверин выводятся из организма с фекальными массами. В тех случаях, когда эти соединения попадают в кровь, они выводятся с мочой в неизменном виде.
При гниении циклических аминокислот в толстой кишке образуются ядовитые вещества, которые после всасывания через кишечник в кровь могут оказывать сильное физиологическое действие на организм.
Из тирозина образуется п-крезол, а если процесс идет дальше, то и фенол:
Н

 О-
-СН2-СН-СООН
НО- -СН3НО-
О-
-СН2-СН-СООН
НО- -СН3НО-
 NН2
NН2
Тирозин Крезол Фенол
Из триптофана образуется скатол и индол:




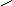



 СН3
СН3

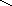

 NН
NН
NН
NН
Скатол Индол
При глубоком разрушении кишечными микроорганизмами серосодержащих аминокислот – цистина, цистеина и метионина – образуются сероводород (Н2S), меркаптан (СН3SН) и другие включающие серу соединения.
Продукты гниения белков всасываются в венозную кровь, затем попадают в печень, где и обезвреживаются при помощи серной или глюкуроновой кислоты.
Индол и скатол также обезвреживается в печени при участии серной и глюкуроновой кислот. Однако, они предварительно окисляются:скатол в скатоксил, индол в индоксил и в виде парных кислот выводятся из организма с мочой .
Некоторые ядовитые вещества, например бензойная кислдота обезвреживаются в печени с помощью глицина. При этом образуется гиппуровая кислота – безвредное соединение, которое выделяется с мочой.

 -СООН
+ Н2N-СН2-СООН
-СО-NН-СН2-СООН
+ Н2О
-СООН
+ Н2N-СН2-СООН
-СО-NН-СН2-СООН
+ Н2О
Бензойная кислота Глицин Гиппуровая кислота
Возможности печени в обезвреживании образовавшихся в толстой кишке и всосавшихся в кровь ядовитых веществ не безграничны. При снижении ее функциональной способности (например, в связи с перенесенными ранее заболеваниями) поступление значительного количества ядовитых веществ может оказаться чрезмерной нагрузкой, тогда часть необезвреженных ядовитых веществ разносится (большим кругом кровообращения) по всему организму, вызывая его отравление. Происходит преждевременное старение клеток и их гибель. При этом отмечается ухудшение самочувствия человека, его мучают головные боли.
Для предупреждения отрицательного воздействия ядовитых веществ на организм необходимо рационально планировать пищевой рацион. В него должны быть включены продукты, содержащие не только белки, но и жиры и углеводы. Полезны кисломолочные продукты, так как молочнокислые бактерии способствуют гибели гнилостных микроорганизмов толстой кишки. В рационе необходима пища, являющаяся источником пектиновых веществ и клетчатки, которые повышая двигательную активность кишечника, способствуют выведению шлаков (в том числе и ядовитых веществ) из организма.
5.4. Катаболизм белков и аминокислот в тканях.
Основная часть аминокислот, образующихся в кишечнике из белков, поступает в кровь (95% и небольшая часть в лимфу. По воротной вене аминокислоты попадают в печень, где расходуются для биосинтеза различных специфических белков (альбуминов, глобулинов, фибриногена и др.), остальные аминокислоты током крови разносятся ко всем органам и тканям, транспортируются внутрь клеток, где они используются для биосинтеза белков взамен подвергшихся разрушению. Неиспользованные аминокислоты окисляются до конечных продуктов обмена.
Процесс расщепления тканевых белков катализируется тканевыми ферментами – протеиназами, катепсинами.
Соотношение между аминокислотами в распадающихся и синтезируемых белках различно, поэтому часть свободных аминокислот должна быть преобразована в другие аминокислоты либо окислена до простых соединений и выведена из организма. Следовательно, в организме существует внутриклеточный запас аминокислот, который в значительной мере пополняется за счет процессов взаимопревращения аминокислот, гидролиз белков, синтеза аминокислот и поступления их из внеклеточной жидкости. В то же время благодаря синтезу белков и другим реакциям (образованию мочевины, пуринов и т.п.) постоянно происходит удаление свободных аминокислот из внеклеточной жидкости.
