
конспекты / ------ -- 3
.pdf
МІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ ДОНБАСЬКА НАЦІОНАЛЬНА АКАДЕМІЯ
БУДІВНИЦТВА І АРХІТЕКТУРИ КАФЕДРА „ПРИКЛАДНА ЕКОЛОГІЯ І ХІМІЯ” СЕКЦІЯ ПРИКЛАДНОЇ ХІМІЇ
„КЛАСИ НЕОРГАНІЧНИХ СПОЛУК”
ДО ПРАКТИКУМУ З КУРСУ „ПРИКЛАДНА ХІМІЯ”
(для студентів спеціальностей ПЦБ, ТБК, АДА, ПЕК, ТГВ, МБГ, ВВ , ААГ, ПТМ усіх форм навчання)
Затверджено:
на засіданні секції „Прикладна хімія” Протокол №10 від 08.06.2011р.
МАКІЇВКА – ДонНАБА - 2011
2
УДК 541
Методичні вказівки до практикуму з курсу „Прикладна хімія” (для студентів спеціальностей ПЦБ, ТБК, АДА, ПЕК, ТГВ, МБГ, ВВ , ААГ, ПТМ усіх форм навчання) / Уклад.: С.І. Сохіна, З.З. Малиніна, А.В. Скляр. – Макіівка: ДонНАБА, 2011. – 33с.
Містять сучасну номенклатуру, властивості, методи добування основних класів неорганічних сполук.
Укладачі: С.І. Сохіна, доц. З.З. Малиніна, доц.. А.В. Скляр, ас.
Рецензент: Дмитрук О.Ф., д.х.н., проф. Дон ДУЕТ Сердюк О.І., д.х.н., проф.. ДонНАБА
Відповід. за випуск |
Скляр А.В., ас. |
|
3 |
|
Зміст |
|
|
Валентність |
5 |
|
1 Оксиди |
6 |
|
1.1 |
Номенклатура оксидів |
7 |
1.2 |
Властивості оксидів |
8 |
1.2.1 Основні оксиди |
8 |
|
1.2.2 Кислотні оксиди |
8 |
|
1.2.3 Амфотерні оксиди |
9 |
|
1.3 |
Методи добування оксидів |
9 |
1.4 |
Подвійні оксиди |
9 |
1.5 |
Пероксиди |
10 |
2 Складні гетеросполуки |
10 |
|
2.1 |
Основи |
10 |
2.1.1 Номенклатура основ |
12 |
|
2.1.2 Властивості основ |
12 |
|
2.1.3 Методи добування основ |
13 |
|
2.2 |
Кислоти. Класифікація кислот |
13 |
2.2.1 Номенклатура кислот |
14 |
|
2.2.2 Властивості кислот |
14 |
|
2.2.3 Методи добування кислот |
15 |
|
2.3 |
Амфотерні гідроксиди |
15 |
3. Солі |
16 |
|
3.1 |
Номенклатура солей |
17 |
3.2 |
Способи добування солей |
17 |
4 Комплексні сполуки |
20 |
|
4.1 |
Номенклатура комплексних сполук |
21 |
5 Солеподібні бінарні сполуки |
21 |
|
6 Галоген- і тіоангідріди |
21 |
|
7 Металіди (інтерметаліди) |
22 |
|
Література |
23 |
|
Додатки |
24 |
|
4
ВСТУП
Хімія – одна з природничих наук, які визначають світ у всій різноманітності його існування та перетворень. Предметом природничих наук є матерія та рух у їх нерозривній єдності.
Природа - це все існуюче у всесвіті, органічний і неорганічний світ, єдність форм у взаємопов’язаних світах: мікро -, макро - і мегасвіт. Незважаючи на якісну специфіку, єдність цих трьох світів полягає в їхній матеріальності.
Формами об’єктивного буття та розвитку матерії є рух, простір і час. До основних видів існування матерії відносяться речовини й поля, що характеризуються, з одного боку, енергією, з іншого – масою покою. Речовина та поле перебувають у нерозривному зв’язку і, залежно від умов, можуть взаємно перетворюватися.
Об’єктом вивчення хімії є хімічна форма руху матерії, яка визначається перетворенням речовин або хімічними реакціями. В основі хімічних реакцій лежать перетворення, що супроводжуються зникненням існуючих (старих) хімічних зв’язків та виникненням нових, в результаті чого змінюються склад, будова, властивості речовин.
Хімія серед базових галузей індустрії (енергетика, металургія, коксохімія, машинобудування тощо) відіграє значну роль у розвитку народного господарства. Хімізація виробничих процесів – одна з основних умов науково-технічного прогресу.
Хімія створила принципово нові речовини із заданими властивостями, без яких неможливі були б космічні польоти та найновіші технології. На сьогодні відомо понад 10 мільйонів хімічних сполук, серед котрих – близько 700 тисяч – неорганічних.
Для швидкої орієнтації серед такої кількості сполук необхідна класифікація. Класифікація – система, що дозволяє розподілити всю безліч речовин за певними
ознаками: природою (органічні та неорганічні), складом, властивостями тощо. Неорганічні сполуки за схожістю властивостей та будови поділяють на певні класи,
що визначаються як кількісним і якісним складом, так і природою хімічного зв’язку.
Усі речовини, згідно з номенклатурними правилами ІЮПАК, поділяються на прості і складні.
Прості речовини (гомосполуки) складаються з одного елемента.
Складні речовини (гетеросполуки) поділяються на класи за складом (двохелементні, або бінарні, і багатоелементні) або за функціональними ознаками.
До бінарних сполук належать оксиди, галогеніди, нітриди, карбіди, гідриди тощо, до тринарних – HNO3, NaOH тощо.
Найважливішими класами неорганічних сполук за функціональними ознаками є оксиди, кислоти, основи, амфотерні гідроксиди, солі.
5
Валентність
Поняття валентності (от лат. valentia - сила), елементів виникло в 50-х роках ХІХ ст. 1852 англ. хіміком Е. Франклендом та є основою теорії будови хімічних сполук. Таблиця Менделєєва наочно представляє зв’язок між валентністю елемента та його положенням в періодичній системі. Д.І.Менделєєв запровадив поняття про змінну валентність. З розвитком теорії будови атома та молекул поняття валентності отримало фізичне обгрунтування.
Існує декілька означень валентності, що відбивають зміст цього поняття. Найбільш загальним можна вважати наступне визначення: валентністю елемента називають властивість його атомів приєднувати або заміщувати в молекулах складних речовин певну кількість атомів іншого елемента, тобто валентність визначається числом, що вказує скільки атомів Гідрогену або іншого одновалентного елемента може прєднати до себе даний елемент. Валентність елемента виражається цілим числом. Визначена таким чином валентність називається валентністю у водневих сполуках або валентністю за Гідрогеном. Так, в сполуках Н2О, HCl, СН4 валентність за Гідроегном Оксигену дорівнює двом, Хлору
– одиниці, Карбону – чотирьом.
Валентність Оксигену, як правило дорівнює двом (виключення складають пероксиди.) Тому, маючи формулу або склад оксигеносвісної сполуки деякого елемента, можна визначити його валентність як подвоєне число атомів Оксигену, яке може приєднати один атом даного елемента. Визначена таким чином валентність називається валентністю за Оксигеном: N2O, SiO2, SO3 – валентність за Оксигеном Нітрогену дорівнює одиниці, Сіліцію – чотирьом, Сульфуру – шости.
Більшість елементів мають різні значення валентності за Гідрогеном та за Оксигеном: наприклад, валентність Сульфуру за Гідрогеном дорівнює двом (H2S), а за Оксигеном шости (SO3). Крім того, більшість елементів виявляє в різних сполуках різну валентність. Наприклад, Карбон утворює з Оксигеном два оксида : монооксид Карбону СО та диоксид Карбону СО2. В монооксиді валентність Карбону дорівнює двом, а в диоксиді – чотирьом.
Історично першим поняттям валентності атома була валентність за Гідргеном, який у всіх сполуках вважали одновалентним, і за Оксигеном, який вважали двовалентним. Це так звана формальна або стехіометрична валентність елемента – число, яке показує скільки атомів Гідрогену може приєднати або замінити у сполуках один атом даного елемента.
Менделєєв довів, що сума максимальних валентностей за Гідрогеном і за Оксигеном завжди дорівнює восьми, а максимальна валентність елементів певної групи періодичної системи зазвичай відповідає її номеру. Проте стехіометрична валентність враховує лише стехіометрію сполуки й не дає чіткого роз’яснення природи хімічного зв’язку.
Згідно зі спіновою теорією валентності (Лондон, 1928), утворення зв’язку між двома атомами обумовлено взаємною компенсацією спінів їх валентних електронів. Можливі значення валентності даного атома визначаються допустимими для нього варіантами існування електронів з неспареними спінами. Кількість варіантів залежить від максимальної ємності зовнішнього енергетичного рівня атома та числа електронів на ньому. Іноді число електронів , що витрачається атомом на утворення спільних електронних пар по одному на кожну пару (компенсація спінів), називають не валентністю, а ковалентністю (Ленгмюр, 1919).
В сучасній хімії поняття валентності пов'язується з мінливістю енергетичних рівнів електронів в зовнішніх оболонках атомів, що зумовлює зміну валентність одного й того ж атома в різних молекулах. До того ж розрізняють такі поняття — валентність атома в молекулі, валентність вільного атома або радикала, валентність іона (простого й складного). Валентність атома в молекулі характеризується його ковалентністю, тобто числом пар електронів, які зв'язують атоми в молекулі

6
1. Оксиди
Оксиди об’єднують бінарні сполуки, в складі молекул яких атоми Оксигену безпосередньо зв’язані з атомами більш електропозитивних елементів.
Оксиген найчастіше виявляє ступінь окиснення -2. В таких оксидах співвідношення компонентів відповідає правилам валентності. Наприклад:
-валентність Калію дорівнює 1, то ж формула оксиду має вид К2О;
-валентність Бору дорівнює 3, формула оксиду – В2О3.
Виключення складає сполука Оксигену з Флуором ОF2. Цю сполуку слід віднести до фторидів, а не до оксидів, оскільки Флуор є більш електронегативним елементом тому Оксиген в ній має ступінь окиснення +2.
Існують сполуки елементів з Оксигеном, що по складу відносяться до класу оксидів, але за своєю будовою та властивостями належать до класу солей – пероксиди. Пероксиди – це сполуки, в яких ступінь окиснення Оксигену дорівнює -1. Пероксидами називаються солі пероксиду Гідрогену Н2О2 , наприклад:
Na2O2 – пероксид Натрію СаО2 – пероксид Кальцію.
Для таких сполук характерна наявність пероксидної групи: ( О2 )2-.
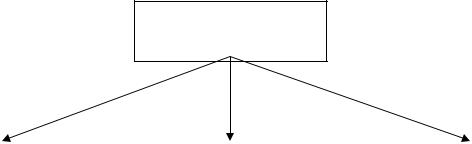
За хімічними властивостями оксиди поділяють на: солетворні (солеутворюючі) та несолетворні (несолеутворюючі). Солетворні оксиди, в свою чергу, поділяються на основні, кислотні та амфотерні.
Оксиди
Солетворні Несолетворні
основні |
|
амфотерні |
|
кислотні |
МеnОх |
|
RnОх |
|
неМеnОх |
|
|
|
|
|
Солетворні – це оксиди, що в разі перебігу певних хімічних реакцій здатні утворювати солі:
ZnO + H2SO4 = Zn SO4 + H2O
CaO + 2HCl = CaCl2 + H2O
Основними оксидами є ті, що утворюють солі при взаємодії з кислотами або з кислотними оксидами. Основним оксидам відповідають основи. До основних оксидів, як правило, належать оксиди металів (але не всі): Li2O, Na2O, MgO та інші.
Na2O + Н2О = 2NaOН
Кислотними оксидами є ті, що утворюють солі при взаємодії з основами або з основними оксидами. Приєднуючи воду кислотні оксиди утворюють кислоти. Кислотні оксиди можуть бути отримані шляхом від’єднання води від відповідних кислот, тому їх називають також ангідридами кислот. До кислотних оксидів належать оксиди неметалів: NO2, SO3, SiО2 та ін.
SО3 + Н2О = Н2SО4.
7
Амфотерні оксиди одночасно виявляють властивостя як кислотних так і основних оксидів.
ZnO + 2NaOН = Na2ZnO2 + Н2О
ZnO + H2SO4 = Zn SO4 + H2O.
Амфотерність характерна для «середніх» елементів Періодичної таблиці.
Здебільшого це d-елементи у проміжних ступенях окислення (Cr3+, Mn4+) і деякі р- елементи (Al3+, Zn2+, Pb2+ , Pb4+, Sn2+, Sn4+). Слід відмітити, що зі збільшенням ступеня
окиснення зростають кислотні властивості:
Mn2+ |
Mn3+ |
Mn4+ |
Mn6+ |
Mn7+ |
Mn(ОН)2 |
Mn(ОН)3 |
Mn(ОН)4 |
|
|
|
|
↕ |
|
|
|
|
Н2MnО3 |
Н2MnО4 |
НMnО4 |
Несолетворні – це оксиди, що не здатні утворювати солі : N2O, NO, СО, SіО.
1.1 Номенклатура оксидів Номенклатура – це сукупність чи перелік назв, що використовуються у будь-якій
науці, спеціальності, галузі тощо.
Хімічна номенклатура складається з формул і назв. Назви адекватно описують формулу сполуки, тобто склад.
Згідно з правилами Міжнародного союзу теоретичної та прикладної хімії (IUPAC), назви хімічних неорганічних сполук складаються з назв хімічних елементів, що їх утворюють, а також різних суфіксів і префіксів для позначення числа атомів або атомних груп. Для чисел використовують грецькі числівники.
Так, співвідношення (2 : 1) - напів – гемі; (1 : 1)- один – моно; (2 : 3) – півтора – сескві; (1 : 2) - два – ді; (2 : 5) - напівп’ять – геміпента; (1 : 3) – три – три; (2 : 7) – напівсім –
гемігепта, а далі: тетра- , пента-, гекса-, гепта- ...
Назви оксидів складають із латинської назви елемента в називному відмінку та слова „оксид”, при цьому вказують грецькі числівникові префікси для позначення числового співвідношення атомів, валентності або ступені окиснення.
А) Якщо елемент має тільки одне значення валентності (ступінь окиснення), в такому випадку назва оксиду складається з назви елемента в називному відмінку та слова „оксид”.
Наприклад:
Nа2О – Натрій оксид; ВаО – Барій оксид; В2О3 – Бор оксид.
Б) Якщо елемент має декілька ступенів окиснення, то для їх позначення використовують числівникові префікси.
Наприклад:
N2O - нітрогенгеміоксид, Нітроген (1+) оксид, Нітроген ( І )оксид, що говориться, як „нітроген один оксид” .
NO - нітрогенмонооксид, Нітроген (2+) оксид, Нітроген ( ІІ )оксид – „нітроген два оксид”.
В навчальних посібниках, підручниках зустрічається номенклатура, коли назва складається зі слова „оксид” і назви елементу в родовому відміннику з вказівкою його валентності або ступені окиснення.
8
Наприклад:
Nа2О – оксид натрію;
N2О – напівоксид Нітрогену, оксид Нітрогену ( І ) – оксид Нітрогену один.
1.2 Властивості оксидів
Властивості солетворних оксидів змінюються в залежності від місцезнаходження елементів в Періодичній системі та зміни валентності елемента. У періодах основні властивості послаблюються, а кислотні – посилюються. Наприклад, для елементів третього періода (Натрій, Магній, Алюміній, Фосфор, Сульфур, Хлор) властивості оксидів змінюються таким чином:
Na2O |
MgO |
Al2O3 |
SiO2 P4O10 SO3 Cl2O7 |
Основні |
|
Амфотерний |
Кислотні |
У головних підгрупах Періодичної системи кислотні властивості оксидів послаблюються, а основні – посилюються. Наприклад, у елементів головної підгрупи третьої групи (Бор, Алюміній, Галій, Індій, Талій) властивості оксидів змінюються таким чином:
B2O3 |
Al2O3 Ga2O3 |
In2O3 |
Tl2O3 |
Кислотний |
Амфотерні |
|
Основні |
Метали змінної валентності утворюють декілька оксидів. В такому випадку із зростанням валентності (ступеня окиснення) металу основні властивості послаблюються, а кислотні – посилюються. Прикладом цієї залежності є оксиди Мангану:
MnO |
Mn2O3 |
MnO2 |
MnO3 |
Mn2O7 |
Осовний |
Амфотерні |
|
К ислотні |
|
1.2.1Основні оксиди
1.Основні оксиди активних металів (лужних та лужно-земельних) взаємодіють з водою з утворенням сильних основ – лугів. Основні оксиди менш активних металів з водою за звичайних умов не взаємодіють.
Nа2О + H2O = 2 NаОН
2. Взаємодіють з кислотами з утворенням солі і води:
FeO + H2SO4 = FeSO4 + H2O
Nа2О + H2SO4 = Nа2SO4 + H2O 3. Взаємодіють з кислотними оксидами з утворенням солі:
CaO + CO2 = CaCO3
4. З основами і основними оксидами не взаємодіють
BaO + NaOH ≠
MgO + Ba(OH)2 ≠
1.2.2Кислотні оксиди
1.Взаємодіють з водою з утворенням кислот
SO2 + H2O = H2SO3
2. З лугами з утворенням солі і води
SO2 + 2NaOH = Na2SO3 + H2O 3. З основними оксидами з утворенням солі:
SO2 +Na2О = Na2SO3
4. З кислотами не взаємодіють, але
9
SiO2 + 6HF = H2SiF6 + 2H2J
SO3 + H2SO4 = H2S2O7
5. Сплавлення з лугами або відповідними карбонатами
SiO2 + Na2CO3 = Na2SiO3 + CO2
1.2.3Амфотерні оксиди
1.З лугами з утворенням солі та води:
Al2O3 + 2NaOH = 2NaAlO2 + H2O 2. З кислотами з утворенням солі та води:
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O 2. З лугами та водою з утворенням комплексних сполук:
Al2O3 + 2NaOH + 3Н2О = 2Na[Al(ОН)2]
3. З кислотними оксидами та з основними оксидами з утворенням солей:
Al2O3 + 3SO3 = Al2(SO4)3
Al2O3 + Na2O = 2 NaAlO2
1.3Методи добування оксидів
1.Взаємодія простих речовин з киснем
4Li + O2 = 2Li2O;
S + O2 = SO2; 4Al + 3O2 = 2Al2O3.
2. Взаємодія складних речовин з киснем (горіння):
2H2S + 3O2 = 2SO2 + 2H2O;
СН4 + 2О2 = СО2 + 2Н2О. 3. Розкладання при нагрівання основ:
Mg(OH)2 = MgO + H2O;
2Al(OH)3 = Al2O3 + 3H2O.
4. Розкладання кислот. Деякі кислоти, наприклад, карбонатка Н2СО3 , розкладається за звичайної температури, а інші – при нагріванні. При цьому утворюється кислотний оксид і вода:
Na2CO3 = CO2 + H2O;
Na2SiO3 = SiO2 + H2O;
H2SO4 = SO3 + H2O.
5. Розкладання при нагріванні солей; при цьому утворюються два оксиди – основний або амфотерний та кислотний:
CaCO3 = CaO + CO2;
ZnCO3 = ZnO + CO2.
6. Дія водовіднімаючих речовин (фосфорний ангідрид, сірчана кислота) на кислоти:
2HNO3 + P2O5 = N2O5 + 2HPO3;
2HMnO4 + H2SO4(конц.) = Mn2O7 + H2SO4·H2O. 7. Взаємодія нижчих оксидів з киснем:
2NO + O2 = 2NO2.
Деякі оксиди є природними сполуками (мінералами): Fe2O3 – гематіт, MnO2 – піролюзіт, TiO2 – рутіл та ін.
1.4 Подвійні оксиди
Метали змінної валентності утворюють декілька оксидів. Із зростанням валентності метала зменшуються основні та посилюються кислотні властивості його оксидів. Внаслідок цього оксиди одного метала можуть взаємодіями між собою (це відбувається при нагріванні) з утворенням подвійних оксидів, наприклад:
FeO + Fe2O3 = Fe3O4 (або FeO·Fe2O3);
2PbO + PbO2 = Pb3O4 (або 2PbO·PbO2).
10
Примітка. Подвійні оксиди можна розглядати як солі. Наприклад, подвійний оксид Pb3O4 є сіллю Pb2PbO4, в якій перші два атома Плюмбуму двовалентні, а третій – чотирьохвалентний. Назва цієї солі– ортоплюмбат Плюмбуму (IV).
1.5 Пероксиди
Кількість пероксидів обмежена : це пороксид Гідрогену (H2O2) та пероксиди лужних та лужно-земельних металів (K2O2, CaO2 та ін.). Існують відомості про існування пероксидів Магнію та Цинку, але вони нестійкі та легко розкладаються. Інші елементи пероксиди не утворюють.
Пероксиди металів утворюються при взаємодії лужних та лужно-земельних металів з надлишком кисню:
2Na + O2 = Na2O2;
Ba + O2 = BaO2.
Пероксид Гідрогену отримують при взаємодії пероксидів металів з кислотами:
BaO2 + H2SO4 = BaSO↓ + H2O2.
Пероксиди лужних та лужно-земельних металів подібно до відповідних оксидів, взаємодіють з водою, але при цьому утворюється не лише основа, але і кисень:
2Na2O2 + 2Н2O = 4NaOН + O2↑;
2BaO2 + 2Н2O = 2Ba(OН)2 + O2↑.
Проксиди взаємодіють з кислотними оксидами, утворюючи сіль та кисень: 2Na2O2 + 2CO2 = 2Na2CO3 + O2↑.
2 СКЛАДНІ ГЕТЕРОСПОЛУКИ
До складних гетеросполук відносяться такі, що в своєму складі нараховують три і більше атомів різних елементів або груп. На відміну від бінарних сполук, які є продуктами взаємодії простих речовин, складні можна розглядати, як продукти взаємодії бінарних або більш складних речовин.
Так, за умов, що всі оксиди безпосередньо могли б реагувати з водою, продуктами реакцій повинні бути гідроксиди.
Гідроксиди
Основи |
|
Амфотерні |
|
Кислоти |
R(OH )n |
|
гідроксиди |
|
НnКЗ |
|
|
R(OH)n↔НnROn |
|
|
Rn + - катіони (позитивно заряджені іони), КЗ – кислотний залишок
2.1 Основи
Загальний вид формули основи можна зобразити як
R (OH )n ,
