
Тест по теме "Электролиз"
1. При
электролизе раствора сульфата цинка с
инертными электродами на аноде выделяется:
а) цинк; б) кислород;
в) водород; г) сера.
2. Объем кислорода (в л, н.у.), выделившегося на инертном аноде при пропускании электрического тока силой 20 А в течение 2,5 ч через раствор сульфата калия, равен:
а) 10,4; б) 11,2; в) 6,8; г) 20,6.
3. При электролизе 240 г 15%-го раствора гидроксида натрия на аноде выделилось 89,6 л (н.у.) кислорода. Массовая доля вещества в растворе после окончания электролиза равна (в %):
а) 28,1; б) 32,1; в) 37,5; г) 40,5.
4. При электролизе раствора хлорида натрия образуются:
а) натрий и хлор;
б) гидроксид натрия, хлор и водород;
в) кислород и хлор;
г) натрий, хлор и соляная кислота.
5. При электролизе расплава гидроксида натрия на аноде выделяется:
а) натрий; б) водород; в) кислород; г) вода.
6. При электролизе раствора хлорида кальция на катоде выделилось 5,6 г водорода. Какова масса (в г) вещества, выделившегося на аноде?
а) 198,8; б) 99,4; в) 89,6; г) 44,8.
7. Медный купорос массой 100 г растворили в воде и провели электролиз до обесцвечивания раствора. Объем (в л, н.у.) собранного газа равен:
а) 2,24; б) 4,48; в) 11,2; г) 22,4.
8. Платиновый электрод:
а) инертный;
б) растворимый;
в) расходуется в процессе электролиза;
г) не расходуется в процессе электролиза.
9. Процесс на катоде при электролизе растворов солей зависит от:
а) природы катода;
б) активности металла;
в) состава аниона;
г) не зависит от перечисленных факторов.
10. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить:
а) выделение диоксида азота;
б) выделение монооксида азота;
в) растворение анода;
г) выделение кислорода.
Ключ к тесту
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
б |
а |
в |
б |
в, г |
а |
б |
а, г |
б |
в |
Задачи на электролиз
Уровень А
1. При
электролизе раствора хлорида меди(II)
на аноде выделилось 560 мл газа (н.у.).
Найти массу меди, выделившейся на катоде.
Ответ. 1,6 г.
2. При электролизе расплава хлорида натрия массой 70,2 г получен хлор, занимающий при н.у. объем 10,08 л. Найти долю выхода хлора.
Ответ. 75%.
3. При электролизе 149 г 20%-го раствора хлорида калия получен гидроксид калия массой 20,16 г. Найти долю выхода продукта реакции.
Решение

Ответ. 90%.
4. При электролизе водного раствора хлорида калия выделилось 7,2 л водорода (н.у.). Найти массу и количество вещества гидроксида калия, образовавшегося в результате электролиза.
Ответ. 36 г и 0,64 моль.
5. Какие вещества и в каких количествах образуются при электролизе 234 г расплава хлорида натрия? Какая масса железа может вступить в реакцию с веществом, выделившимся на аноде?
Ответ. 4 моль Na и 2 моль Cl2; 74,7 г Fe.
6. Ток одной и той же силы пропущен в течение одинакового времени через растворы нитрата серебра и сульфата меди. В результате выделилось 0,64 г меди. Найти массу выделившегося серебра.
Ответ. 2,16 г.
7. При электролизе раствора, содержащего 2,22 г соли двухвалентного металла, на аноде выделилось 0,448 л хлора (н.у.). Определить, какая соль была подвергнута электролизу. Написать уравнение реакции электролиза.
Ответ. Хлорид кальция.
![]()
8. Ток силой 6 А пропустили через водный раствор серной кислоты в течение 1,5 ч. Вычислить массу разложившейся воды и объем выделившихся газов (н.у.).
Ответ. 3,02 г Н2О; 3,76 л Н2 и 1,88 л О2.
9. Сколько времени потребуется для разложения 2 моль воды током силой 2 А?
Ответ. 53,6 ч.
10. Найти объем кислорода (н.у.), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор гидроксида калия.
Ответ. 627 мл.
11. При электролизе водного раствора сульфата хрома(III) током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз?
Ответ. 6,18 ч.
12. Через расплав оксида алюминия пропускали постоянный ток силой 16 А в течение 3 ч. Вычислить массу алюминия, выделившегося на катоде.
Ответ. 16,1 г.
Уровень Б
1. При пропускании тока силой 2,5 А через раствор электролита за 30 мин выделилось 2,77 г металла. Определить металл.
Ответ. Олово.
2. При пропускании через раствор соли некоторого металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Определить металл.
Ответ. Индий.
3. Через 300 г 10%-го раствора хлорида натрия пропустили ток. Спустя некоторое время ток выключили. Объем газа, выделившегося на аноде, при давлении 1 атм и температуре 27 °С равен 1 л. Найти массовые доли веществ, находящихся в растворе после выключения тока, если доля выхода продуктов электролиза составляет 91% от теоретически возможного.
Ответ. 8,36% NaCl и 1,2% NaOH.
4. Газ, выделившийся на аноде при электролизе 200 г 20%-го раствора хлорида натрия, пропустили через 400 г 30%-го раствора бромида калия. К полученному раствору добавили избыток раствора нитрата серебра. Определить количественный состав выпавшего осадка.
Ответ. 59,4 г AgBr и 98,15 г AgCl.
5. Через 800 г 10%-го водного раствора хлорида натрия пропустили ток. После окончания процесса электролиза соли весь выделившийся на аноде газ поглотили горячим раствором, получившимся в результате электролиза. Найти массовые доли веществ, содержащихся в растворе после поглощения газа.
Ответ. 8,35% NaCl и 3,03% NaClO3.
6. Через 50 г 10%-го раствора сульфата натрия некоторое время пропускали ток. Когда процесс прервали, объем выделившегося на аноде газа составил 10 л (давление 1 атм, температура 20 °С). Найти массовую долю сульфата натрия в растворе после прекращения электролиза.
Ответ. 14,28%.
7. Некоторое количество нитрида натрия обработали избытком воды и получили газ А. Оставшееся в растворе вещество выделили и при электролизе в расплаве получили газ В на аноде. Смесь А и В пропустили над нагретой платиной, и газы вступили в реакцию без остатка. Найти долю выхода вещества А, если выход газа В можно считать количественным.
Ответ. ![]() (NH3)
= 60%.
(NH3)
= 60%.
8. При электролизе расплава 8 г соединения одновалентного металла на аноде выделилось 11,2 л водорода (н.у.). Определить соединение. Можно ли подвергнуть электролизу его водный раствор?
Решение
Водород на аноде может выделяться только при электролизе расплавов гидридов металлов МН:
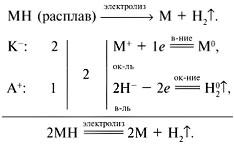
![]() (H2)
= V(H2)/VM =
11,2/22,4 = 0,5 моль,
(H2)
= V(H2)/VM =
11,2/22,4 = 0,5 моль,
![]() (МH)
= 2
(МH)
= 2![]() (H2)
= 1 моль,
(H2)
= 1 моль,
M(MH)
= m(MH)/![]() (MH)
= 8/1 = 8 г/моль.
(MH)
= 8/1 = 8 г/моль.
Искомый гидрид – LiH.
Подвергнуть электролизу водный раствор LiH невозможно, т.к. он разлагается водой:
LiH
+ H2O
= LiOH + H2![]() .
.
Ответ. LiH.
9. Водный раствор каустической соды подвергали электролизу током 10 А в течение 268 ч. После окончания электролиза осталось 100 г 24%-го раствора гидроксида натрия. Найти первоначальную концентрацию раствора.
Ответ. 2,4%.
10. При пропускании постоянного тока силой 6,4 А в течение 30 мин через расплав хлорида неизвестного металла на катоде выделилось 1,07 г металла. Определить состав соли, подвергшейся электролизу.
Ответ. Хлорид алюминия.
