Пособие-репетитор по химии
ЗАНЯТИЕ 19 10-й класс (первый год обучения)
Общая характеристика металлов. Электрохимический ряд напряжений металлов
П л а н
1.
Деление химических элементов на металлы
и неметаллы.
2. Особенности строения атомов металлов.
3. Общие физические свойства металлов.
4. Общие химические свойства металлов.
5. Электрохимический ряд напряжений металлов.
6. Общие методы получения металлов.
Все химические элементы и образуемые ими простые вещества можно разделить на металлы и неметаллы. К металлам относятся все s-элементы (кроме водорода и гелия), d-элементы и f-элементы. Среди p-элементов есть как металлы, так и неметаллы, число элементов-металлов увеличивается с увеличением номера периода. Деление элементов на металлы и неметаллы объясняется различием в строении их атомов.
Атомы большинства металлов на внешнем электронном уровне имеют от 1 до 3 электронов. Исключения составляют атомы германия, олова, свинца (4е), сурьмы и висмута (5е), полония (6е).
Атомы металлов имеют меньший заряд ядра и больший радиус по сравнению с атомами неметаллов данного периода. Таким образом, атомы металлов легко отдают валентные электроны, превращаясь в положительно заряженные ионы.
Ф и з и ч е с к и е с в о й с т в а
Простые вещества-металлы при обычных условиях являются твердыми кристаллическими веществами (кроме ртути). Кристаллическая решетка металлов образуется за счет металлической связи.
Самые мягкие металлы – калий и натрий, самый твердый – хром. Для всех металлов характерны металлический блеск и непрозрачность, тепло- и электропроводность, пластичность, упругость и прочность; они способны изменять свою форму, не разрушаясь.
Температуры плавления и плотности металлов изменяются в широких пределах. Самый легкоплавкий металл – ртуть, самый тугоплавкий – вольфрам; самый легкий металл – литий, самый тяжелый – осмий.
По способности к намагничиванию все металлы можно разделить на три группы. Ферромагнитные металлы способны намагничиваться даже под действием слабых магнитных полей (железо, кобальт, никель). Парамагнитные металлы проявляют слабую способность к намагничиванию (алюминий, хром, титан). Диамагнитные металлы не притягиваются к магниту, даже слегка отталкиваются от него (олово, медь, висмут).
Х и м и ч е с к и е с в о й с т в а
Все металлы характеризуются небольшой величиной энергии ионизации (энергии, необходимой для отрыва электрона от атома и превращения его в катион). Атомы металлов легко отдают валентные электроны, но не могут их присоединять. Поэтому в реакциях металлы являются только восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов неодинакова: в периодах слева направо она уменьшается, а в главных подгруппах сверху вниз – увеличивается. Восстановительная активность металла в химических реакциях, протекающих в водных растворах различных веществ, характеризуется положением металла в электрохимическом ряду напряжений (ряд стандартных электродных потенциалов).
Уравнения реакций металлов
H2 (+/–)*:
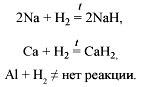
О2 (+/–):
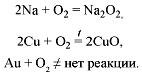
Другие неметаллы (+/–):
![]()

Н2О (+/–):

Основные оксиды (–/+):

Основания (–/+):
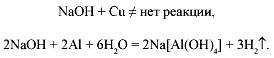
Кислоты (+/–):
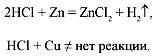
Соли (+/–):
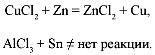
Э л е к т р о х и м и ч е с к и й р я д н а п р я ж е н и й м е т а л л о в
(ряд стандартных электродных потенциалов)
При погружении металлической пластины (электрода) в раствор соли данного металла может происходить один из двух процессов:
1. Если металл является активным восстановителем (т.е. легко теряет электроны), то под действием диполей воды некоторая часть атомов металла оставляет свои электроны на электроде и переходит в раствор в виде катионов:
M0 = Mn+ + ne.
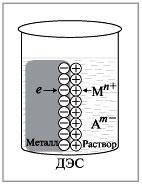
В результате этого процесса окисления металлическая пластина заряжается отрицательно. Катионы металла притягиваются к ней, и поэтому прилегающий к пластине слой раствора заряжается положительно. Таким образом, на границе металл–раствор возникает двойной электрический слой(ДЭС) (рис. 1).
|
|
|
Рис. 1. Образование двойного электрического слоя на границе металл–раствор соли MmAn в результате перехода ионов металла в раствор |
2. Если сам металл является слабым восстановителем, то его ионы, содержащиеся в растворе соли, являются сильными окислителями. Некоторая часть этих ионов подходит к поверхности металлической пластины и восстанавливается за счет имеющихся в ней свободных электронов:
Mn+ + ne = M0.
В результате осаждения катионов пластина металла заряжается положительно и притягивает к себе отрицательно заряженные анионы соли, находящиеся в растворе. Прилегающий к пластине слой раствора заряжается отрицательно, и в этом случае также возникает ДЭС (рис. 2).
|
|
|
Рис. 2. Образование двойного электрического слоя на границе металл–раствор соли MmAn в результате перехода ионов металла из раствора |
Разность потенциалов, возникающая в двойном электрическом слое на границе металл–раствор, называется электродным потенциалом.
Непосредственно измерить потенциал отдельного металла невозможно, поэтому электродные потенциалы измеряют относительно стандартного водородного электрода, потенциал которого принимают равным нулю. Потенциал каждого электрода (металла) зависит от природы металла, концентрации его ионов в растворе, температуры.
Разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом при стандартных условиях называетсястандартным электродным потенциалом металла (Е°).
Металлы, расположенные в порядке возрастания значения их стандартного электродного потенциала, составляют электрохимический ряд напряжений.
Необходимо отметить, что положение металлов в электрохимическом ряду напряжений не вполне соответствует их положению в периодической системе. Это объясняется тем, что при измерении электродных потенциалов учитывается не только энергия ионизации, но и энергия, которая затрачивается на разрушение кристаллической решетки, а также энергия, выделяющаяся при гидратации ионов. Так, натрий является более активным металлом, чем литий, но в водных растворах литий проявляет большую восстановительную активность.
Электродные потенциалы щелочных и щелочно-земельных металлов рассчитываются теоретически, т.к. в водных растворах эти металлы взаимодействуют с водой. Значение электродного потенциала количественно характеризует восстановительные свойства металла, т.е. его химическую активность. Слева направо в ряду напряжений восстановительная активность металлов в водных растворах уменьшается, а окислительная способность катионов увеличивается. На основании ряда напряжений можно сделать выводы о химической активности металлов.
• Каждый металл вытесняет из солей другие металлы, имеющие большие значения Е°, т.е. являющиеся менее сильными восстановителями.
• Металлы, имеющие отрицательные значения Е°, способны вытеснять водород из кислот.
• Металлы, имеющие очень низкие значения Е°, т.е. являющиеся сильными восстановителями (с лития по натрий), в любых водных растворах взаимодействуют прежде всего с водой.
Эти правила имеют ряд исключений.
• Алюминий и магний часто не могут вытеснять менее активные металлы из-за наличия на их поверхности защитной пленки оксида. Если же эту пленку разрушить, то металлы начинают реагировать с водой.
• Для вытеснения металлов не используют молекулярный водород (водородный электрод работает только в присутствии платины).
• Свинец не вытесняет водород из растворов соляной и серной кислот, т.к. на поверхности металла образуется пленка малорастворимых хлорида и сульфата, пассивирующих дальнейшую реакцию.
Большинство металлов встречается в природе в виде различных соединений, только наименее активные металлы встречаются в природе в самородном, свободном состоянии. Получить металлы из соединений можно, применяя различные металлургические процессы, причем любой из них сводится к восстановлению ионов металла с помощью восстановителей. В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию.
Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей (C, CO, H2, Al, Mg и др.). Частным случаем пирометаллургии является алюмотермия. Например:
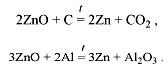
Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид) растворяют в кислоте, в результате чего получают соль металла. Затем из полученного раствора необходимый металл вытесняют более активным металлом. Например:
CuO + H2SO4 = CuSO4 + H2O,
CuSO4 + Zn = ZnSO4 + Cu.
Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при этом играет электрический ток. Например: