
Научные стремления 2012-1
.pdf
пористости ASAP2020 МР (Micromeritics, USA). Удельную поверхность
рассчитывали по методу БЭТ [8].
Химический состав образцов катализатора определяли с помощью рентгенофлуоресцентного анализа (cистема химического анализа JED 2201).
Качественный и количественный состав изомеризата определяли
методом газовой хроматографии (хроматограф Хромос ГХ-1000) на капиллярной колонке 50 м х 0,65 мм (неподвижная фаза Сarbowax 20M.) Температура в испарителе и детекторе составляла 180°С, нагрев колонки осуществляли от 60 до 100°С со скоростью 5°С/мин.
Для корректного сравнения активностей исследуемых катализаторов, различающихся концентрацией образца в реакционной смеси (0,5–5 мас. %) и величиной удельной поверхности (таблица 1), количества образующихся в реакции камфена и дипентена выражали как моль/г катализатора/Sуд, что соответственно – моль/м2 [9].
Результаты исследования и их обсуждение. С целью определения оптимальных параметров процесса изомеризации скипидара (температура реакции, количество катализатора) на природном глауконите реакцию проводили при температурах 130–150ºС и концентрациях катализатора 1,0–5,0 мас. %. Установлено, что процесс изомеризации на исходном глауконите осуществляется с превращением только α-пинена. В присутствии 3 мас. % катализатора при 150°С за 5 ч опыта конверсия α-пинена достигает 85 %, накопление в изомеризате целевых продуктов – камфена и дипентена – составляет 1,2 и 1,1 ммоль/м2 соответственно.
Для определения оптимального количества модификатора образцы глауконита обрабатывали 25–50–100–175 мл/г 10 % HCl. Максимальная конверсия α-пинена (~95 %) достигается на глауконите, обработанном 50 мл/г 10% HCl за 5 ч опыта (температура реакции 140°С, количество катализатора 1,0 мас. %), при этом концентрация 3-карена снижается от 33,0 до ~25,0 мас. %, накопление камфена и дипентена в смеси составляет 2,6 и 1,6 ммоль/м2 соответственно.
Для сравнительной оценки активностей алюмосиликатных катализаторов в реакции изомеризации скипидара провели процесс на глауконите, активированном 50 мл/г 10 % HCl, Al-Si РБ, модифицированном 50 мл/г 10 % HCl и промышленном АС-36.
Таблица 1 –Химический состав и удельная поверхность исследованных катализаторов
Катализатор |
|
|
Содержание компонентов, мас. % |
|
|
Sуд, |
||||
|
|
|
|
|
|
|
|
|
м2/г |
|
Al2O3 |
SiO2 |
|
FeO |
Na2O |
MgO |
K2O |
CaO |
TiO2 |
||
|
|
|
||||||||
Глауконит |
|
|
|
|
|
|
|
|
|
|
- исходный |
11,19 |
58,86 |
|
19,4 |
- |
3,55 |
5,67 |
- |
1,34 |
29,0 |
|
|
|
|
|
|
|
|
|
|
|
211
- обработанный |
|
|
|
|
|
|
|
|
|
10% HCl (мл/г) |
|
|
|
|
|
|
|
|
|
- 25 |
11,82 |
56,82 |
22,28 |
- |
3,24 |
5,32 |
- |
0,51 |
58,0 |
- 50 |
11,79 |
58,32 |
20,99 |
- |
3,59 |
4,92 |
- |
0,39 |
54,0 |
- 100 |
10,94 |
58,75 |
21,24 |
- |
3,25 |
5,8 |
- |
0,01 |
57,0 |
- 175 |
11,28 |
58,11 |
21,36 |
- |
3,35 |
5,55 |
- |
0,35 |
58,0 |
|
|
|
|
|
|
|
|
|
|
Al-Si РБ, |
|
|
|
|
|
|
|
|
|
активированный |
20,4 |
64,6 |
5,6 |
0,7 |
1,5 |
5,2 |
0,9 |
1,1 |
72,0 |
50 мл/г10% HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АС-36 |
11,6 |
86,1 |
0,2 |
0,3 |
|
1,8 |
|
|
297, |
|
|
|
0 |
||||||
|
|
|
|
|
|
|
|
|
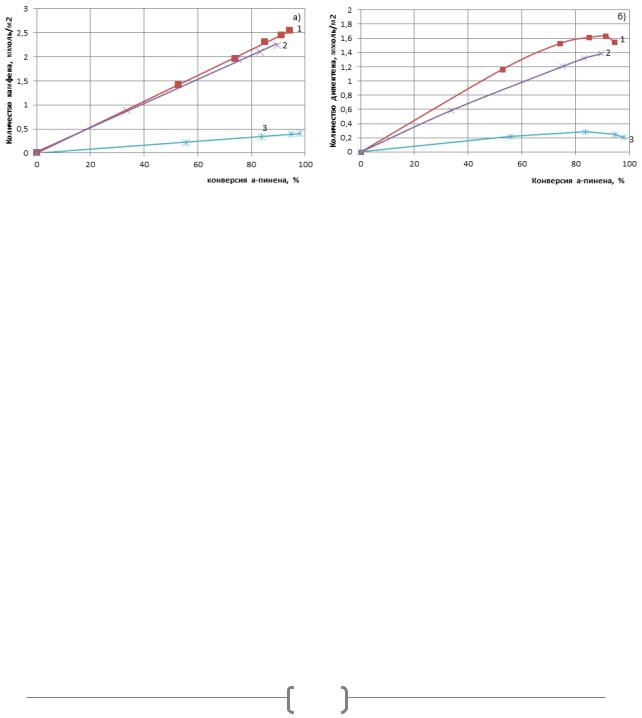
Рисунок 1. Зависимость количества камфена (а) и дипентена (б) (ммоль/м2) от конверсии α-пинена на различных катализаторах:1 – глауконит, активированный 50 мл/г 10% HCl; 2
– Al-Si РБ, модифицированный 50 мл/г 10% HCl; 3 – АС-36
При конверсии α-пинена 80% наибольшие количества камфена и дипентена (2,2 и 1,6 ммоль/м2 соответственно) образуются на глауконите, активированном 50 мл/г 10% HCl. Несколько меньшие (2,0 и 1,3 ммоль/м2) – в присутствии Al-Si РБ, модифицированного 50 мл/г 10% HCl. Минимальную активность проявил промышленный катализатор АС-36 (количества камфена и дипентена 0,3 ммоль/м2).
Выводы. Оптимальными условиями процесса изомеризации скипидара на природном глауконите являются температура 150°С, концентрация катализатора 3,0 мас. %, время опыта 5 ч. При этом накопление камфена и дипентена в изомеризате составляет 1,2 и 1,1 ммоль/м2 соответственно при конверсии α-пинена ~85 %. В этих условиях 3-карен в реакцию не вступает.
Наибольшую активность проявил глауконит, обработанный 50 мл/г 10 % HCl. При температуре 140°С и концентрации катализатора 1,0 мас. % за 5 ч реакции конверсия α-пинена достигает ~94 %, накопление камфена и дипентена в изомеризате составляет 2,6 и 1,6 ммоль/м2 соответственно, концентрация 3-карена снижается с 33,0 до 25,0 мас. %. В этих условиях при одинаковой конверсии α-пинена (80 %) количества образовавшихся камфена и
212

дипентена в изомеризате на данном катализаторе в 7 и 5 раз соответственно выше, чем на АС-36.
Показана возможность использования отечественного глауконитового катализатора в процессе изомеризации скипидара для получения камфена и дипентена.
Литературные источники
1.Ковернинский И.Н., Комаров В.И., Третьяков С.И. и др. Комплексная химическая переработка древесины. Архангельск: Изд-во Арханг. гос. техн. ун-та, 2002. С. 242–245.
2.Шулов Л.М., Хейфиц Л.А. Душистые вещества и полупродукты парфюмернокосметического производства. М.: Агропромиздат, 1990. – 208 с.
3.Ильина И.И., Максимчук Н.В., Семиколенов В.А. // Российский химический журнал, 2004, XLVIII, №3. С. 39.
4.V.E. Agabekov, G.M. Sen’kov, A.Yu. Sidorenko, Nguyen Dinh Tuyenb, Vu Anh Tuanb // Catalysis in Industry, 2011, Vol. 3, No. 4, pp. 319–330.
5.Рудаков,Г.А. Химия и технология камфары. М.: Лесная промышленность, 1976. –
234 с.
6.Сеньков Г.М., Агабеков В.Е., Сидоренко А.Ю., Жаврид А.С. Способ получения камфена. Пат.15142 (РБ). 2011.
7.Рудин М.Г., Драбкин А.Е. Краткий справочник нефтепереработчика. Л.: 1980. –
с.322.
8.Карнаухов А. П. Адсорбция. Текстура дисперсных и пористых материалов. Новосибирск: Наука, 1999. – 470 с.
9.Comelli N.A., Ponzi E.N., Ponzi M.I. // Chem. Engn. J., 2006, Vol.117, No 2. P.93.
Utenkova D.B., Sidorenko A.Ju.
TURPENTINE ISOMERIZATION OVER GLAUCONITE
Institute of Chemistry of New Materials
of the National Academy of Sciences of Belarus
Summary
The process of isomerization of turpentine (main ingredients were α-pinene and 3-carene) over domestic glauconite was studied by the methods of a gas chromatography, XRF, N2- adsorbtion. Over initial glauconite optimal reaction temperature, catalyst concentration and reaction time were 150°C, 3 wt. % and 5 h respectively. At this conditions 1,2 mmol/m2 of camphene and 1,1 mmol/m2 of dipentene were founded (α-pinene conversion was ~85 %, 3- carene wasn‘t react). Activity of glauconite was increased after treatment of catalyst by 50 ml/g of 10 % HCl. Over that at the same reaction time α-pinene conversion was ~85 %, 2,6 mmol/m2 of camphene and 1,6 mmol/m2 of dipentene were founded, 3-carene concentration was decreased from 33,0 to 25,0 wt. %.
213
СЕРИЯ «БИОЛОГИЧЕСКИЕ НАУКИ»
УДК 579.66.083.1.088.1:620.193.8
Антоновская Л.И., Белясова Н.А.
СПОСОБНОСТЬ БАКТЕРИОСТОЙКИХ МАТЕРИАЛОВ И ИЗДЕЛИЙ С БИОЦИДНЫМИ ДОБАВКАМИ ПРОТИВОСТОЯТЬ БИООБРАСТАНИЮ
Белорусский государственный технологический университет, Минск
Введение. Для оценки степени бактериостойкости материалов и изделий c биоцидными добавками известен ряд стандартных методов [1–3], среди которых только один [1] позволяет на основании количественных параметров дифференцировать материалы на бактериостойкие и небактериостойкие. В частности, в Японском промышленном стандарте (JIS Z 28001) оценку бактериостойкости материалов с гладкой поверхностью осуществляют с помощью параметра антимикробной активности (R), который определяется как логарифм уменьшения числа жизнеспособных клеток при ингибировании на биозащищеном образце. Материал признается бактериостойким, если параметр R ≥ 2. Ранее нами разработаны и стандартизированы два количественных метода для оценки антимикробных свойств пористых материалов со сложной геометрией поверхности: адсорбционнно-титриметрический [4], позволяющий дифференцировать образцы на бактериостойкие и небактериостойкие с помощью параметра DS , чье пограничное значение составляет 0,45, и анаэробно-суспензионный [5], в котором используется относительный количественны параметр с пограничным значением 0,68.
В литературе не встречаются данные, позволяющие сопоставить степень бактериостойкости материалов и изделий с их способностью противостоять биообрастаниям.
Цель данной работы заключалась в сопоставительной оценке степени бактериостойкости материалов и изделий, испытанных с помощью адсорбционнно-титриметрического и анаэробно-суспензионного методов, со степенью их биозащищенности.
Материалы и методы исследования. Объектами исследования служили разработанные в ГНУ «ИХНМ НАН Беларуси» изделия – половолоконные ультрафильтрационные мембранные элементы (ПВУМ), а также разработанные в ГНУ «ИОНХ НАН Беларуси» материалы – коррозионностойкие полимерные композиции (КПК), модифицированные различными биоцидными добавками.
Оценку степени бактериостойкости образцов ПВУМ осуществляли с помощью адсорбционнно-титриметрического метода [4]. Оценку степени бактериостойкости образцов КПК осуществляли с помощью анаэробносуспензионного метода [5].
214

Идентификацию выделенных из состава биообрастаний ПВУМ бактерий осуществляли с помощью секвенирования ДНК-фрагментов генов 16S рРНК.
Для исследования биообрастаний на поверхности образцов использовали сканирующую электронную микроскопию (СЭМ) на микроскопе JSM-5610 LV (JEOL, Япония), а также микроскопию в отраженном свете с помощью светового микроскопа Биолам М-1.
Результаты исследования и их обсуждение. В таблицах 1 и 2
приведены результаты анализа антибактериальных свойств нескольких образцов ПВУМ и КПК с помощью разработанных методов, а также результаты дифференцировки этих материалов на бактериостойкие и небактериостойкие с помощью относительных количественных параметров.
Таблица 1 – Антибактериальные свойства образцов ПВУМ в адсорбционнотитриметрическом методе с использованием тест-бактерий Lactococcus lactis ssp. lactis БИМ В-426
|
|
DS , |
|
|
|
|
|
Образец |
Концентрация накопившейся |
|
DS , |
Оценка бактериостойкости |
|||
молочной кислоты, моль/см3 |
отн. ед. |
|
отн. ед. |
образца изделия |
|||
ПВУМ- |
3,63 |
0,34 |
|
|
|
|
|
3,74 |
0,32 |
0,33±0,02 |
Небактериостойкий |
||||
1 |
|||||||
3,74 |
0,32 |
|
|
|
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
ПВУМ- |
1,51 |
0,72 |
|
|
|
|
|
1,62 |
0,70 |
0,70±0,04 |
Бактериостойкий |
||||
2 |
|||||||
1,73 |
0,68 |
|
|
|
|
||
|
|
|
|
|
|||
ПВУМ- |
4,64 |
0,15 |
|
|
|
|
|
4,58 |
0,16 |
0,15±0,03 |
Небактериостойкий |
||||
4 |
|||||||
4,75 |
0,13 |
|
|
|
|
||
|
|
|
|
|
|||
ПВУМ- |
4,86 |
0,11 |
|
|
|
|
|
4,81 |
0,12 |
0,11±0,01 |
Небактериостойкий |
||||
6 |
|||||||
4,86 |
0,11 |
|
|
|
|
||
|
|
|
|
|
|||
ПВУМ- |
1,17 |
0,79 |
|
|
|
|
|
1,29 |
0,76 |
0,78±0,01 |
Бактериостойкий |
||||
9 |
|||||||
1,12 |
0,80 |
|
|
|
|
||
|
|
|
|
|
|||
Примечания – средняя концентрация молочной кислоты (по результатам трех измерений) в культуральной жидкости с образцом, не содержащим биоцидную добавку (ПВУМ-К) составила 5,48 моль/см3.
Таблица 2 – Степень бактериостойкости образцов КПК в анаэробно-суспензионном методе с использованием тест-бактерий Desulfovibrio sp. LSL-1
|
Концентрация |
|
|
|
|
|
Оценка бактериостойкости |
Образец |
сероводорода, |
АH S |
, отн.ед. |
|
AH S ±δ, отн.ед |
||
|
образца материала |
||||||
|
мг/дм3 |
2 |
|
|
2 |
||
|
|
|
|
|
|
|
|
|
2,52 |
|
0,25 |
|
|
|
|
КПК-21 |
2,43 |
|
0,27 |
|
0,26±0,02 |
Небактериостойкий |
|
|
2,48 |
|
0,26 |
|
|
|
|
|
2,97 |
|
0,11 |
|
|
|
|
КПК-36 |
3,06 |
|
0,09 |
|
0,10±0,02 |
Небактериостойкий |
|
|
3,01 |
|
0,10 |
|
|
|
|
|
0,25 |
|
0,93 |
|
|
|
|
КПК-33 |
0,20 |
|
0,94 |
|
0,93±0,03 |
Бактериостойкий |
|
|
0,31 |
|
0,91 |
|
|
|
|
КПК-26 |
0,92 |
|
0,73 |
|
0,75±0,03 |
Бактериостойкий |
|
215

|
0,85 |
0,75 |
|
|
|
0,81 |
0,76 |
|
|
|
2,18 |
0,35 |
|
|
КПК-31 |
2,13 |
0,36 |
0,35±0,02 |
Небактериостойкий |
|
2,22 |
0,34 |
|
|
Примечание – средняя (по результатам трех измерений) концентрация сероводорода в контрольной пробе культуральной жидкости составила 3,35±0,12 мг/дм3
Как следует из приведенных данных, антибактериальные свойства испытанных образцов колеблются в широком диапазоне, о чем свидетельствуют показатели изменения уровня метаболической активности (концентрации конечных продуктов метаболизма молочнокислых бактерий – молочной кислоты и сульфатредуцирующих бактерий – сероводорода), а также количественные параметры бактериостойкости DS и AH2S . Наилучшими
антибактериальными свойствами характеризуется образец ПВУМ-9 ( DS =0,78) и образец КПК-33 ( AH2S =0,93), наихудшими – ПВУМ-К (не содержит биоцидных добавок) и КПК-36, которые использованы для определения способности бактериостойких материалов противостоять биообрастаню.
Чтобы обеспечить возможность ускоренного обрастания материалов и изделий бактериальным матриксом, из состава биообрастаний ПВУМ после их эксплуатации в системе очистки водопроводной воды были выделены, охарактеризованы и идентифицированы доминирующие в составе слизистого матрикса бактерии. Ими оказались: Bacillus cereus В-1, Klebsiella oxytoca Е-1, Aeromonas hydrophila Р-В, Pseudomonas aeruginosa Р-С. Выделенные бактерии отличаются способностью формировать капсулы или слизистые слои на поверхности клеточной стенки, что способствует закреплению клеток на субстрате и приобретению устойчивости к неблагоприятным условиям окружающей среды. Большинство представителей относится к облигатным аэробам и олиготрофам.
Для определения устойчивости образцов КПК к биообрастаниям использовали сульфатредуцирующих бактерий (СРБ), выделенных из промывных вод оборудования ОАО «Мозырьский нефтеперерабатывающий завод». Эти облигатно-анаэробные бактерии осуществляют специфический способ запасания энергии – «сульфатное» дыхание, сопровождающееся диссимиляционным восстановлением сульфатов с образованием сероводорода и сульфидов. На основании морфологических и биохимических признаков эти бактерии отнесены к роду Desulfovibrio.
Бактериостойкие (ПВУМ-9, КПК-33) и небактериостойкие (ПВУМ-К, КПК-36) образцы материалов и изделий инкубировали в условиях, благоприятствующих процессам биообрастаний: образцы ПВУМ в инокулированном бактериями Bacillus cereus В-1, Klebsiella oxytoca Е-1, Aeromonas hydrophila Р-В, Pseudomonas aeruginosa Р-С питательном бульоне при 30ºС в условиях аэрации, образцы КПК – в инокулированной бактериями Desulfovibrio среде Ван-Дельдена в строго анаэробных условиях при 30ºС. Длительность испытания составила 2 месяца.
216

Аккуратно промытые и высушенные образцы материалов и изделий подвергали микроскопированию. На рисунках 1 и 2 приведены микрофотографии поверхностей образцов, на которых заметно, что поверхности небактериостойких образцов материалов и изделий за два месяца испытаний покрылись довольно развитым слоем биообрастаний (КПК-36, ПВУМ-К (b)), в то время как на поверхности бактериостойких образцов такого развитого бактериального матрикса не наблюдалось (КПК-33, ПВУМ-9 (b)).
ПВУМ-9 (а) |
ПВУМ-К (а) |
ПВУМ-9 (b) |
ПВУМ-К (b) |
Рисунок 1. Микрофотографии поверхностей образцов ПВУМ (×50), до (a) и после (b) инкубирования с бактериями биообрастаний
КПК-33 КПК-36
Рисунок 2. Микрофотографии поверхностей образцов КПК (×100) после инкубирования с сульфатредуцирующими бактериями
Вывод. С помощью разработанной биотехнологической системы анализа установлена корреляция между степенью бактериостойкости образцов полимерных материалов и изделий, дифференцированных с помощью относительных количественных параметров DS и на бактериостойкие и небактериостойкие и способностью этих образцов материалов и изделий противостоять биообрастанию.
217

Литературные источники
1.Противомикробные изделия – Тест на противомикробную активность и эффективность: Японский промышленный стандарт JIS Z 28001. – Введ. 20.12.2000. – Токио: Японская ассоциация стандартов, 2001. – 15 с.
2.Пластмассы. Оценка воздействия микроорганизмов: ISO 846: 1997. – Введ.
15.06.97/ Технический комитет ИСО/ТК 61 «Пластмассы», 1997. – 42 с.
3.Единая система защиты от коррозии и старения. Жидкости смазочноохлаждающие. Методы испытаний на биостойкость: ГОСТ 9.085–78. − Введ. 01.02.79. – М.: Издательство стандартов. Государственный комитет СССР по стандартам. Государственный стандарт Союза ССР, 1979. – 10 с.
4.Антоновская, Л.И. Оригинальный метод, позволяющий количественно оценить антибактериальные свойства изделий со сложным характером поверхности и материалов, прочно удерживающих биоцидные добавки / Л.И. Антоновская, Н.А. Белясова // Биотехнология: состояние и перспективы развития: матер. VI Московского междунар. конгресса, Москва, 21–25 марта 2011 г. / ЗАО «Экспо-биохим-технологии», РХТУ им. Д.И. Менделеева. – Ч. 2. – Москва, 2011. – С. 32–33.
5.Разработка относительного количественного параметра степени бактериостойкости материалов / Л.И. Антоновская, Н.А. Белясова, И.П. Рокало // Молодежь в науке – 2011: прил. к журн. «Весцi нацыянальнай акадэмii навук Беларусi».– Ч. 3. – 2012. – С. 17–22.
Antanouskaya L.I., Belyasova N.A.
ABILITY OF BACTERIAE-RSISTENT MATERIALS AND PRODUCTS WITH BIOCIDAL ADDITIVES TO RESIST BIOFOULING
Belarusian State Technological University, Minsk
Summary
It is proved that the samples of materials which were accepted bacteriae-persistent in an adsorption-titrimetric and anaerobic-suspension methods, are characterized by resistance to biofouling at an incubation in bacterial suspensions in optimal for growth of bacteria conditions.
218

УДК 582.71.734:633.88+581.19
Башилов А.В.
ФОТОСЕНСИБИЛИЗИРУЮЩАЯ ХЕМИЛЮМИНЕСЦЕНЦИЯ В ОПРЕДЕЛЕНИИ ИНТЕГРАЛЬНОЙ АНТИОКСИДАНТНОЙ АКТИВНОСТИ РАСТИТЕЛЬНОГО СЫРЬЯ
Центральный ботанический сад НАН Беларуси, Минск
Введение. В настоящее время существует большое количество методов определения антиоксидантной активности (далее – АОА), различающихся по типу источника окисления, окисляемому субстрату и способу детектирования продуктов окисления [1]. Одним из современных методов интегральной оценки АОА является фотосенсибилизирующая хемилюминесценция (далее – PCL) лежащая в основе работы анализатора АОА «Photochem®». Анализатор предназначен для количественной оценки АОА гидрофильных и гидрофобных фракций. Для PCL-метода характерна высокая чувствительность, короткое время измерений, а также высокая воспроизводимость результатов.
Цель исследования: определить PCL-методом интегральную АОА галеновых препаратов Filipendula ulmaria (L.) Maxim., Pentaphylloides fruticosa
(L.) O. Schwarz и Mentha piperita L. Выбор объектов исследования обусловлен использованием представленного растительного сырья в разработке рецептур фитокомпозиций антиоксидантного действия [2, 3].
Материалы и методы исследования.
Объекты исследования: соцветия и трава Filipendula ulmaria (L.) Maxim.
(таволга вязолистная), трава Pentaphylloides fruticosa (L.) O. Schwarz
(пятилистник кустарниковый); трава Mentha piperita L. (мята перечная). Растения культивировались в коллекции пряно-ароматических и лекарственных растений Центрального ботанического сада НАН Беларуси.
Определение интегральной АОА проводили на анализаторе «Photochem®»
(«Analytik Jena», Германия, 2007 г.).
Определение АОА гидрофильной фракции (далее – ACW). 1 г измельченного растительного сырья заливали 100 мл дистиллированной воды комнатной температуры и настаивали на кипящей водяной бане в течение 15 мин. После этого вытяжку охлаждали при комнатной температуре и фильтровали. Полученный экстракт хранили в темном месте при 4оС. При определении ACW использовали стандартизованные тестовые наборы.
Определение АОА липофильной фракции (далее – ACL). 1 г измельченного растительного сырья заливали 100 мл метанола и настаивали в течение 24 часов. Полученный экстракт фильтровали. Хранили в темном месте при 4оС. При определении ACL использовали стандартизованные тестовые наборы.
Калибровку и измерения проводили в соответствии со стандартными протоколами, установленными производителем. Результаты рассчитывали по уравнению:
ACW/ACL = nbV1 / V2m
219

где ACW/ACL – интегральная антиоксидантная активность гидрофильных/липофильных фракций в эквивалентах аскорбиновой кислоты или тролокса соответственно, нмоль/мг воздушно-сухого растительного сырья;
n – количество вещества, моль;
b – разбавление полученного экстракта, раз; V1 – объем экстрагента, мл;
V2 – объем пробы, взятой для анализа, мл;
m – масса воздушно-сухого растительного сырья, взятого для приготовления экстракта, кг.
Расчеты проводили с использованием программного обеспечения
«PCLsoft® control».
Результаты исследования и их обсуждение. При воздействии ультрафиолетового излучения на реакционную среду фотосенсибилизатор, в нашем случае это люминол (5-амино-2,3-дигидро-1,4-фталазиндион), переходил в возбужденное состояние с последующим взаимодействием с
молекулярным кислородом образуя супероксид-анион радикалы:
L + h (UV) + O2 [L*O2] L + + O2 -
где L – люминол;
h (UV) – квант ультрафиолетового излучения; L* – люминол в возбужденном состоянии;
L + – катион-радикал люминола;
O2 - – супероксид-анион радикал.
Затем часть супероксид-анион радикалов вступала во взаимодействие с молекулами антиоксидантов с образованием малоактивных радикалов. Оставшиеся супероксид-анион радикалы вступали в индикаторную реакцию с
ранее образованными катион-радикалами люминола:
L + + O2 - L + h + O2
Реакция происходила с выбросом кванта энергии. По его интенсивности определяли интегральную АОА растительных фракций, поскольку, чем они активнее, тем меньше супероксид-анион радикалов оставалось на взаимодействие с катион-радикалами люминола, и интенсивность излучения, следовательно, тоже была меньше, и наоборот.
В зависимости от значений параметра ACW (таблица) изученные образцы можно разделить на две группы. К первой относятся Pentaphylloides fruticosa (L.) O. Schwarz и Filipendula ulmaria (L.) Maxim. (соцветия). Они достоверно не отличаются между собой по ACW показателю, среднее значение составило 820,31±14,57 нмоль/мг, что выше соответствующего аналога для Mentha piperita L. и Filipendula ulmaria (L.) Maxim. (трава).
Таблица. ACW и ACL показатели растительных образцов
|
Образец |
ACW, нмоль/мг |
ACL, нмоль/мг |
|
Pentaphylloides fruticosa (L.) O. Schwarz |
826,55±26,91 |
582,41±11,52 |
||
Mentha piperita L. |
|
|
605,41±0,47 |
521,00±28,96 |
Filipendula ulmaria |
|
соцветия |
814,07±2,24 |
440,82±21,27 |
(L.) Maxim. |
|
трава |
658,58±9,67 |
435,10±26,60 |
220
